宫颈癌患者凝血指标与肿瘤临床病理特征的相关性研究*
2015-02-21陈本均何茂兰冉约曼赵小卫
陈本均,何茂兰,冉约曼,赵小卫
(重庆市大足区人民医院妇产科,重庆 大足 402360)
女性生殖系统恶性肿瘤严重威胁着全世界广大妇女的健康与生命,宫颈癌是其中第二大最常见恶性肿瘤,已成为全球女性癌症死亡的主要因素之一。据统计,全球每年约有30万人死于宫颈癌[1]。研究表明恶性肿瘤患者死亡的两大主要原因包括多发性远处转移和并发血栓性疾病[2],且高凝血状态、血栓形成以及微循环障碍是恶性肿瘤患者的常见体征,约95%的恶性肿瘤患者都有一项或多项凝血功能异常[3]。因此作为恶性肿瘤患者的常见并发症,近年来凝血功能异常受到了越来越多的关注。本研究通过对2009年至2013年118例宫颈病变患者的临床资料进行回顾性分析,以探讨宫颈癌患者各项凝血指标与肿瘤临床病理特征的相关性,为临床处理恶性肿瘤的相关性并发症问题提供参考。
1 资料与方法
1.1 一般资料:选取2009年1月至2013年12月于本院住院治疗的的宫颈病变患者118例,年龄29-73岁,平均48.7±13.9岁。所有患者均经病理确诊,其中根据宫颈癌病理演变过程分类包括:27例正常宫颈组织,33例宫颈癌前病变组织和58例宫颈鳞癌组织,正常宫颈组织来源于因子宫肌瘤、子宫脱垂等非肿瘤性病变行子宫切除术的患者,宫颈癌前病变组织和宫颈鳞癌均来源于因宫颈病变行子宫全切术和宫颈锥切术的患者。另外根据2000年国际妇产科协会(FIGO)的分类法,将宫颈鳞癌又分为Ⅰ-Ⅱ期32例,Ⅲ-Ⅳ26例。所有样本均已取宫颈组织进行了病理活检确诊,且所有患者手术之前均未接受任何形式的放疗、化疗、生物学治疗以及局部物理治疗且均不并发严重心、肝、肾等脏器疾病。
1.2 实验方法
1.2.1 血浆各凝血指标测定:采用ACL-TOP全自动血凝分析仪(美国贝克曼-库尔特公司)进行凝血指标检测。具体流程为:清晨采集患者空腹静脉血3mL加入100mmoL/L枸橼酸钠0.5mL充分混匀后,3000r/min离心15min,取血浆备用。之后采用凝固法测定血浆凝血酶原时间(TP)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(Fib),采用乳胶颗粒免疫浊度分析法测定D-二聚体水平,所有操作严格按照试剂盒说明操作,且均在2h内完成。
1.2.2 血小板参数测定:采用全自动血细胞分析仪(Sysmex3000型)进行血小板指标测定。具体流程为:清晨于抗凝管中釆集患者空腹静脉血2mL,抗凝剂为乙二胺四乙酸二钾,充分混匀后于2h内完成血小板(PLT)参数测定。
1.3 统计学分析:应用SPSS19.0统计软件进行数据处理,以a=0.05为标准,所测数值以±s表示。组间差异采用t检验,P<0.05被认为差异有统计学意义。
2 结果
2.1 宫颈癌患者各凝血指标与肿瘤病理类型的关系:与正常宫颈相比,宫颈癌前病变(CIN)在各项凝血指标中仅在PT和D-二聚体阳性率上表现有明显的统计学差异(P<0.05),而在 APTT,TT,Fib,PLT 上无显著统计学差异(P>0.05);而宫颈癌患者在TP,APTT,Fib和D-二聚体阳性率上均表现有显著统计学差异(P<0.05),同样在TT,PLT上无显著统计学差异(P>0.05),具体详见表1。
表1宫颈癌患者各凝血指标与肿瘤病理类型的关系(±s)
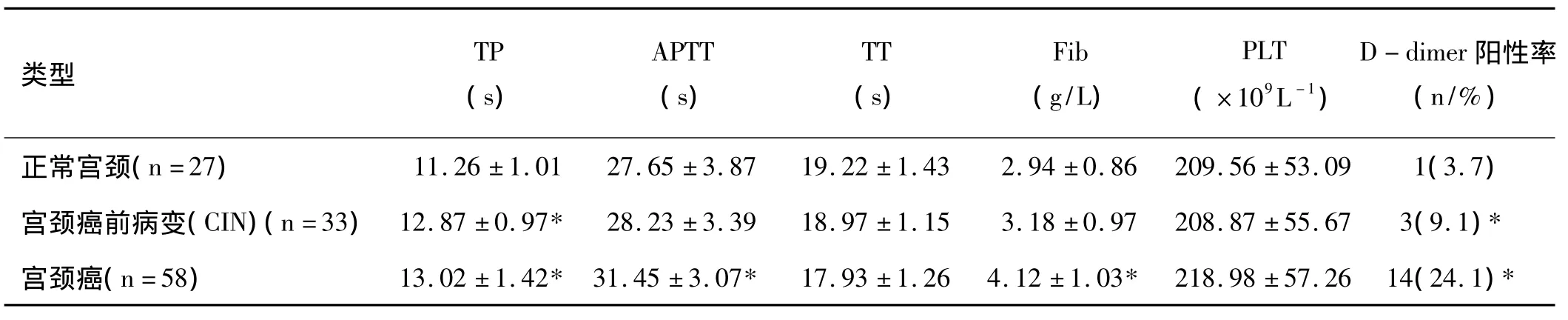
表1宫颈癌患者各凝血指标与肿瘤病理类型的关系(±s)
注:与正常宫颈比较,*表示P<0.05
类型TP(s)APTT(s)TT(s)Fib(g/L)PLT(×109L-1)D-dimer阳性率(n/%)正常宫颈(n=27) 11.26±1.01 27.65±3.87 19.22±1.43 2.94±0.86 209.56±53.09 1(3.7)宫颈癌前病变(CIN)(n=33) 12.87±0.97* 28.23±3.39 18.97±1.15 3.18±0.97 208.87±55.67 3(9.1)*宫颈癌(n=58) 13.02±1.42* 31.45±3.07* 17.93±1.26 4.12±1.03* 218.98±57.26 14(24.1)*
2.2 宫颈癌患者各凝血指标与临床病理特征的关系:在恶性宫颈癌患者中,根据临床病理分期各项凝血指标检测结果显示:与Ⅰ-Ⅱ期相比,Ⅲ-Ⅳ期的TP,APTT,Fib和D-二聚体阳性率均明显升高,差异均具有统计学意义(P<0.05),而 TT,PLT则差异不明显(P>0.05)。此外,经病理检查发现宫颈鳞癌有20例发生了淋巴结转移,38例未发生淋巴结转移。伴有淋巴结转移的患者中TP,APTT,Fib,PLT的含量以及D-二聚体阳性率均明显高于无淋巴结转移的宫颈癌患者,各项差异均具有统计学意义(P<0.05),而只有TT表现差异不明显(P>0.05),详见表2。
表2宫颈癌患者各凝血指标与临床病理特征的关系(±s)

表2宫颈癌患者各凝血指标与临床病理特征的关系(±s)
注:与前一组比较,*表示P<0.05
病理特征 TP(s)APTT(s)TT(s)Fib(g/L)PLT(×109L-1)D-dimer阳性率(n/%)病理分期 Ⅰ-Ⅱ(n=32) 12.15±1.27 28.67±3.86 18.51±1.87 3.23±1.12 214.23±60.23 4(12.5)Ⅲ-Ⅳ(n=26)14.01±1.18* 31.38±3.26* 18.01±1.28 4.26±1.21* 228.41±54.98 10(38.5)*淋巴结转移 无(n=38) 12.08±1.31 28.59±4.03 18.29±2.01 3.13±1.39 207.59±62.08 5(13.2)有(n=20) 13.89±1.07* 31.25±3.53* 17.88±1.95 4.06±0.99*234.37±56.28* 9(45.0)*
3 讨论
恶性肿瘤患者由于全身的代谢、免疫等多种功能的下降以及代偿功能减弱等,会出现一些常见并发症及合并症[4,5]。其中凝血功能障碍,或由肿瘤本身直接引起的包括压迫所致的梗阻、出血等所致,或由肿瘤分解代谢产物所致,已受到越来越多的关注[6]。据报道约有50%以上的癌症患者会发生凝血、抗凝和纤溶系统的异常[7]。其凝血功能异常的原因与肿瘤细胞的侵袭特性及其产物、宿主对肿瘤组织的反应及肿瘤的治疗因素等有密切关系,其可能的机制主要包括:①肿瘤细胞可产生组织因子(TF)和癌促凝物质(CP)两种促凝蛋白[8];②肿瘤环境下血浆纤溶酶原激活物抑制剂-1(PAI-1)抑制了纤溶酶原向纤溶酶的转化,导致高凝状态[9];③肿瘤细胞可通过释放二碟酸腺苷、细胞自溶酸、白介素等物质激活血小板,促进内皮粘附[10];④肿瘤抗原或促凝物质可活化细胞因子,从而激活血小板,诱导TF的表达以及刺激PAI-1通路,促进高凝[11]。
本研究结果显示:恶性宫颈癌患者体内存在血液的高凝状态。恶性宫颈癌患者血浆PT、APTT、Fib含量及D-二聚体阳性率均明显高于正常宫颈患者。晚期肿瘤Ⅲ-Ⅳ期较早期肿瘤Ⅰ-Ⅱ期在PT、APTT、Fib及D-二聚体阳性率均显示显著升高。晚期淋巴结转移患者体内血浆 PT、APTT、Fib、PLT含量及 D-二聚体阳性率均明显高于非淋巴结转移患者。以上结果表明:恶性宫颈癌患者出现凝血指标异常与肿瘤病理类型及肿瘤的分期以及有无淋巴结转移有关。其中Fib、D-二聚体阳性率的变化与国内大多数恶性肿瘤报道一致[12]。Fib是恶性肿瘤细胞浸润导致组织因子(TF)释放后启动凝血系统产生大量凝血酶所致[6];D-二聚体的阳性率高低直接反应机体凝血酶生成的多少和纤溶活性的强弱,是目前公认的临床上判断血浆高凝状态和血栓性疾病的一项特异性指标[13]。除此之外,PT和APTT在恶性宫颈癌中变化也很明显。PT是主要反映外源性凝血功能是否正常的凝血指标,也常用于口服抗凝剂如华法林等药物治疗的监控;APTT则是主要反映内源性凝血系统状况的常用指标,临床主要用于监测肝素用量。两者含量升高的原因均可能是体内凝血因子水平降低或者纤维蛋白原或凝血酶原缺乏,在肿瘤患者体内PT和APTT的显著增高能够说明患者机体内凝血系统已被异常激活。血小板PLT为多功能血细胞,具有黏附、聚集、促凝和收缩血块等功能,当PLT数量增多或聚集功能增强时血液即表现为高凝状态。本研究通过不同比较,仅在宫颈癌伴有淋巴结转移患者中发现PLT含量具有显著性增高,说明只有在恶性程度较高或伴有转移发生时,PLT的含量变化可作为宫颈癌临床病理诊断的一个指标。
综上所述,恶性宫颈癌患者体内的确存在凝血系统功能亢进和继发纤溶的现象。在一般临床实践中,恶性肿瘤患者常合并血栓及相关并发症,容易造成猝死等严重后果,严重影响患者治疗效果、预后效果以及生活质量。目前的临床医疗工作对宫颈癌患者凝血系统异常等相关问题还不够重视,尚未做到对血栓及相关并发症的早期发现和早期诊断,因此会给宫颈癌患者造成不可挽回的恶性后果。
[1] 邹春艳.宫颈癌发生相关危险因素的病例对照研究[J].现代医学,2013,41(7):494-496.
[2] 白丽萍,门剑龙.恶性转移瘤患者高凝状态的研究.中国慢性病预防与控制,2006,14(2):241-242.
[3] 叶正龙,陈劲松,高娜,等.恶性肿瘤病人凝血指标分析及临床意义[J].江西医药,2010,45(7):705-706.
[4] 陈青娟,李曾,柳仲秋,等.宫颈癌合并深静脉血栓30例临床分析[J].现代肿瘤医学,2011,19(4):761-763.
[5] 刘惠莉.妇科肿瘤患者术后发生血栓性疾病的临床分析[J].中国保健营养,2013,4(上):1708.
[6] 陈雪芹,张云.宫颈癌患者凝血功能的检测及意义[J].检验医学与临床,2010,7(21):2317-2318.
[7] Rickles FR,Levine MN.Epidemicology of thrombosis in cancer[J].Acta Haematol,2002,106:6-12.
[8] 王丽丽,徐成伟.恶性肿瘤血栓形成机制的研究进展[J].血栓与止血学,2013,19(5):237-240.
[9] Bruyere F,Melen-Lamalle L,Blacher S,et al.Does plasminogen activator inhibitor-1 drive lymphangiogenesis[J].PLoS One,2010,5(1):9653.
[10] Hoffmann AC,Mori R,Vallbohmer D,et al.High expression of HIFla is a predictor of clinical outcome in patients with pancreatic ductal adenocarcinomas and correlated to PDGFA,VEGF and b-FGF[J].Neoplasia(New York,NY),2008,10(7):674-679.
[11] Chang YT,Chang MC,Wei SC,et al.Serum vascular endothelial growth factor/soluble vascular endothelial growth factor receptor 1 ratio is an independent prognostic marker in pancreatic cancer[J].Pancreas,2008,37(2):145-150.
[12] 喻晓洁,张一清,竺鹏飞.宫颈癌手术前后血浆纤维蛋白原和D-二聚体水平变化[J].中国妇幼保健,2013,28:418-420.
[13] 杨凯乐,孙克佳.血浆D-二聚体水平与宫颈癌的相关性研究[J].河北医学,2012,18(1):102-104.
