血管紧张素抑制剂缬沙坦对膀胱癌细胞表达的影响
2015-02-21杨德林杨定芳颜汝平王海峰韦海荣丁祥黎唐钊然
霍 倩,杨德林,杨定芳,颜汝平,王海峰,韦海荣,丁祥黎,唐钊然
血管紧张素抑制剂缬沙坦对膀胱癌细胞表达的影响
霍 倩,杨德林,杨定芳,颜汝平,王海峰,韦海荣,丁祥黎,唐钊然
目的 探讨缬沙坦对不同侵袭能力的膀胱癌细胞株血管紧张素Ⅱ(Ang Ⅱ) 1型受体(AT1R)抗原、基质金属蛋白酶2(MMP-2)、基质金属蛋白酶9(MMP-9)表达的影响。方法 对三株不同侵袭能力的细胞株EJ-M3、EJ、BIU-87进行培养,使用10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9mol/L缬沙坦的1640培养液作用于细胞株,采用细胞生长状态测定法检测细胞增殖状况,确定最终药物浓度。根据细胞株不同分为EJ-M3组、EJ组、BIU-87组,每组细胞分为实验亚组和对照亚组,实验亚组加入含有10-3mol/L缬沙坦的RPMI-1640培养液,对照亚组仅加入无血清RPMI-1640培养液,培养48 h后抽提相应蛋白和mRNA。采用Western blotting法测定AT1R、MMP-2和MMP-9蛋白表达水平,采用RT-PCR法检测AT1R、MMP-2和MMP-9基因的相对表达。采用细胞划痕实验、Transwell体外细胞侵袭实验检测3种膀胱癌细胞株的迁移能力和侵袭能力的改变。结果 依据MTT实验测定出的生长曲线选择浓度为10-3mol/L的缬沙坦作为最终药物浓度。Western blotting电泳结果显示,AT1R、MMP-2、MMP-9在3个细胞株中均有表达,但均较对照亚组表达明显降低。3组细胞株对照亚组AT1R、MMP-2、MMP-9 mRNA相对表达均高于实验亚组(P<0.05)。3组细胞株实验亚组细胞迁移距离短于对照亚组(t=7.24、6.14、4.30,P<0.01)。3组细胞株实验亚组侵入细胞数量较对照亚组少(t=6.24、4.33、2.81,P<0.01)。结论 缬沙坦可有效抑制膀胱癌细胞AT1R表达,进而抑制MMP-2和MMP-9表达。AT1R抑制剂有可能成为一种新的抑制膀胱癌转移和延长膀胱癌患者生存期的药物。
膀胱肿瘤;受体,血管紧张素,1型;缬沙坦;基质金属蛋白酶类
霍倩,杨德林,杨定芳,等.血管紧张素抑制剂缬沙坦对膀胱癌细胞表达的影响[J].中国全科医学,2015,18(11):1274-1279.[www.chinagp.net]
Huo Q,Yang DL,Yang DF,et al.Influence of angiotensin inhibiter valsartan on the expression of bladder cancer cells[J].Chinese General Practice,2015,18(11):1274-1279.
血管紧张素Ⅱ(Ang Ⅱ)是肾素-血管紧张素系统(renin-angiotensin system,RAS)中一种主要的多功能活性肽,近年来研究发现,Ang Ⅱ不仅调节血压和体液平衡,而且可以作为一种多效应生长因子影响细胞增殖和凋亡、调节细胞因子的基因表达和分泌、增加细胞对生长因子的敏感性,与血管再生关系密切。有研究显示,Ang Ⅱ可以通过激活Ang Ⅱ 1型受体(AT1R)促进基质金属蛋白酶2(MMP-2)、基质金属蛋白酶9(MMP-9)的表达,促进肿瘤组织的侵袭和转移能力[1]。本研究使用AT1R抑制剂缬沙坦作用于3株膀胱癌细胞株,观察其对细胞增殖、侵袭及迁移能力的影响以及AT1R与MMP-2、MMP-9蛋白和基因表达的关系,探讨Ang Ⅱ抑制剂对膀胱癌侵袭转移的抑制作用。
1 材料与方法
1.1 材料 膀胱癌细胞株高侵袭力亚系EJ-M3(由前期实验筛选获取),膀胱癌细胞株EJ细胞(由北京大学泌尿外科研究所余莉章教授惠赠),膀胱癌细胞株BIU-87(购自中国科学院昆明动物所细胞室),RPMI-1640培养液、胰蛋白酶(美国Gibco公司),胎牛血清(上海依科赛生物工程有限公司),鼠抗人AT1R、MMP-2、MMP-9单克隆抗体(美国Santa Cruz公司),辣根过氧化酶(HRP)标记的羊抗鼠二抗(美国Santa Cruz公司),内参抗体β-tubulin(北京博奥森生物技术有限公司),Trizol、M-MLV第一链合成试剂盒(美国Invitrogen公司),SYBR®Green Realtime PCR Master Mix(上海TOYOBO公司),Western blotting配胶、电泳及转膜液试剂盒(上海碧云天生物技术有限公司),Western blotting发光试剂(北京中杉中桥生物技术有限公司)。
1.2 方法
1.2.1 细胞培养 3株膀胱癌细胞EJ-M3、EJ、BIU-87生长于含有10%胎牛血清、1%双抗的RPMI-1640培养液中,5% CO2培养箱中37 ℃培养,实验所用细胞均处于对数生长期。
1.2.2 细胞生长状态测定 取处于对数生长期状态良好的细胞,常规消化、分离、收集细胞及细胞计数,按每孔5×103个细胞接种于96孔板中,每种细胞株设5个复孔,贴壁后无血清培养细胞24 h,使细胞同步化,弃去原培养液,每种细胞株分别加入含10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9mol/L缬沙坦的1640培养液200 μl(作为实验标本),RPMI-1640培养液200 μl(作为对照标本),设调零孔,在37 ℃、5% CO2及饱和湿度条件下培养48 h,每孔加入MTT溶液20 μl,继续培养4 h。弃去含MTT的上清液,然后每孔加入DMSO 150 μl,震荡5 min,充分溶解formazan结晶。把96孔板放在酶标仪上进行检测,比色测定波长为490 nm吸光值(OD值),然后计算3株细胞的生长抑制率,抑制率(%)=(1-实验标本平均OD值/对照标本平均OD值)×100%。
1.2.3 分组根据 根据MTT实验测定出的生长曲线选择浓度为10-3mol/L的缬沙坦作为最终药物浓度。根据细胞株不同分为EJ-M3组,EJ组,BIU-87组,每组细胞分为实验亚组和对照亚组,取对数生长期的细胞接种在6孔板无血清培养12 h,实验亚组加入含有10-3mol/L缬沙坦的RPMI-1640培养液,对照亚组只加入无血清RPMI-1640培养液,在37 ℃、5% CO2及饱和湿度条件下培养48 h,抽提相应蛋白和mRNA。
1.2.4 Western blotting法 细胞经药物处理后,用RIPA蛋白裂解液裂解细胞提取蛋白质并检测蛋白浓度。配置10%聚丙烯酰胺分离胶及5%积成胶。取总蛋白100 μg变性后加样,90 V条件下电泳,电泳缓冲液为Tris-甘氨酸;然后在100 V、4 ℃条件下进行电转膜2 h,分别加入鼠抗人AT1R、MMP-2、MMP-9单克隆抗体(1∶1 000),4 ℃过夜;在分别加入羊抗鼠IgG(1∶2 000),特异性蛋白信号条带的观察使用ECL化学发光检测试剂,胶片成像。
1.2.5 RT-PCR法 应用Primer Express软件设计基因特异性PCR引物序列(见表1),采用Trizol提取细胞总RNA。然后严格按照反转录试剂盒说明书将RNA反转录成cDNA。每一个样品均进行3个重复反应。同时设无模板对照。在荧光定量PCR仪上进行检测。反应条件:95 ℃ 60 s;95 ℃ 30 s、60 ℃ 30 s,40个循环;扩增完毕后进行熔解曲线分析:95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s。分析3株膀胱癌细胞株AT1R、MMP-2和MMP-9 mRNA的相对表达情况。采用ΔΔCT法进行相对定量分析,ΔCT值为目的基因CT值(循环数)与管家基因GAPDH CT值(循环数)的差值,ΔΔCT为各实验亚组ΔCT与选择的对照亚组ΔCT的差值。平均相对含量=2-ΔΔCT,为相对于对照亚组的mRNA水平。

表1 RT-PCR引物序列
注:AT1R=血管紧张素Ⅱ 1型受体,MMP-2=基质金属蛋白酶2,MMP-9=基质金属蛋白酶9
1.2.6 细胞划痕实验 采用记号笔在6孔板背后利用直尺均匀划5条横线,每个实验亚组均设3个平行样本。3株膀胱癌细胞以5×105/孔接种于6孔板中,置于37 ℃、5% CO2培养箱内培养24 h,待细胞贴壁率为100%时,用枪头比着直尺,尽量垂直于背后的横线划痕,枪头要垂直,不能倾斜。用磷酸盐缓冲液(PBS)清洗细胞3次,去除划下的细胞,实验亚组加入含有10-3mol/L缬沙坦的RPMI-1640培养液,对照亚组加入无血清培养基放入37 ℃、5% CO2培养箱继续培养24 h。在光学显微镜下观察划痕修复过程,取24 h为时间点拍照记录。
1.2.7 Transwell细胞小室检测细胞侵袭能力 取对数生长期细胞,以含10%胎牛血清的RPMI-1640培养液继续培养,将液化的Matrigel与预冷无血清的RPMI-1640培养液按1∶8稀释,配足量(冰浴上操作),然后加入上室各100 μl,放入37 ℃培养箱中2~4 h使其成胶;在实验亚组下室中预先加入600 μl含10-3mol/L缬沙坦的RPMI-1640培养液,对照亚组加600 μl RPMI-1640培养液;将细胞悬浮计数后调整细胞密度为5×105个/ml,用无血清培养基洗Matrigel胶1次,取细胞悬液100 μl/孔加入上室,设3个重复孔,37 ℃、5% CO2条件下培养24 h;取出Transwell小室,用PBS洗2次并用棉签小心刮除上室细胞,用冰预冷的甲醇固定30 min;苏木精-伊红染色5 min,PBS洗2次;染色后光学显微镜下计数膜背面侵袭的细胞数量,随机计数中间和四周共5个视野,每组细胞计数3份,取平均值。

2 结果
2.1 细胞生长状态 使用10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9mol/L缬沙坦处理过的细胞,EJ-M3的抑制率分别是97.42%、68.21%、65.84%、58.25%、56.83%、36.81%、24.30%、13.39%;EJ的抑制率分别是89.54%、41.67%、38.69%、34.06%、22.58%、19.70%、16.57%、8.25%;BIU-87的抑制率分别是85.74%、46.09%、44.75%、30.15%、28.43%、20.16%、17.29%、6.15%。
2.2 AT1R、MMP-2、MMP-9蛋白表达 Western blotting电泳结果显示,AT1R、MMP-2、MMP-9在3个细胞株中均有表达,但均较对照亚组表达明显降低(见图1)。

注:1= EJ-M3对照亚组,2= EJ-M3实验亚组,3= EJ对照亚组,4= EJ实验亚组,5= BIU-87对照亚组,6= BIU-87实验亚组;AT1R=血管紧张素Ⅱ 1型受体,MMP-2=基质金属蛋白酶2,MMP-9=基质金属蛋白酶9
图1 3组细胞株实验亚组和对照亚组AT1R、MMP-2和MMP-9蛋白的表达
Figure 1 The protein expression of AT1R、MMP-2 and MMP-9 in three cells between experiment subgroup and control subgroup
2.3 AT1R、MMP-2、MMP-9 mRNA表达 3组细胞株对照亚组AT1R、MMP-2、MMP-9 mRNA相对表达均高于实验亚组,差异有统计学意义(P<0.05,见表2~4)。

Table 2 Comparison of expression of AT1R mRNA in three cells between experiment subgroup and control subgroup

组别EJ-M3EJBIU-87对照亚组8.32±0.316.28±0.615.52±0.22实验亚组3.39±0.143.31±0.192.59±0.24t值21.436.5712.73P值<0.001<0.010<0.001
2.4 细胞划痕实验 划痕实验结果显示:划痕处理24 h后,EJ-M3对照亚组和实验亚组细胞的迁移距离分别为(2.28±0.07)、(1.57±0.12)μm。EJ对照亚组和实验亚组细胞的迁移距离分别为(1.66±0.13)、(1.07±0.04)μm。BIU-87对照亚组和实验亚组细胞的迁移距离分别为(1.24±0.09)、(0.81±0.11)μm。与对照亚组相比,实验亚组细胞迁移距离降低,差异有统计学意义(t=7.24、6.14、4.30,P<0.01,见图2)。

Table 3 Comparison of expression of MMP-2 mRNA in three cells between experiment subgroup and control subgroup

组别EJ-M3EJBIU-87对照亚组8.77±0.586.31±0.412.37±0.02实验亚组4.91±0.233.86±0.430.85±0.05t值8.7713.888.94P值<0.01<0.01<0.01

Table 4 Comparison of expression of MMP-9 mRNA in three cells between experiment subgroup and control subgroup
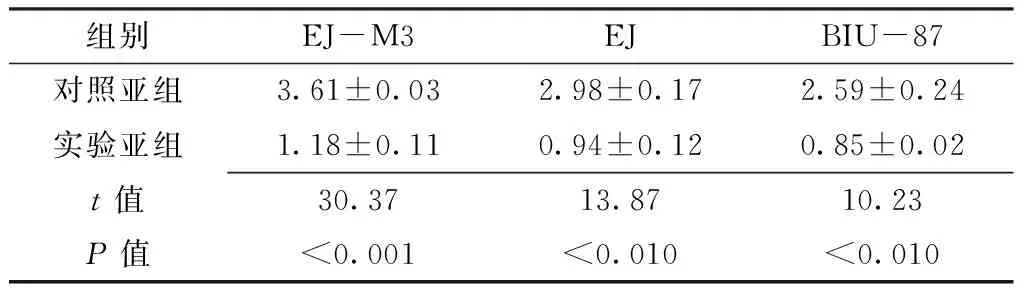
组别EJ-M3EJBIU-87对照亚组3.61±0.032.98±0.172.59±0.24实验亚组1.18±0.110.94±0.120.85±0.02t值30.3713.8710.23P值<0.001<0.010<0.010
2.5 细胞株细胞基质侵袭能力 Transwell细胞小室检测细胞侵袭能力结果显示:EJ-M3实验亚组侵入细胞数量为(154.28±6.24)个,对照亚组为(233.39±8.18)个;EJ实验亚组为(107.88±6.38)个,对照亚组为(150.05±4.73)个;BIU-87实验亚组为(50.81±3.41)个,对照亚组为(87.19±5.56)个。3组细胞株实验亚组侵入细胞数量较对照亚组少,差异有统计学意义(t=6.24、4.33、2.81,P<0.01,见图3)。
3 讨论
膀胱癌是我国最常见的泌尿生殖系统肿瘤之一,其发病率和病死率均占泌尿系肿瘤的首位,且有逐年增加的趋势。膀胱癌的主要生物学特性是易发生浸润和转移,且术后复发率高[2]。恶性肿瘤的浸润和转移是一个多步骤、多阶段的复杂过程。在这个过程中,肿瘤细胞侵袭细胞外基质的过程可描述为三个步骤:依附、基质降解和迁移。首先肿瘤细胞附着到基质,然后肿瘤细胞直接分泌某种蛋白酶,降解细胞外基质。这种蛋白酶可以降解基质结构的胶原蛋白和附着蛋白。最后肿瘤细胞横跨基底膜和基质通过该区域。浸润细胞外基质是通过这三个步骤的循环完成的[3]。在肿瘤细胞分泌的蛋白水解酶中,MMP-2和MMP-9占有重要地位。MMPs能够降解几乎所有的细胞外基质成分和肿瘤细胞周围的结缔组织与基底膜,在肿瘤侵袭转移中起关键性作用。

注:A=EJ-M3对照亚组,B=EJ-M3实验亚组,C=EJ对照亚组,D=EJ实验亚组,E=BIU-87对照亚组,F=BIU-87实验亚组
图2 3组细胞株实验亚组和对照亚组细胞划痕实验结果(×200)
Figure 2 The result of cell wound scratch test of three cell lines of experiment subgroup and control subgroup
MMPs可以促进肿瘤新生血管的形成,大量研究证实,实体肿瘤的进一步生长、浸润及血行转移有赖于肿瘤新生血管的形成。肿瘤血管生成是一个非常复杂的过程,大致分为三个步骤:(1)血管周围细胞外基质的降解;(2)内皮细胞的迁移、增殖;(3)毛细血管的分化吻合。血管内皮生长因子(VEGF)对血管生成的多个环节,如血管内皮细胞增殖、分化、迁移和管腔状结构的形成,血管内皮基底膜的降解等均有明显的促进作用。众多研究表明,MMP-9能够促进VEGF合成,MMP-2和MMP-9的表达与结直肠癌新生血管形成有密切关系,能够分泌产生MMP-2和MMP-9的肿瘤细胞具有较强的侵袭转移能力[4-6]。Qiao等[7]研究结果表明,在肾细胞癌组织中MMP-2和MMP-9 mRNA的表达量明显高于正常肾组织。隋锐等[8]通过免疫组织化学方法分别检测脑胶质瘤标本和正常脑组织MMP-2和MMP-9的表达情况,发现脑胶质瘤标本的表达比正常脑组织的表达高,并随病理分期的增高而增高。

注:G=EJ-M3对照亚组,H=EJ-M3实验亚组,I=EJ对照亚组,J=EJ实验亚组,K=BIU-87对照亚组,L=BIU-87实验亚组
图3 3组细胞株实验亚组和对照亚组细胞株侵袭能力(苏木精-伊红染色,×200)
Figure 3 The invasion ability of in three cells between experiment subgroup and control subgroup
肾素-血管紧张素-醛固酮(RAS)系统中,通过血管紧张素转化酶(angiotensin converting enzyme,ACE)的作用使血管紧张素Ⅰ(AngⅠ)水解产生血管紧张素Ⅱ(AngⅡ),AngⅡ通过与其受体结合而发挥生物学效应。AngⅡ受体包括AT1R和AT2R。AT1R大多分布于血管、心、脑、肾及肝脏中,而AT2R主要分布于胚胎组织、肾上腺髓质、子宫、卵泡中[9]。Ang Ⅱ可通过激活AT1R发挥促肿瘤生长转移作用[10],最近发现AT1R在多种肿瘤组织中表达,AT1R在乳腺癌、前列腺癌和胰腺癌等多种肿瘤细胞和组织中有高水平表达[11-13]。Akhavan等[14]采用免疫印迹方法分析在黑色素瘤中通过AngⅡ表达的不同的影响因子,发现在B16F10黑色素瘤细胞中AngⅡ通过激活AT1R可以促进MMP-2,MMP-3和VEGF的表达,而不能促进MMP-9的表达,从而使得血管紧张素受体拮抗剂在肿瘤的药物治疗中扮演重要的角色。
为了解AT1R拮抗剂缬沙坦在膀胱癌中的作用,探讨以AT1R为靶点治疗膀胱癌的可能性,本研究采用MTT实验检测不同浓度缬沙坦对细胞株的影响,选出最佳浓度为10-3mol/L缬沙坦作用于细胞进行后续试验。分别采用Western blotting和RT-PCR实验方法检测3种细胞株用药前后AT1R、MMP-2、MMP-9蛋白表达和基因表达。Western blotting检测结果显示,经过10-3mol/L缬沙坦处理过的细胞其蛋白表达均下降,3种细胞株的实验亚组较对照亚组表达明显降低。RT-PCR检查显示,经过10-3mol/L缬沙坦处理过的细胞与对照亚组比较mRNA表达下降,本研究分别从转录水平和蛋白水平进一步证实了不同侵袭能力的膀胱癌细胞株中AT1R、MMP-2和MMP-9的表达,而且这种表达可被AT1R拮抗剂所阻断。
肿瘤细胞侵袭力是影响患者预后及生存率的关键因素。本研究通过Transwell细胞小室检测经过10-3mol/L缬沙坦处理过的细胞与对照亚组侵袭能力的改变。光学显微镜下观察计数膜背面细胞侵入3种细胞株细胞的数量,实验亚组较对照亚组侵入细胞数量明显减少,提示缬沙坦可以降低膀胱肿瘤的侵袭能力。
迁移在肿瘤细胞转移过程中也必不可少。肿瘤细胞与母体瘤分离,穿过血管壁、侵袭正常组织,需要一定的运动能力。研究已表明缬沙坦与膀胱癌细胞的迁移有密切的关系。本研究方法借鉴体外细胞致伤愈合实验模型测定肿瘤细胞在细胞外基质上的运动特性,结果显示,划痕处理24 h后,3种细胞株的实验亚组与对照亚组比较迁移距离缩短,提示缬沙坦作用于细胞后可以抑制膀胱肿瘤细胞的迁移能力。
综上所述,AT1R与膀胱癌细胞的活性密切相关,通过抑制膀胱癌细胞内AT1R表达从而抑制MMP-2和MMP-9的表达,进而影响膀胱癌细胞增殖、侵袭和迁移能力。本研究提示血管紧张素抑制剂缬沙坦可为预防和治疗膀胱癌侵袭和转移提供新思路,通过阻断AT1R而抑制肿瘤生长和血管生成将可能会成为一种对抗癌症的行之有效的策略。
来自本文更多的信息:
本研究后续实验将膀胱癌细胞种植于裸鼠体内观察裸鼠致瘤率情况,并且使用不同剂量缬沙坦饲养裸鼠,从而进一步证实血管紧张素抑制剂对肿瘤血管形成的影响。
[1]Huang W,Yu LF,Zhong J,et al.Angiotensin Ⅱ type 1 receptor expression in human gastric cancer and induces MMP2 and MMP9 expression in MKN-28 cells[J].Dig Dis Sci,2008,53(1):163-168.
[2]Al Hussain TO,Akhtar M.Molecular basis of urinary bladder cancer[J].Adv Anat Pathol,2013,20(1):53-60.
[3]Kohn EC,Liotta LA.Molecular insights into cancer invasion:strategies for prevention and intervention[J].Cancer Res,1995,55(9):1856-1862.
[4]Said AH,Raufman JP,Xie G.The role of matrix metalloproteinases in colorectal cancer[J].Cancers(Basel),2014,6(1):366-375.
[5]Kostova E,Slaninka-Miceska M,Labacevski N,et al.Expression of matrix metalloproteinases 2,7 and 9 in patients with colorectal cancer[J].Vojnosanit Pregl,2014,71(1):52-59.
[6]Groblewska M,Mroczko B,Gryko M,et al.Serum levels and tissue expression of matrix metalloproteinase 2(MMP-2)and tissue inhibitor of metalloproteinases 2(TIMP-2)in colorectal cancer patients[J].Tumour Biol,2014,35(4):3793-3802.
[7]Qiao ZK,Li YL,Lu HT,et al.Expression of tissue levels of matrix metalloproteinases and tissue inhibitors of metalloproteinases in renal cell carcinoma[J].World J Surg Oncol,2013(11):1.
[8]隋锐,张烨,陈一,等.MMP-2及MMP-9联合检测在脑胶质瘤中的诊断价值[J].中国实验诊断学,2014,18(2):205-206.
[9]Atlas SA.The renin-angiotensin aldosterone system:pathophysiological role and pharmacologic inhibition[J].J Manag Care Pharm,2007,13(8 Suppl B):9-20.
[10]Suganuma T,Ino K,Shibata K,et al.Functional expression of the angiotensin Ⅱ type 1 receptor in human ovarian carcinoma cells and its blockade therapy resulting in suppression of tumor invasion,angiogenesis,and peritoneal dissemination[J].Clin Cancer Res,2005,11(7):2686-2694.
[11]Guimond MO,Battista MC,Nikjouitavabi F,et al.Expression and role of the angiotensin Ⅱ AT2 receptor in human prostate tissue:in search of a new therapeutic option for prostate cancer[J].Prostate,2013,73(10):1057-1068.
[12]Du N,Feng J,Hu LJ,et al.Angiotensin Ⅱ receptor type 1 blockers suppress the cell proliferation effects of angiotensin Ⅱ in breast cancer cells by inhibiting AT1R signaling[J].Oncol Rep,2012,27(6):1893-1903.
[13]Masamune A,Hamada S,Kikuta K,et al.The angiotensin Ⅱ type I receptor blocker olmesartan inhibits the growth of pancreatic cancer by targeting stellate cell activities in mice[J].Scand J Gastroenterol,2013,48(5):602-609.
[14]Akhavan MM,Karimi M,Ghodrati M,et al.AT1 receptors activation enhances the expression of MMP-2,MMP-13 and VEGF but not MMP-9 in B16F10 melanoma cells[J].Pak J Biol Sci,2011,14(17):821-830.
(本文编辑:贾萌萌)
Influence of Angiotensin Inhibiter Valsartan on the Expression of Bladder Cancer Cells
HUOQian,YANGDe-lin,YANGDing-fang,etal.
DepartmentofUrinarySurgery,theSecondAffiliatedHospitalofKunmingMedicalUniversity,Kunming650101,China
Objective To study the effect of Valsartan on angiotensin Ⅱ inhibitors(AngⅡ)type 1 receptor (AT1R)antigen,matrix metalloproteinase-2(MMP-2),matrix metalloproteinase-9(MMP-9)in bladder cancer(BC)cell lines of different invasive abilities.Methods Three cell strains(EJ-M3,EJ,BIU-87)of different invasive abilities were cultured.This study used Valsartan (10-2,10-3,10-4,10-5,10-6,10-7,10-8,10-9mol/L)to effect on cell lines in 1640 culture solutions,used cell growth status assay to detect cell proliferation to determine the final drug concentration.The cell strains were divided into groups EJ-M3,EJ,BIU-87,and each group subdivided into subgroups study,control.Valsartan RPMI-1640 culture solution containing 10-3mol/L was added into study subgroup,serum-free RPMI-1640 culture into control subgroup and corresponding protein and mRNA were extracted after 48 h of culture.The expressions of AT1R,MMP-2,MMP-9 proteins were determined by Western blotting,the relative expressions of AT1R,MMP-2,MMP-9 genes by RT-PCR method.The changes of the abilities of transfer,invasion of 3 BC cell lines were detected by cell wound scratch test,Transwell in vivo cell invasion assay.Results The growth curve measured by MTT assay chose the valsartan of 10-3mol/L as final drug concentration.By Western blotting electrophoresis AT1R,MMP-2,MMP-9 were expressed in 3 cell lines,but lower than in control subgroups.The relative expressions of MMP-2,MMP-9 mRNA were higher in control subgroups than in study subgroups(P<0.05).The transfer distances were shorter in study subgroups than in control subgroups(t=7.24,6.14,4.30,P<0.01).The invasive cell number was fewer in study subgroups than in control subgroups(t=6.24,4.33,2.81,P<0.01).Conclusion Valsartan can inhibit the expression of AT1R effectively,thus to inhibit the expressions of MMP-2,MMP-9.AT1R inhibitor may become a new drug inhibiting BC metastasis and prolonging patients′ life span.
Bladder cancer;Receptor,angiotensin,type 1;Valsartan;Matrix metalloproteinases
云南省科技厅资助项目(2011FB197)——昆明医科大学联合专项
650101云南省昆明市,昆明医科大学第二附属医院泌尿外科 云南省泌尿外科研究所(霍倩,杨德林,颜汝平,王海峰,韦海荣,丁祥黎,唐钊然);保山中医药高等专科学校(杨定芳)
杨德林,650101云南省昆明市,昆明医科大学第二附属医院泌尿外科 云南省泌尿外科研究所;E-mail:ydelin@163.com
R 737.14
A
10.3969/j.issn.1007-9572.2015.11.011
2014-11-08;
2015-01-20)
