柚皮素脂质体冻干粉的制备及其药效学评价
2015-02-19赵文明
季 鹏,赵文明
辽宁医学院药学院,辽宁锦州 121000
柚皮素脂质体冻干粉的制备及其药效学评价
季鹏,赵文明
辽宁医学院药学院,辽宁锦州 121000
摘要:目的制备柚皮素脂质体冻干粉,并观察其对急性肺损伤(ALI)大鼠模型的治疗效果。方法乙醇注入法制备柚皮素脂质体并进行质量评价,加入冻干保护剂甘露醇(5%,W/V),冻干并进行相关粉体学评价。大鼠气管喷注脂多糖(LPS)(5 mg/kg)制备急性肺损伤模型,将48只SD雌性大鼠随机分成6组(n=8),分别为空白对照组(A组)、模型组(B组)、柚皮素原料药+LPS组(C组)、脂质体冻干粉+LPS组(D组)、地塞米松+LPS组(E组)和空白脂质体冻干粉+LPS组(F组),光学显微镜观察给药后各组大鼠肺组织形态学改变,并测定肺组织湿/干重比。结果最佳处方制得的柚皮素脂质体包封率为(82.44±0.98)%,平均粒径为(133±11)nm,Zeta电位为(-35.9±5)mV。冻干粉的休止角为36°,堆密度为0.3 g/ml。光镜观察结果显示,与A组空白对照比较,B~F组肺组织均出现不同程度炎性细胞的浸润、毛细血管充血、出血和肺泡壁增厚,其中以B组和F组改变最为显著,C组次之,D组和E组最轻。LPS诱导后B~F组肺组织湿/干重比均有不同程度增加,但D组和E组湿/干重比的增加量明显低于B组(P=0.0012,P=0.0018)。结论乙醇注入法制备柚皮素脂质体工艺简单可行,其冻干粉对大鼠急性肺损伤疗效显著。
关键词:柚皮素;脂质体;冷冻干燥;急性肺损伤
ActaAcadMedSin,2015,37(2):208-214
柚皮素(4’,5,7-三羟基二氢黄酮)是一类天然二氢黄酮类化合物。该类物质广泛存在于水薄荷[1]、大戟属植物[2]、枳实[3]等植物中。现代药理学研究表明,柚皮素具有广泛的生物活性,包括抗炎、抗氧化、抗肿瘤、抗肺损伤等作用[4]。但是,由于柚皮素水溶性较差、口服生物利用度较低以及体内半衰期短,限制了其临床应用。据文献报道柚皮素在兔体内的生物利用度以游离柚皮素计算仅为4%[5]。目前,制备柚皮素合适的制剂,提高其生物利用度是药剂学工作者亟待解决的问题。脂质体是一种具有类似生物膜结构的双分子层囊泡,主要由磷脂和胆固醇构成,其作为药物载体具有很多优势,如可以增加药物的溶解性,提高药物的生物利用度和减少药物的治疗剂量等。目前,国内外柚皮素脂质体的相关研究报道较少,本研究采用乙醇注入法制备柚皮素脂质体,再经冷冻干燥制备成柚皮素粉雾剂,测定该脂质体及其冻干粉的理化性质;同时,通过建立大鼠急性肺损伤(acute lung injury,ALI)模型,观察柚皮素游离药的药效学特性,为柚皮素治疗急性肺损伤提供实验数据。
材料和方法
材料SPF级SD雌性大鼠48只,体重(180~220)g,平均体重(200±20)g,由辽宁医学院实验动物中心提供,实验前动物适应环境至少3 d。室温保持在25 ℃,自由进食和饮水。柚皮素(质量分数≥98%,南京康维盛生物技术有限公司);脂多糖(lipopolysaccharide,LPS)(美国Sigma公司);大豆卵磷脂(上海太伟药业有限公司,批号:20130427);甲醇和乙腈为色谱纯;其他试剂均为国产分析纯或药用。L- 2000Elite型高效液相色谱仪(日立高新技术公司);TU- 1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);Mastersizer2000激光粒度测定仪(英国Malvern公司);JEM- 1400高衬度透射电子显微镜(日本电子株式会社);LGJ- 30F型冷冻干燥机(北京松源华兴科技发展有限公司)。
柚皮素脂质体的处方优化根据预实验和单因素考察,筛选出磷脂浓度(g/ml)、柚皮素和磷脂重量比(简称药脂比)(W/W)、缓冲液pH值、溶解温度(℃)为主要考察因素,每个因素又选取3个水平,以包封率为评价指标,L9(34)正交试验法优化脂质体的制备。
乙醇注入法制备柚皮素脂质体按最优处方,精密称取柚皮素原料药3 mg,大豆磷脂60 mg和胆固醇20 mg溶于适量的乙醇中,在涡旋条件下将所得混合液迅速注入55 ℃的10 ml 磷酸盐缓冲液(phosphate buffered saline,PBS)(pH=7.4)溶液中,超声1 min后倒入小烧杯,在磁力搅拌器上搅拌30 min,除去少量乙醇,得到淡蓝色混悬液,过0.45 μm微孔滤膜,即得柚皮素脂质体,4 ℃下保存,备用。空白脂质体除不加药物外,其他条件一样。
脂质体含量测定精密称取柚皮素标准品5 mg,加入到50 ml容量瓶中,乙醇稀释定容,得到0.1 mg/ml的储备液。乙醇逐步稀释成质量浓度为 1、5、10、20、40、80 μg/ml的系列标准溶液。采用高效液相色谱法测定。
色谱条件:色谱柱为Hypersil BDS C18柱(200 mm×4.6 mm,5 μm);流动相为乙腈-水(40∶60);检测波长288 nm;柱温40 ℃;流速1.0 ml/min;进样量20 μl。
专属性实验:加入适量甲醇破乳,55 ℃恒温摇床振荡15 min,得到澄清透明溶液即可。分别取空白脂质体破乳后溶液(α)、柚皮素标准溶液(β)以及柚皮素脂质体破乳后溶液(γ),0.45 μm滤膜过滤后取滤液20 μl,按上述色谱条件进样测定。
药物含量的测定:取2 ml脂质体混悬液于10 ml容量瓶中,加甲醇适量破乳,超声约5 min使澄清后,甲醇稀释至刻度,0.45 μm滤膜过滤后取滤液20 μl进样,按上述色谱条件测定样品峰面积,计算药物含量。
脂质体包封率的测定采用微型凝胶柱离心法[6]。精密称取脂质体混悬液2 ml于10 ml量瓶中,加甲醇适量破乳,超声5 min,澄清后甲醇稀释至刻度,进样,计算总的药物含量(W0)。取2 ml加至Sephadex G- 50凝胶微柱的顶端后离心3 min(2000 r/min,离心半径为6.1 cm),再加入PBS 0.5 ml离心3 min(2500 r/min,离心半径为6.1 cm),收集洗脱液于10 ml量瓶中,重复2次,加入适量甲醇超声破乳,后用甲醇稀释至刻度,进样,计算药物的质量浓度(W1)。根据公式计算包封率(EE%):EE%=W1/W0× 100%。式中,W1为包封在脂质体中的柚皮素质量浓度;W0为脂质体中柚皮素的总质量浓度。
初步稳定性考察取柚皮素脂质体混悬液3批,在(4±2)℃条件下放置 2个月,分别于0、1、2个月末取样并观察外观,用纳米激光粒度仪测量粒径,用微型凝胶柱离心法测量包封率。
脂质体冻干粉的制备及质量考察在脂质体制备过程中,先将5%(W/V)甘露醇作为冻干保护剂溶解于PBS溶液中,其他过程不变,将制得的柚皮素脂质体混悬液用移液管分装于西林瓶中,冻干即可。
冻干粉相关性质测定:柚皮素冻干粉的休止角、堆密度测定参考第7版《药剂学》[7]。
脂质体冻干前后的形态观察:取柚皮素脂质体混悬液适量,以水为分散介质稀释约10倍,滴于铜网上用2%磷钨酸进行负染,透射电镜下观察其形态;取柚皮素冻干粉样品适量,加PBS溶液适量,振摇至完全分散,同上观察。
粒径和Zeta电位的测定:取100 μl柚皮素脂质体冻干前后混悬液用水稀释至10 ml后,用纳米激光粒度仪测定粒径和Zeta电位。
动物模型的建立及分组用气管内喷注脂多糖(5 mg/kg)建立大鼠ALI模型[8]。将48只SD雌性大鼠随机分成6组,每组8只,分别为空白对照组(A组,气管内喷注生理盐水)、模型组(B组,气管内喷注LPS)、柚皮素原料药+LPS组(C组,气管内喷注LPS前1 h给予柚皮素100 mg/kg,临用前加适量生理盐水分散)、柚皮素脂质体冻干粉+LPS组(D组,气管内喷注LPS前1 h给予柚皮素脂质体冻干粉100 mg/kg),地塞米松+LPS组(E组,气管内喷注LPS前1 h给予地塞米松5 mg/kg)、空白脂质体冻干粉+LPS组(F组,气管内喷注LPS前1 h给予空白脂质体冻干粉100 mg/kg)。每一组注射完后7 h时,用3%水合氯醛腹腔注射麻醉大鼠并解剖,取肺组织测定指标。
肺组织评价指标处死大鼠解剖取出左肺组织,以4%的多聚甲醛固定,常规脱水包埋苏木素-伊红(HE)染色后,光镜下观察肺组织病理学改变[9]。同时取出右上肺叶,立即称湿重,再在80 ℃下加热48 h称干重,计算湿/干重比。
统计学处理采用SPSS 18.0统计软件分析数据,计量资料以均数±标准差表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
结果
柚皮素脂质体优化处方的确定采用4因素3个水平(表 1),根据极差 R可知,各因素对包封率的影响大小依次为:磷脂浓度>药脂比>溶解温度>缓冲液 pH值。再根据均值K,可以确定乙醇注入法制备柚皮素脂质体的最佳处方工艺组合为磷脂的质量浓度为0.06 g/ml,药脂比为1∶20,类脂溶液的溶解温度为55 ℃,缓冲液pH值为7.40(表2)。
柚皮素脂质体含量及包封率经高效液相色谱法测得的柚皮素峰面积(A)对质量浓度(C,μg/ml)进行线性回归,得到柚皮素的回归方程为A=29.95 C+1.13(n=3,r=0.9995)。即柚皮素质量浓度在1~80 μg/ml内与峰面积呈良好的线性关系。低、中、高浓度的回收率分别为100.87%、98.23%和99.16%,相对标准偏差(relative standard deviation,RSD)=1.34%(n=3)。平均日内、日间RSD分别为0.20%、0.54%(n=3)。专属性测定结果可见柚皮素峰值(图1)。按最优处方,测得脂质体中柚皮素质量浓度为(287.75±0.23)μg/ml(n=3),柚皮素脂质体的包封率为(82.44±0.98)%,RSD为0.64%(n=3)。

表 1 柚皮素脂质体处方筛选正交试验因素水平
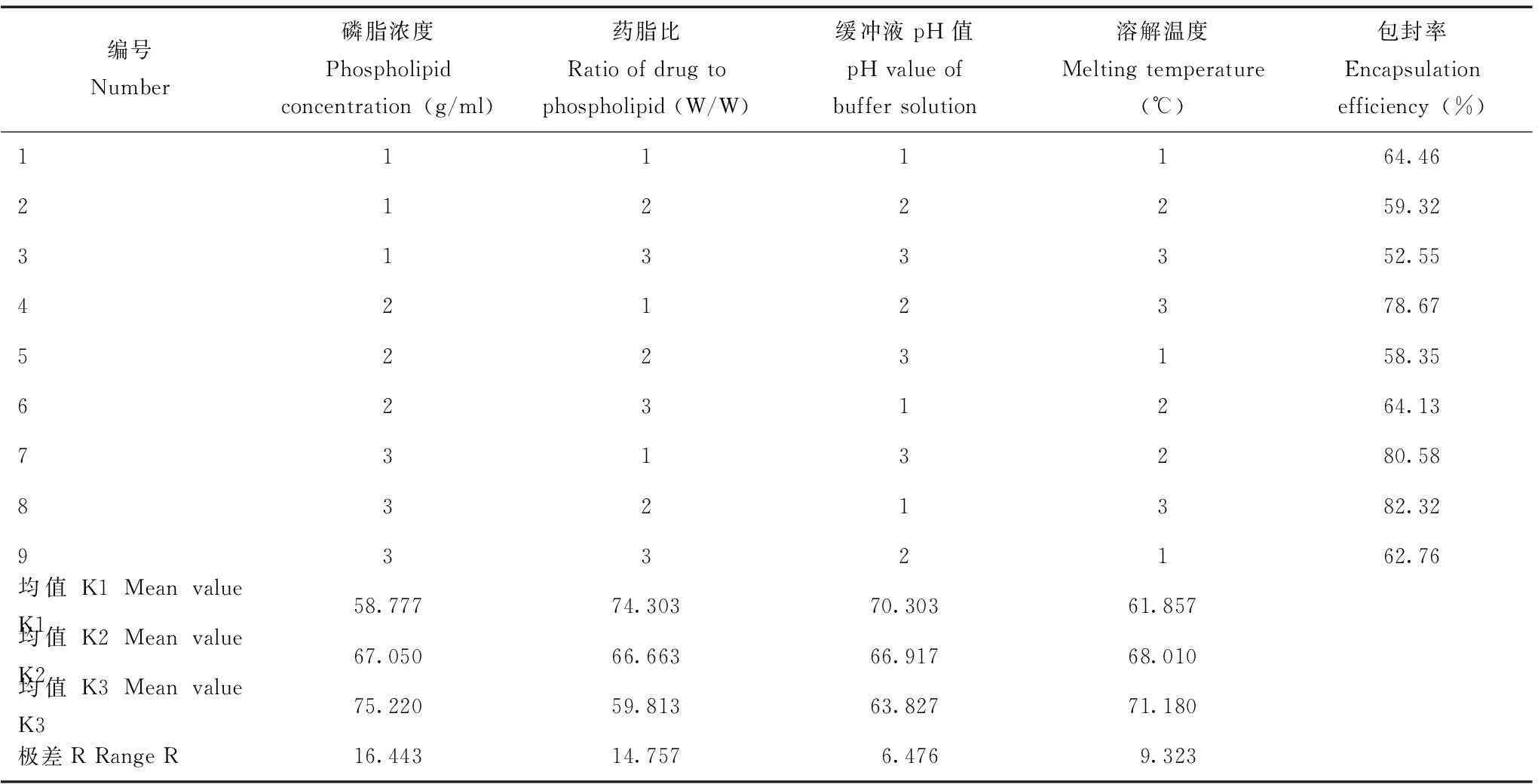
表 2 L9(34)正交实验结果
1:柚皮素
1:naringenin
图 1空白脂质体(A)、柚皮素标准品(B)、柚皮素脂质体(C)的高效液相色谱图
Fig 1High performance liquid chromatography of liposome without naringenin(A),standard substance of naringenin(B),naringenin-loaded liposome(C)
脂质体冻干前后的粒径、Zeta电位冻干前脂质体平均体粒径为(133±11)nm,表面带负电,Zeta电位为(-35.9±5)mV。冻干后脂质体平均体粒径为(151±17)nm,Zeta电位为(-26.3±1)mV,冻干粉复溶后粒径有所变大,电位有所降低。
脂质体冻干前后的形态观察脂质体冻干前后,脂质体均多为球形及类球形粒子,粒径较小,外观圆整,分布均匀(图2)。
脂质体冻干粉的外观、流动性及再分散性柚皮素脂质体为带有淡蓝色乳光的混悬液(图3A),经冷冻干燥后呈白色疏松粉末(图3B),测得休止角为36°,流动性较好;量筒法测得冻干粉堆密度为0.3 g/ml;冻干粉加入PBS溶液后重新分散较好,呈淡蓝色透明混悬液(图3C)。

A.柚皮素脂质体混悬液;B.柚皮素脂质体冻干粉再分散后得到的混悬液
A. naringenin liposomal suspension;B.naringenin lyophilized liposomal suspension obtained after redispersion
图 2柚皮素脂质体透射电镜照片
Fig 2Transmission electron microscope photo of naringenin liposomes
初步稳定性柚皮素脂质体低温放置2个月,结果显示0、1、2个月的平均包封率分别为82.13%、81.42%、81.04%;粒径分别为131.2、147.3、151.3 nm。
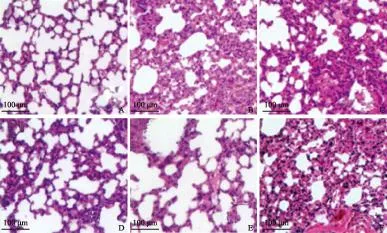
肺组织外观及评价光镜观察结果显示,与A组空白对照比较,B~F组肺组织均出现不同程度炎性细胞的浸润、毛细血管充血、出血和肺泡壁增厚,其中以B组和F组改变最为显著,C组次之,D组和E组最轻(图4)。
肺组织湿/干重比与A组(2.36±0.24)相比,湿/干重比在B组(5.08±0.32,P=0.0001)和F组(5.02±0.15,P=0.0001)显著增加;与B组(5.08±0.32)相比,C组(4.13±0.27,P=0.037)湿/干重比增加的量被抑制,而D组(2.82±0.25,P=0.0012)和E组(2.76±0.21,P=0.0018)湿/干重比增加的量被显著抑制。

A.柚皮素脂质体混悬液;B.柚皮素脂质体冻干粉;C.柚皮素脂质体冻干粉再分散得到的混悬液
A.naringenin liposome suspension;B.lyophilized powder of naringenin liposome; C.re-suspension of naringenin lyophilized powder
图 3柚皮素制剂外观形态比较
Fig 3Comparison of different naringenin formulations
LPS:脂多糖
LPS:lipopolysaccharide
A.空白组;B.模型组;C.柚皮素原料药+LPS组(100 mg/kg);D.脂质体冻干粉+LPS组(100 mg/kg);E.地塞米松+LPS组(5 mg/kg);F.空白脂质体冻干粉+LPS组(100 mg/kg)
A.control group;B.model group;C.naringenin+LPS group(100 mg/kg);D.lyophilized liposome+LPS group(100 mg/kg);E.dexamethasone+LPS group(5 mg/kg);F.blank lyophilized liposome+LPS group(100 mg/kg)
图 4各组大鼠肺组织HE染色结果(× 200)
Fig 4The results of hematoxylin-eosin staining of rat lung tissues in different groups(× 200)
讨论
柚皮素是柚皮甙的甙元,属二氢黄酮类化合物,在抗菌、抗炎、抗肿瘤等方面具有较强的生物活性。柚皮素的生物活性主要与其对血浆和肝脏中代谢酶的作用相关[4]。柚皮素治疗急性肺损伤的作用机制可能与其能治疗急性肺损伤所引起的炎症有关。
徐新荣等[10]制备了柚皮素β-环糊精包合物,增加了柚皮素水溶性,但制备工艺复杂、粒径较大,不适合肺部给药;王章姐等[11]采用Box-Behnken设计—效应面法优化处方并制备了柚皮素自微乳,提高了药物溶解度和肠渗透性,但稳定性不好,辅料PEG- 400等对胃肠有刺激作用,限制了其临床应用发展。脂质体是由脂类材料形成的具有双分子层结构的封闭囊泡,类似于细胞膜结构的双分子层[12]。由于其特殊的结构,脂质体作为药物递送系统使用时具有一些优势,如提高药物的稳定性,增强水难溶性药物的生物利用度,持续或控制药物释放,具有优异的生物降解性和细胞亲和性等[13- 15]。刘晓旭等[16]用薄膜分散—冷冻干燥法制备鸦胆子油脂质体,其体内外抑制癌细胞的能力均优于市售鸦胆子油乳注射液;张兰等[17]采用铜离子梯度法制备盐酸米托蒽醌脂质体,药效实验结果表明,盐酸米托蒽醌脂质体可显著延长荷瘤鼠的生存时间,且毒性小于盐酸米托蒽醌游离药。可见,把药物制成脂质体给药,可明显提高药效和生物利用度。
本研究选择乙醇注入法制备脂质体,简单快速、条件温和、不易使药物成分变性、不使用高压均质和超声等耗能手段,避免了药物的污染和磷脂双分子层的破坏。处方中加入的少量无水乙醇在制剂成型后加热搅拌一定时间即可挥发除去,避免了残留有机溶剂的潜在毒性。脂质体混悬液理化性质不稳定,在贮存过程中可能发生粒径增长和药物泄漏,为方便将其制备成其他剂型,通常需要冷冻干燥。本研究先将柚皮素制备成脂质体混悬液,加入冻干保护剂进一步制备成粉雾剂,用于吸入治疗急性肺损伤。一般来说,Zeta电位(绝对值)越高,脂质体分散体系的稳定性就越好[18]。本研究制得脂质体和冻干粉复溶液平均电位分别为-35.9 mV和-26.3 mV,表明体系较为稳定。复溶后电位绝对值变小可能与加入冻干保护剂有关。透射电镜照片进一步表明所制得的柚皮素脂质体分布较均匀,粒径较小,稳定性好。
最新调查表明,全世界每100 000人有1.5~75例ALI患者,死亡率高达35%~40%[19]。急性肺损伤是由直接伤害肺或通过全身性的炎症过程开始[20],其特征一般表现为:毛细血管通透性增加、间质和肺泡水肿、炎症介质释放、广泛的中性粒细胞浸润[21]。LPS气管内给药已被广泛认为是一种理想的且可重复的急性肺损伤模型构建方法而被应用于相关研究中[22]。湿/干重比对肺水肿的评估十分重要[23],本研究表明柚皮素脂质体冻干粉可明显降低脂多糖诱导的肺水肿。光镜观察证实,与空白对照组比较,LPS诱导模型组的肺切片形态学特性发生了明显变化,包括炎性细胞的浸润、毛细血管充血、出血和肺泡壁显著增厚,表明脂多糖诱导造模成功。空白脂质体冻干粉+LPS组的肺组织切片形态与模型组类似,表明空白脂质体对急性肺损伤无治疗作用。相反,当增加柚皮素或地塞米松后,肺泡毛细血管充血扩张、炎症细胞浸润和局灶性肺间隔增宽均较模型组有所减轻和缓和,符合药理学特点[6],其中柚皮素脂质体冻干粉的疗效接近地塞米松,远远好于原料药。本研究引入普遍接受的对脂多糖诱导的肺损伤有很好疗效的地塞米松做为对照,有利于进一步评估柚皮素脂质体冻干粉的药效。地塞米松组和脂质体冻干粉组治疗效果差异无统计学意义,表明制备成脂质体能极大地提高药物生物利用度,增强药效。肺组织病理切片和干湿重比结果表明,将柚皮素制备成脂质体混悬液克服了其水溶性差的缺点,提高了制剂稳定性,并直接作用于病灶部位,对LPS诱导的急性肺损伤有很好的保护作用,疗效明显好于柚皮素原料,为临床研究提供了新思路。
综上,本研究采用乙醇注入法制备了包封率高、载药量大、粒径分布均匀的柚皮素脂质体混悬液,采用冷冻干燥制备得到冻干粉。冻干粉流动性好,质轻,适合于肺部给药。加入PBS溶液后粉雾剂能够迅速分散成混悬液,其性质与冻干前脂质体混悬液相比,无明显变化。药效学实验表明柚皮素脂质体冻干粉对急性肺损伤疗效远远好于原料药,为今后可能的临床应用奠定了基础。
参考文献
[1]Olsen HT,Stafford GI,van Staden J,et al. Isolation of the MAO-inhibitor naringenin from Mentha aquatica L [J].J Ethnopharmacol,2008,117(3):500- 502.
[2]Batrakova EV,Li S,Alakhov VY,et al. Sensitization of cells overexpressing multidrug-resistant proteins by pluronic P85 [J].Pharm Res,2003,20(10):1581- 1590.
[3]Zhou DY,Xu Q,Xue XY,et al. Rapid qualitative and quantitative analyses of flavanone aglycones in Fructus aurantii by HPLC ion-trap MS [J].J Sep Sci,2007,30(6):858- 867.
[4]张天柱,马春华,樊湘泽.柚皮素对脂多糖诱导小鼠急性肺损伤的保护作用研究 [J].中药药理与临床,2013,29(6):30- 31.
[5]马燕,林宝琴,李卫中,等.柚皮素大鼠在体肠吸收动力学的研究 [J].中成药,2012,34(8):1487- 1491.
[6]龚素娟,蒋艳博,杨琳琳,等.冬凌草甲素脂质体的制备及其影响因素考察 [J].沈阳药科大学学报,2010,27(2):87- 92.
[7]崔福德.药剂学 [M].7版.北京:人民卫生出版社,2012:94- 100.
[8]Sua ZQ,Moa ZZ,Liao JB,et al. Usnic acid protects LPS-induced acute lung injury in mice through attenuating inflammatory responses and oxidative stress [J].Int Immunopharmacol,2014,22(8):371- 378.
[9]Ahmet G,Umit N,Burhan A,et al. Protective effects of methylisothiourea sulfate on different aspiration materials-induced lung injury in rats [J].Int J Pediat Otorhinolaryngol,2008,72(8):1241- 1250.
[10]徐新荣,于海涛,杭丽,等.柚皮素β-环糊精包合物的制备及对模型大鼠脉络膜新生血管形成的抑制作用 [J].中国药房,2014,25(11):981- 983.
[11]王章姐,胡容峰,王国凯,等.Box-Behnken设计-效应面法优化柚皮素自微乳给药系统 [J].中草药,2014,45(17):2461- 2466.
[12]Sessa G,Weissmann G.Phospholipid spherules(liposomes)as a model for biological membranes [J].J Lipid Res,1968,9(3):310- 318.
[13]Mohammed AR,Weston N,Coombes AG,et al. Liposome formulation of poorly water soluble drugs:optimization of drug loading and ESEM analysis of stability [J].Int J Pharm,2004,85(2):23- 34.
[14]Kim CK,Han JH.Lymphatic delivery and pharmacokinetics of methotrexate after intramuscular injection of differently charged liposome-entrapped methotrexate to rats [J].J Microencapsul,1995,12(4):437- 446.
[15]Samad A,Sultana Y,Aqil M.Liposomal drug delivery systems:an update review [J].Curr Drug Deliv,2007,4(4):297- 305.
[16]刘晓旭,倪睿,刘建平.鸦胆子油脂质体冻干粉的制备及其药效学评价 [J].中国药科大学学报,2009,40(1):37- 40.
[17]张兰,杜艳玲,刘勋涛,等.盐酸米托蒽醌脂质体的制备及药效学、药动学研究 [J].中国药学杂志,2013,48(17):1283- 1287.
[18]Bai GZ,Yu HT,Ni YF,et al. Shikonin attenuates lipopolysaccharide-induced acute lung injury in mice [J].J Surg Res,2013,182(2):303- 311.
[19]Wheeler AP,Bernard GR.Acute lung injury and the acute respiratory distress syndrome:a clinical review [J].Lancet,2007,369(9572):1553- 1564.
[20]Griffith B,Pendyala S,Hecker L,et al. NOX enzymes and pulmonary disease [J].Antioxid Redox Signal,2009,11(10):2505- 2516.
[21]Zhang X,Huang H,Yang T,et al. Luo chlorogenic acid protects mice against lipopolysaccharide-induced acute lung injury [J].Injury,2010,41(7):746- 752.
[22]Chen X,Yang X,Liu T,et al. Kaempferol regulates MAPKs and NF-kappaB signaling pathways to attenuate LPS-induced acute lung injury in mice [J].Int Immunopharmacol,2012,14(2):9- 16.
[23]Zhang B,Liu ZY,Li YY,et al. Antiinflammatory effects of matrine in LPS-induced acute lung injury in mice [J].Eur J Pharm Sci,2011,44(5):573- 579.
·论著·
DOI:10.3881/j.issn.1000- 503X.2015.02.012
Preparation and Pharmacodynamic Evaluation of Naringenin Lyophilized Liposome
JI Peng,ZHAO Wen-ming
College of Pharmacy of Liaoning Medical University,Jinzhou,Liaoning 121000,China
Corresponding author:ZHAO Wen-mingTel:0416- 4673439,E-mail:zhaowenming1957@163.com
ABSTRACT:ObjectiveTo prepare the lyophilized powder of naringenin liposome and investigate its pharmacodynamics in rat models of acute lung injury(ALI).MethodsNaringenin liposome was prepared by ethanol injection method and then its quality was evaluated.Also,the related characteristics was evaluated by adding mannitol(5%,W/V)as lyoprotectant to be freeze-dried.The rat ALI models were established by inhaling lipopolysaccharide(LPS)(5 mg/kg).Totally 48 female Sprague-Dawley rats were randomly divided into six groups:control group(A),LPS group(B),LPS+naringenin group(C),LPS+lyophilized liposome group(D),LPS+dexamethasone group(E),and LPS+blank liposome group(F),with 8 rats in each group.Lung wet/dry weight ratio was calculated,and the histopathological morphologies were observed under the light microscope.ResultsThe encapsulation efficiency of the prepared liposome was(82.44±0.98)%,the average particle size was(133±11)nm,and the Zeta potential was(-35.9±5)mV.The angle of repose of lyophilized powder was 36° and the bulk density was 0.3 g/ml.Compared with the group A,the lung tissues from groups B to F showed different remarkable histopathological changes under a light microscope,including infiltration of inflammatory cells,capillary congestion,hemorrhage,and marked thickening of the alveolar wall,among which group B and F changed the most significant,followed by group C,whereas groups D and E were the lightest.The wet/dry weight ratios increased in groups B to F compared with group A in some degree,and the increase of the lung wet/dry weight ratio in group D and E was significantly lower than in group B(P=0.0012,P=0.0018).ConclusionThe technology of preparing naringenin liposome by ethanol injection is simple and feasible,and lyophilized powder has an obvious therapeutic effect on ALI.
Key words:naringenin;liposome;freeze-drying;acute lung injury
(收稿日期:2014- 11- 16)
中图分类号:R944.1+5
文献标志码:A
文章编号:1000- 503X(2015)02- 0208- 07
通信作者:赵文明电话:0416- 4673439,电子邮件:zhaowenming1957@163.com
