α7nAChR 基因敲除小鼠的饲养繁育及基因型鉴定*
2015-02-18基金项目国家自然科学基金项目81100279浙江省大学生科技创新活动计划暨新苗人才计划项目2014R410058
*基金项目:国家自然科学基金项目 (81100279);浙江省大学生科技创新活动计划暨新苗人才计划项目(2014R410058)。
α7nAChR 基因敲除小鼠的饲养繁育及基因型鉴定*
*基金项目:国家自然科学基金项目 (81100279);浙江省大学生科技创新活动计划暨新苗人才计划项目(2014R410058)。
★李富强1吴小翠1陈小梅1唐翠兰2**(1.浙江中医药大学第二临床医学院杭州 310053;2.浙江省新华医院感染科杭州 310006)
摘要:目的:繁殖和鉴定烟碱型乙酰胆碱受体α7基因敲除小鼠。方法:将引进的α7nAChR基因敲除杂合子小鼠进行饲养并繁殖,提取子代小鼠尾部 DNA,用 PCR 方法检测子代小鼠基因型;采用 Western blot 检测α7nAChR 蛋白质的表达,进一步证实 PCR 鉴定方法的可靠性。结果:获得子代 (α7nAChR+ / +) ,子代小鼠纯合率为 30%。结论:α7nAChR基因敲除小鼠的繁育和鉴定均获得成功,为进一步研究α7nAChR 缺失对非酒精性脂肪性肝炎的影响提供了理想的动物模型。
关键词:烟碱型乙酰胆碱受体α7; 基因敲除小鼠; 非酒精性脂肪性肝炎
烟碱型乙酰胆碱受体α7(α7 nicotinic acetylcholine receptor, α7nAChR)是配体门控离子通道蛋白超家族的典型代表,烟碱型乙酰胆碱受体的一个重要亚型,是复杂的五聚体跨膜蛋白[1]。α7nAChR分布广泛且功能多样,不仅分布于中枢神经系统,在外周神经系统也有广泛表达,介导着神经元的快速突触传递[2-3]。近年来研究发现,α7nAChR在身体多个部位的非神经元细胞和组织中亦有表达,通过活化胆碱能抗炎通路参与多种炎症反应的调控。它的激活可以有效减少多种促炎因子的释放,对局部和全身炎症具有明显的抑制作用[4]。巨噬细胞是参与胆碱能抗炎通路的主要靶细胞[5]。胆碱能抗炎通路主要通过活化巨噬细胞表面的α7nAChR发挥抗炎作用[6]。在前期实验中,我们给予NASH小鼠体外腹腔注射烟碱,结果发现可以减轻NASH的炎症反应,其作用机制主要是活化α7nAChR介导的胆碱能抗炎通路,通过调控NF-κB和MAPK信号通路,减轻NASH的炎症反应。为了进一步明确α7nAChR在NASH小鼠中的作用机制以及该基因的缺失会对小鼠NASH炎症反应产生的影响,我们从美国杰克逊实验室(Jackson Laboratory)成功引入了α7nAChR基因敲除杂合子小鼠,在 SPF级动物房中饲养、繁殖,基因鉴定出一批子代纯合子基因敲除小鼠。
1材料与方法
1.1实验动物α7nAChR基因敲除小鼠由美国 Jackson 实验室引进( Stock Number: 003232, Strain Name:B6.129S7-Chrna7tm1Bay/J) ,品系背景为 C57BL/6J,雌雄各 3 只,基因型为杂合子(α7nAChR + /-) 。
1.2主要试剂及仪器小鼠组织DNA提取、PCR反应(美国KAPA Mouse Genotyping Kit),DNA Marker(上海江莱生物科技有限公司),5×TBE、溴化乙啶溶液(北京索莱宝科技有限公司),琼脂糖(BIOWEST),6×Loading buffer(宝生物工程(大连)有限公司) ;DK-8D 型三孔电热恒温水槽( 上海恒科技有限公司),UNO-Ⅱ型 PCR 仪(美国 Biometra 公司),Eppendorf 5804R 低温离心机 ( 德国Eppendorf AG), FR-250 电泳仪,FR-980A 生物电泳图像分析系统(上海复日科技有限公司);Anti-α7nAChR抗体(美国Proentech公司),Anti-GAPDH抗体(Cell Signal公司),Goat anti-rabbit IgG-HRP(上海博谷生物科技有限公司);蛋白裂解液 RIPA、BCA 蛋白浓度测定试剂盒( 上海碧云天生物技术有限公司) ,蛋白酶抑制剂 PMSF(Sigma公司)。
1.3基因敲除小鼠的饲养和繁殖小鼠饲养于浙江中医药大学动物中心SPF 环境中,室内温度控制在 22℃~26℃ ,湿度50% ~ 60% ,明暗循环 12 h / d,自由饮食和饮水,小鼠笼盒、垫料、饮用水均经高温高压灭菌处理。饲料购自浙江省医学科学院。饲养过程中,每天进入动物房1 次,观察小鼠生长情况,垫料每周更换3次,每天补充饲料和饮用水。小鼠2个月后性能力发育成熟,将其雌雄等比例同笼合养。雌性小鼠的妊娠期和哺乳期为3周左右,过哺乳期后把小鼠与母鼠分开,雌雄分开饲养,以免影响实验数据的精确性。用于繁殖的小鼠要定期给予灭菌葵花籽和蛋黄以补充营养以增强其繁殖能力。
1.4小鼠的基因型鉴定国外购买的α7nAChR敲除小鼠是杂合子小鼠,根据孟德尔定律,其子代可能基因型为杂合子(α7nAChR+/-) 、纯合子(α7nAChR-/-) 及野生型(α7nAChR+/+) ,所以必须对它们进行基因型鉴定。
1.4.1小鼠组织 DNA 的提取剪取小鼠尾巴约1~3mm,放入1.5 mL 离心管中,然后分别加入以下反应物:10× KAPA Express Extract Buffer10μL、1U/μL KAPA Express Extract Enzyme 2μL,轻轻混匀,75℃水浴10min,95℃水浴5min,涡旋震荡3s,12000g离心1min,转移上清至新的1.5mLEP管中。
1.4.2PCR反应PCR反应引物由生工生物工程(上海)公司合成。引物1:CCC TTT ATA GAT TCG CCC TTG 用于检测突变型; 引物 2: ATC AGA TGT TGC TGG CAT GA用于检测野生型; 引物 3: TTC CTG GTC CTG CTG TGT TA 作为通用引物。PCR扩增:根据KAPA Mouse Genotyping Kit 使用说明,按25μL反应体系进行扩增。分别加入如下反应物:DNA模板1μL、突变引物(0.5μmol.L-1)1.25μL、野生型引物(0.5μmol.L-1)1.25μL、通用引物(0.5μmoL/L)1.25μL、2×KAPA 2G Fast Genotyping Mix(1×)12.5μL、1.5mM氯化镁0.5μL,加ddH2O补足至25μL。反应条件为:95℃预变性3min,95℃变性15s,60℃退火15s,72℃延伸20s/kb,循环35次,72℃最后延伸5min终止反应,4℃保存。
1.4.3琼脂糖电泳及基因型鉴定琼脂糖1.5g,0.5×TBE100mL,溴化乙啶(EB)5μL,PCR产物10μL,上样缓冲液1μL,DNA Marker 4μL,电泳电压100V,时间为60min。
引物1扩增产物大小为187bp,为纯合子小鼠;引物2扩增产物大小为390bp,为野生型小鼠;187bp、390bp这2条电泳条带均存在的为杂合子小鼠。
1.5Western blot分析α7nAChR蛋白质的表达
1.5.1组织蛋白提取将小鼠肝脏组织用PBS洗净,置于离心管中,用干净的剪刀将组织块尽量剪碎,每100mg肝组织加入500μL含PMSF的RIPA蛋白裂解液,于手动匀浆器上进行匀浆1min后置于冰上,几分钟后再行匀浆,再置于冰上,如此重复,裂解30min后,在4℃下12000g离心15min,取得上清即为蛋白。将组织中提取的蛋白用BCA法测定细胞蛋白浓度后,加上样缓冲液后沸水煮10min后迅速水浴冷却。
1.5.2蛋白电泳和Western blot 检测采用10﹪SDS-PAGE胶,120V电泳1.5h将蛋白质分离;300mA,4℃转膜2h将蛋白质转印至PVDF膜。用含5%脱脂牛奶的TBST在室温下封闭2小时后,分别加入Anti-α7nAChR抗体(1∶500)和Anti-GAPDH抗体(1∶1000)4℃孵育过夜,TBST洗涤3次。分别加入Goat anti-rabbit IgG-HRP(1∶5000),室温孵育1小时,TBST洗涤3次后,加化学发光底物作用3分钟,暗室曝光,显影,定影。
2结果
2.1部分小鼠基因型鉴定结果亲代α7nAChR基因敲除小鼠均为杂合子配种,子代小鼠有杂合、纯合和野生型3种基因型。如图1所示,3、4、6号小鼠电泳条带位于390bp和187bp处为杂合子;2、5号小鼠电泳条带位于187bp处为纯合子;1号小鼠电泳条带位于390bp处为野生型。

图1 子代小鼠α7nAChR基因鉴定结果
2.2α7nAChR基因敲除小鼠繁育生长情况6个月共繁育小鼠3代/次,得到子代小鼠30只,其中雄性21只,雌性9只;经基因型鉴定,获得α7nAChR+/+小鼠5只,α7nAChR+/-小鼠16只,α7nAChR-/-小鼠9只,纯合小鼠比例为30%;新生小鼠呈肉色,还没长出毛,眼睛闭着,尾短,四肢柔弱,平时躺着不动,平均断乳期为21d;成年小鼠体重相对C57BL/6J没有较大差别,但是繁殖能力相对弱,会出现食仔、脱毛等现象,见图2。

图2 α7nAChR基因敲除小鼠新生2日龄及30日龄幼鼠
2.3基因敲除小鼠α7nAChR蛋白质表达为了进一步验证PCR结果的可靠性,我们选取经PCR鉴定获得的纯合子和野生型小鼠,应用Western Blot的方法检测α7nAChR蛋白在肝脏组织中的表达。结果如图3所示,纯合子小鼠肝脏组织未检测到α7nAChR蛋白质的表达,而野生型小鼠肝脏可见α7nAChR蛋白的表达,PCR方法鉴定所得的结果一致。
3讨论
慢性炎症反应在NASH的发生发展中起重要作用[7]。来源于肝脏巨噬细胞的炎症因子对NASH的发生发展起重要作用[8],巨噬细胞失活后可以阻断NASH大鼠肝脂肪变性和炎症的发展[9]。α7nAChR与TLR-4在巨噬细胞表面均有表达,α7nAChR介导的抗炎信号传导通路与TLR-4介导的致炎信号传导通路均通过NF-κB和MAPK信号通路来发挥作用。巨噬细胞的活化主要由肠道来源的内毒素脂多糖(1ipopoLysaccharides,LPS)启动[10],LPS通过与巨噬细胞TLR-4结合,活化MAPK和NF-κB信号通路[11],导致细胞因子IL-6、TNF-α产生[12]。另外,活化的巨噬细胞通过NADH/NADPH氧化酶合成的活性氧(Reactive oxygen species,ROS)活化NF-κB和MAPK信号通路导致肝脏损伤[13]。烟碱活化巨噬细胞表面的α7nAChR后,可以通过抑制TLR-4介导的NF-κB和MAPK信号通路来发挥抗炎作用,从而减轻NASH的炎症反应。
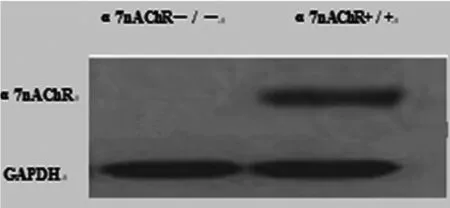
图3 小鼠肝脏组织α7nAChR蛋白质表达
理论依据。
参考文献
[1]安静,邬礼政,周志斐.α7 nAChR在上皮组织的表达及其功能的研究进展[J].现代生物医学进展,2014,14(6):1 174-1 176.
[2]DanieLa Gtindisch ,Christoph Eib1.Nicotinic acetylchoLine receptor ligands;a patent review (2006-2011)[J].Expert Opin Ther Pat, 2011, 21(12):1 867-1 896.
[3]XiaoWei Li, Hai Wang. Non-neuronal nicotinic alpha 7 receptor, a new endothelial target for revascuLarization[J].Life Sciences,2006,78:1 863-1 870.
[4]Rosas-Ballina M, Tracey KJ. The neurology of the immune system: neural refLexes reguLate immunity[J].Neuron, 2009, 64(1):28-32.
[5]Pohanka M, Snopkova S, Havlickova K, et al. Macrophage-assisted inflammation and pharmacological regulation of the cholinergic anti-inflammatory pathway[J].Curr Med Chem, 2011, 18(4):539-551.
[6]Bencherif M, Lippiello PM, Lucas R, et al.ALpha7 nicotinic receptors as novel therapeutic targets for inflammation-based diseases[J].Cell Mol Life Sci, 2011, 68(6):931-949.
[7]Lade A, Noon LA, Friedman SL. Contributions of metabolicdysregulation and inflammation to nonalcoholic steatohepatitis, hepatic fibrosis, and cancer[J].Curr Opin Oncol,2014, 26(1):100-107.
[8]YuTao Zhan, Wei An. Roles of Liver innate immune cells in nonalcoholic fatty liver disease[J].WorLd J Gastroenterol, 2010, 16(37): 4 652-4 660.
[9]Mouralidarane A, Soeda J, Visconti-Pugmire C, et al.Maternal obesity programs offspring nonalcoholic fatty Liver disease by innate immune dysfunction in mice[J].HepatoLogy,2013, 58(1):128-138.
[10]Li L, Chen L, Hu L, et al.Nuclear factor high-mobility group box1 mediating the activation of Toll-Like receptor 4 signaling in hepatocytes in the early stage of nonalcoholic fatty Liver disease in mice[J].HepatoLogy,2011, 54(5):1 620-1 630.
[11]Chung MY, Yeung SF, Park HJ, et al.Dietary α- and γ-tocopheroL supplementation attenuates lipopolysaccharide-induced oxidative stress and inflammatory-related responses in an obese mouse model of nonalcoholic steatohepatitis[J].J Nutr Biochem,2010,21(12):1 200-1 206.
[12]O’Neill LA,Bowie AG.The family of five:11R-domain-containing adaptors in Toll-Like receptor signaLing[J].Nat Rev LmmunoI, 2007(7):353-364.
[13]Gyorgy Baffy. Kupffer cells in non-alcoholic fatty liver disease: The emerging view[J].J Hepatol, 2009, 51(1): 212-223.
[14]高翔.小鼠基因功能研究及疾病模型系列专题(二)-基因工程小鼠的品系管理及基因型鉴定[J].中国细胞生物学学报,2010,32( 2) :193-194.
Reproduction and Genotype Identification of α7nAChR Knockout mice
LI Fu-qiang1,WU Xiao-cui1,CHEN Xiao-mei1,TANG Cui-lan2
1.TheSecondClinicalMedicalCollege,ZhejiangChineseMedicalUniversity,Hangzhou310053,China;
2.DepartmentofInfectionsDisease,ZhejiangProvinceXinhuaHospital,Hangzhou310006,China.
Abstract:Objective:Reproduce and identify α7nAChR knockout mice. Methods:Heterozygote mice were bred and reproduced. Genome DNA was extracted from the murine tail and identified by PCR; Additionally, the expression of α7nAChR protein was detected by Western blot to further confirmed the reliability of PCR methods for genotype identification of α7nAChR mutant mice. Results:α7nAChR genotypes of the offspring mice included heterozygous (α7nAChR+/-),homozygous (α7nAChR-/-),and wild types(α7nAChR+/+).The homozygous rate of offspring was 30% .Conclusion: α7nAChR knockout mice are successful reproduced, which provides an ideal animal model for study of the NASH.
Key words:α7 nicotinic acetylcholine receptor; Knockout mouse; Nonalcoholic steatohepatitis
收稿日期:(2015-03-23)编辑:翟兴英
中图分类号:R285.5
文献标识码:A
通信作者:**唐翠兰(1971—),博士,主任医师,硕士生导师。TeL:15988115612,E-mail:1747603542@qq.com。
