肥胖对小鼠胃癌生长的影响
2015-02-18李海军车向明张正良仇广林付军科
李海军,车向明,张正良,仇广林,樊 林,付军科
(西安交通大学医学部:1.第一附属医院胸外科;2.第一附属医院普通外科,陕西西安 710061;3.第二附属医院急诊科,陕西西安 710004)
胃癌是世界上发病率和死亡率较高的恶性肿瘤之一,也是我国最常见的消化道肿瘤,严重威胁着人类的健康。随着饮食结构的改变及食物储存方式的改善,胃癌总体发病率有所下降,以远端胃癌为著,但近端胃癌发病率却有所增加,这很可能与肥胖有关[1]。肥胖增加多种恶性肿瘤的发病率,如结肠癌、乳腺癌、食管癌、胰腺癌等[2-4]。对于胃癌,Meta分析显示肥胖与胃癌的发病率增加有关,并随着个体体质量指数的增加而上升,尤以近端胃癌最为明显[5]。因此,肥胖与胃癌关系密切,并可能影响其生长与转移。
肥胖表现为白色脂肪组织蓄积,而脂肪组织作为内分泌器官,可分泌多种脂肪细胞因子调控代谢、炎症、免疫等,它包括瘦素、脂联素、内脂素等[6]。内脂素作为新发现的脂肪细胞因子,是一种主要由内脏脂肪细胞分泌的脂肪细胞因子,它上调脐静脉血管内皮细胞核因子κB(nuclear factorκB,NF-κB)表达以增加基质金属蛋白酶2/9(matrix metalloproteinase,MMP)表达[7],也刺激前列腺癌、乳腺癌细胞生长与转移[8-9],并在结肠癌、恶性胶质瘤患者血清中表达升高且与肿瘤分期有关[10-11]。肥胖影响胃癌生物学行为的相关因素较多,目前也缺乏相应的基础研究。高脂饮食诱导C57BL/6j小鼠可建立肥胖模型,它具有与人类肥胖相似的特点,可用于研究肥胖与胃癌之间的关系。因此,本研究拟建立肥胖小鼠皮下胃癌移植瘤模型,分析肥胖对胃癌的生长、增殖、凋亡等生物学行为的影响,为预防肥胖或代谢性疾病相关胃癌提供理论依据。
1 材料与方法
1.1 实验材料 SPF级雄性、4周龄C57BL/6j小鼠(中国科学院上海实验动物中心),体质量15~18g;小鼠胃癌细胞MFC(中国科学院上海细胞库);基础饲料作为对照组,能量构成比为脂肪10%、蛋白质20%、碳水化合物70%;高脂饲料由79.5%基础饲料、10%熟猪油、10%蛋黄粉、0.25%胆固醇及0.25%猪胆盐组成,能量组成为脂肪35%、蛋白质20%及碳水化合物45%。
1.2 高脂饮食诱导肥胖小鼠模型的建立 C57BL/6j小鼠适应性喂养1周,而后随机分成正常饮食(n=24)、高脂饮食组(n=36),分别给予基础、高脂饲料喂养。小鼠自由摄食及饮水,明暗周期为12h(8am~8pm),温度控制在(25±1)℃,相对湿度40%~50%。每周测量小鼠体质量、体长(鼻尖至肛门的长度)。12周末建模成功,正常饮食组小鼠即为正常(Lean)小鼠;高脂饮食组小鼠按体质量筛选肥胖(Obese)小鼠,造模评定标准:通常认为,C57BL/6j小鼠体质量超过(正常饮食组体质量均数+2倍标准差)即达到肥胖标准,体质量未达到肥胖标准即为非肥胖(non-obese)小鼠。
1.3 小鼠皮下胃癌移植瘤模型的建立 将小鼠胃癌细胞(0.2mL/只,含2.0×106个细胞)注射于小鼠右侧腹部皮下,分为正常、非肥胖、肥胖组,分别给予原饮食方案继续喂养2周,动态监测皮下移植瘤形成与否、大小及小鼠全身情况。肿瘤体积大小计算用公式:V=1/2ab2(a为最大直径,b为最小直径)。本实验所用小鼠经伦理委员会批准使用,所有实验过程均遵循西安交通大学医学部实验动物管理与使用条例以尽量减少实验动物的痛苦。
至实验结束时,小鼠禁食10h,荷瘤小鼠处死前1h腹腔注入5-BrdU(120mg/kg),给予100g/L水合氯醛(3~4mL/kg)腹腔注射进行麻醉。麻醉成功后,拔眼球取血并处死小鼠,全血室温静置至血清析出约1h,4℃、3 000r/min离心30min,获得血清。检测血糖与血清胰岛素、内脂素水平。完整剥离肿瘤组织、称取质量,100g/L甲醛液固定、石蜡包埋并切片,组织切片厚5μm。常规HE染色观察肿瘤组织内脂肪细胞的大小与数量,并计数微血管数量。实验中死亡以及实验结束时处死小鼠均进行开腹尸检以确认有无肿瘤转移。
1.4 细胞增殖与凋亡检测 采用SP免疫组化方法检测胃癌细胞增殖情况,用PBS代替一抗作为阴性对照。5-Brdu在抗原定位处出现清晰的棕黄色或棕褐色特异性免疫反应颗粒者即为阳性。每张切片选择高倍镜视野,计数阳性细胞个数;末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(TdT-mediated dUTP nick end labeling,TUNEL)检测肿瘤组织内细胞凋亡情况,根据凋亡细胞形态特征进行综合判断:未染色细胞变小,胞膜完整但出现发泡现象,晚期出现凋亡小体;染色细胞呈现染色质浓缩、边缘化,核膜裂解,染色质分割成块状/凋亡小体。
1.5 统计学方法 采用SPSS16.0统计学软件对实验数据进行分析。计量资料数据均值用(±s)表示,组间差异的比较采用t检验,相关性分析采用Pearson相关性分析(正态分布)或Spearman秩相关分析(非正态分布)。P<0.05时认为差异有统计学意义。
2 结 果
2.1 小鼠体质量变化与肥胖小鼠的筛选 相较于正常饮食组,高脂饮食组小鼠进食量稍多,尿色较黄、量稍少,大便色黄、质软、量稍少。因高脂饲料质地较为松软,口感较差,高脂饮食组小鼠体质量在实验初期增长较为缓慢。至6周末时,高脂饮食组小鼠体质量明显高于正常饮食组(P<0.05,图1)。至12周末,高脂饮食组按体质量≥31.50g标准筛选出肥胖小鼠(n=24),肥胖模型成功率66.7%(24/36),余即为非肥胖小鼠(n=12);正常饮食组即正常小鼠(n=24)。

图1 C57BL/6j小鼠体质量与饲养时间的关系Fig.1 Relationship between mean body weight of C57BL/6j mice and the feeding time(*P<0.05)
正常、非肥胖、肥胖小鼠体长分别为(10.40±0.26)cm、(10.38±0.33)cm、(10.52±0.29)cm,彼此之间差异无统计学意义(P>0.05);体质重分别为(28.50±1.27)g、(28.70±2.30)g、(35.40±2.81)g;体质量指数即 Lee's指数=体质量(g)1/3×103/体长(cm),分别为(293.77±5.35)、(295.15±3.43)、(312.85±2.93),其中肥胖小鼠体质量、体质量指数均明显高于非肥胖、正常小鼠(P<0.05),而非肥胖与正常小鼠之间差异无统计学意义(P>0.05)。
2.2 肥胖对小鼠胃癌体内生长、转移的影响 接种MFC第4天,于小鼠接种部位皮下可触及呈沙粒结节状的肿瘤组织即胃癌皮下移植瘤模型建立成功。正常、非肥胖、肥胖小鼠皮下移植瘤形成率分别为83.3%(10/12)、75% (9/12)、100%(12/12),至实验结束时所有小鼠均存活,腹腔均未见肿瘤转移。
肥胖小鼠皮下胃癌移植瘤生长速度明显快于非肥胖、正常小鼠(P<0.05,图2A),致使正常、非肥胖、肥胖小鼠皮下移植瘤的终末质量分别为(77.2±14.9)mg、(83.4±15.3)mg、(134.2±17.3)mg,其中肥胖小鼠组明显重于非肥胖、正常小鼠组(P<0.05),而非肥胖与正常小鼠组之间差异无统计学意义(P>0.05)。与此同时,皮下胃癌移植瘤质量与小鼠体质量之间存在显著的正相关性(r=0.75,P<0.05,图2B)。
2.3 肥胖对小鼠胃癌体内增殖、凋亡的影响 研究结果显示,正常、非肥胖、肥胖小鼠皮下胃癌移植瘤组织内细胞增殖情况(1个高倍镜视野下平均增殖细胞个数,×400,图3)分别为(57.7±10.2)、(61.2±9.7)、(88.1±8.8)cells/hpf;细胞凋亡情况(1个高倍镜视野下平均凋亡细胞个数,×400,图4)分别为(54.7±5.7)、(55.2±8.2)、(23.7±4.6)cells/hpf,其中肥胖与非肥胖、正常小鼠组之间细胞增殖、凋亡均有明显差异(P<0.05),而非肥胖与正常小鼠组之间差异无统计学意义(P>0.05)。这表明肥胖促进移植瘤存活、生长不仅与细胞增殖增加有关,而且与细胞凋亡减少密切相关。

图2 肥胖对小鼠胃癌体内生长的影响Fig.2 Obesity affected the growth of murine gastric cancer in vivo
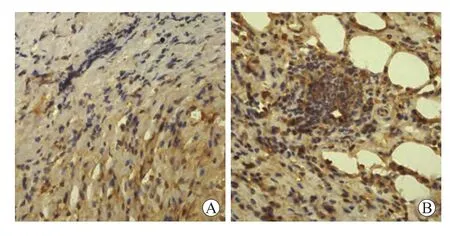
图3 不同移植瘤内胃癌细胞的增殖情况Fig.3 Representative micrographs(5-BrdU incorporation,original magnification,×400)of xenograft tumor sections from lean,non-obese and obese mice
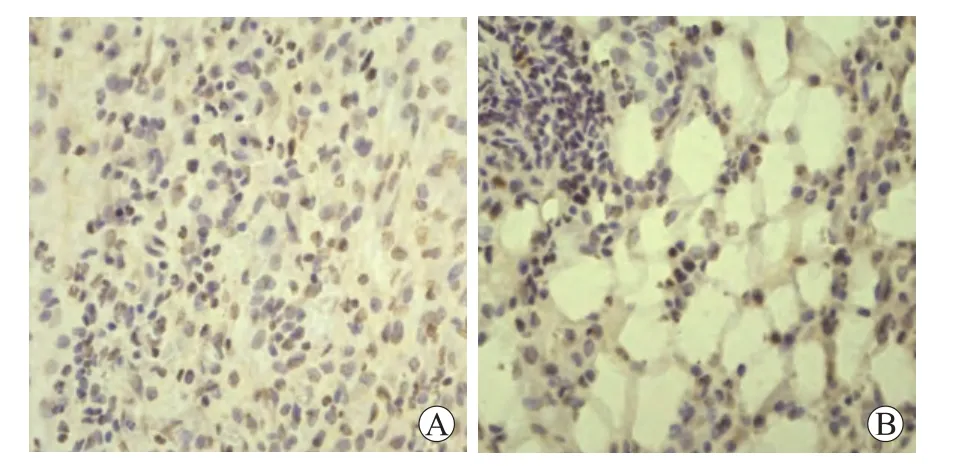
图4 不同移植瘤内胃癌细胞的凋亡情况Fig.4 Representative micrographs(TUNEL,original magnification,×400)of xenograft tumor sections from lean,non-obese and obese mice
2.4 肥胖致小鼠代谢性改变及其对胃癌的影响 研究结果显示,肥胖小鼠空腹血糖、胰岛素、内脂素水平及胰岛素抵抗指数均明显高于正常、非肥胖小鼠(P<0.05,表1),而正常与非肥胖小鼠之间差异无统计学意义(P>0.05)。胰岛素抵抗用HOMA-IR指数表示,HOMA-IR=葡萄糖(mmol/L)×胰岛素(mu/L)/22.5。
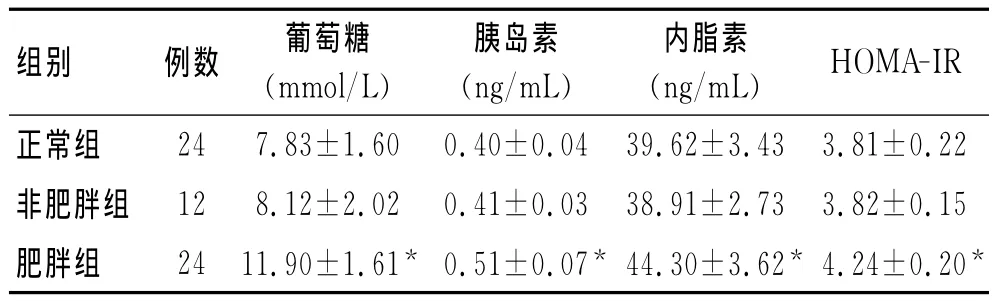
表1 小鼠血清代谢性指标的比较Tab.1 Serum metabolic parameters in mice
移植瘤内胃癌细胞增殖与血清胰岛素(r=0.58,P=0.01)、内脂素(r=0.51,P=0.02)呈正相关性,与血糖水平无关(r=0.20,P=0.10);胃癌细胞凋亡与血清胰岛素(r=-0.74,P<0.05)、内脂素(r=-0.53,P=0.02)呈负相关性,仍与血糖水平无关(r=-0.16,P=0.25)。这表明肥胖所致高胰岛素血症、胰岛素抵抗与肥胖或脂肪组织的内分泌功能在促进肿瘤细胞存活、增殖、减少凋亡中有着重要作用。
2.5 肥胖对移植瘤肿瘤微环境的影响 肿瘤微环境与肿瘤的生物学行为密切相关。研究结果显示,在移植瘤组织内可见大量的脂肪细胞,正常、非肥胖、肥胖小鼠皮下移植瘤组织内1个高倍镜视野下平均脂肪细胞个数(×400)分别为15.4±2.7、16.1±2.0、17.2±4.2,彼此之间差异无统计学意义(P>0.05);移植瘤内脂肪细胞大小分别为(67.3±8.2)、(69.5±9.9)、(169.9±5.7)μm2,其中肥胖小鼠组明显大于非肥胖、正常组(P<0.05,图5),而非肥胖与正常组之间差异无统计学意义(P>0.05)。此外,皮下移植瘤内可见一定数量的微血管,正常、非肥胖、肥胖小鼠皮下移植瘤内微血管密度(×400)分别为(7.1±1.5)、(7.7±1.8)、(9.2±1.0)/hpf,彼此之间差异无统计学意义(P>0.05)。结合上述细胞增殖与凋亡情况,肥胖促进小鼠胃癌细胞增殖并减少凋亡,这与肥胖致肿瘤微环境改变有关,并在一定程度上与局部脂肪细胞的大小有关。
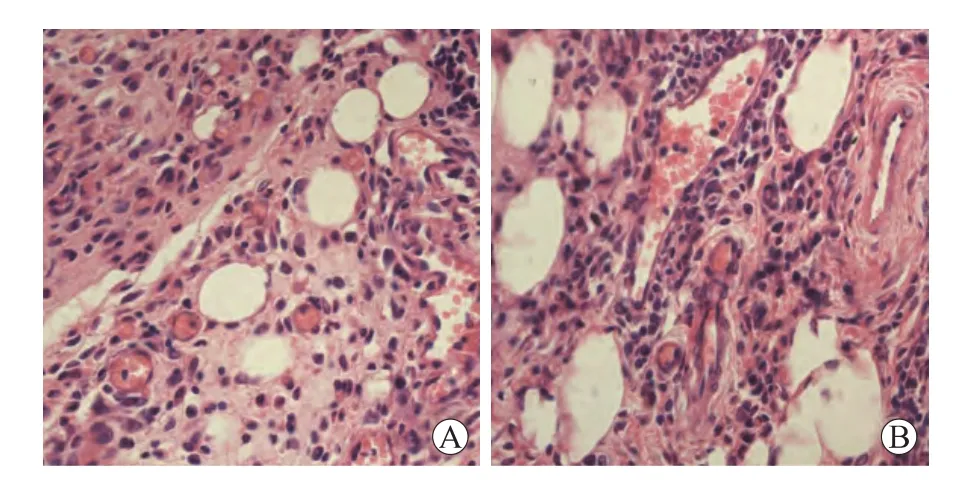
图5 不同移植瘤内脂肪细胞数量与大小Fig.5 Representative micrographs(H&E,original magnification,×400)of xenograft tumor sections from lean,non-obese and obese mice
3 讨 论
肥胖或脂肪组织在恶性肿瘤中的作用日益清晰,主要基于两大关键发现:①流行病学研究表明,肥胖与某些肿瘤如食管癌、子宫内膜癌、肾细胞癌的发病率增加有关;②多种类型肿瘤如胃癌、乳腺癌、结肠癌、肾癌及卵巢癌生长于脂肪组织的解剖毗邻区域,脂肪细胞是乳腺癌与腹腔转移肿瘤如胃癌、结肠癌及卵巢癌形成肿瘤微环境的主要成分之一[12]。研究表明,肥胖增加胃癌(尤其近端胃癌)的发病风险[1,5,13],能否促进胃癌的生长与进展尚不清楚。由于肥胖或脂肪组织的生物学效应众多,因此弄清肥胖与胃癌之间的关系也颇为复杂。
本研究通过小鼠胃癌细胞接种于高脂饮食诱导的肥胖C57BL/6j小鼠皮下以建立移植瘤模型,系首次采用全新的体内模型以研究胃癌与肥胖之间的关系。研究结果显示,胃癌在肥胖小鼠体内生长速度明显快于非肥胖与正常小鼠,这有力地证明肥胖可直接促进胃癌的生长。肥胖小鼠体内移植瘤的快速生长不仅与胃癌细胞凋亡减少有关,而且与细胞增殖增加有关。胃癌细胞凋亡与血清胰岛素、内脂素浓度呈负相关性,细胞增殖与血清胰岛素、内脂素水平呈正相关性,这表明肥胖所致高胰岛素血症、胰岛素抵抗与肥胖或脂肪组织的内分泌功能在促进肿瘤细胞存活、增殖、减少凋亡中有着重要作用。
本研究通过简单的HE染色发现颇为意外的结果,起源于相同细胞类型的肿瘤在不同状况小鼠体内生长并出现不同的生理表型,形成迥异的肿瘤微环境。本研究中皮下胃癌移植瘤组织内可见大量的脂肪细胞,其中肥胖组明显大于非肥胖与正常组,这提示肥胖促进小鼠胃癌细胞的增殖、减少其凋亡作用与肥胖致肿瘤微环境改变有关,并在一定程度上与局部脂肪细胞的大小有关。这与脂肪组织在乳腺癌、结肠癌、多发性骨髓瘤的微环境内有着保护作用一致[14-16]。脂肪间质细胞通过分泌脂肪细胞因子以促进肿瘤生长,它有助于新生血管的形成[17],这对肿瘤体积的增大很有必要,尽管本研究未发现胃癌移植瘤组织内微血管密度方面各分组之间存在明显差异,但肥胖小鼠组微血管密度要稍高于正常组[(7.1±1.5)/hpf vs.(9.2±1.0)/hpf],这在一定程度上也提示肿瘤内微环境可能受控于白色脂肪组织通过旁分泌产生的生长因子。肿瘤微环境对肿瘤生长、进展的作用已被广泛接受,但脂肪细胞可能参与肿瘤微环境的构成这一概念较为新颖[17],需要进一步研究。而本研究的体内模型较为简易且清晰地阐释了这一概念。
肥胖人群肿瘤的形成受多种机制及代谢性因素决定,这包括胰岛素、胰岛素抵抗、炎症细胞因子以及内脂素等脂肪细胞因子,但尚不清楚肥胖或脂肪组织中哪种具体成分对肿瘤的影响关系较为密切。脂肪组织最初被单纯地认为是能量储存部位,在周围器官能量需求增加时进行能量动员。然而,1994年发现leptin之后,脂肪组织由传统的能量储存组织衍变为功能性内分泌器官,分泌脂肪细胞因子,调控全身性能量与代谢的动态平衡。脂肪细胞因子在结构上与细胞因子相似,分子量小并具有活性,主要由脂肪细胞分泌,具有多种生物学效应,参与炎症、免疫及其他代谢性效应并促进肿瘤生长、进展[12,18]。
内脂素作为新发现的脂肪细胞因子,调控组织对胰岛素的敏感性,也可能是影响肥胖相关肿瘤生长的因子中重要成员之一。血清内脂素浓度随着肥胖程度的增加而增加,并与机体的一般炎症状态有关,正受到越来越多的关注,尤其是其与肿瘤生物学之间的关系。它上调脐静脉血管内皮细胞NF-κB表达以增加MMP2/9的表达,也刺激前列腺癌、乳腺癌细胞生长、转移,并在结肠癌、恶性胶质瘤患者血清中表达升高并随肿瘤分期增加而升高[10-11]。它还可通过调控IL-6/STAT3、PI3K/Akt、ERK1/2等多种信号通路作用于靶细胞[7]。本研究中也发现小鼠血清内脂素与皮下胃癌移植瘤生长之间存在密切关系,并与移植瘤内胃癌细胞的增殖增加、凋亡减少有关。
胰岛素也可能影响肥胖调控的肿瘤进展,它通过结合胰岛素受体 A(insulin receptor A isoform,IRA)、IR-B以及异二聚体受体(包含IGF-IR与IR),再刺激下游AKT、MAPK激活,从而促进肿瘤细胞增殖[19]。本研究发现,血清内脂素、胰岛素浓度与皮下移植瘤生长密切相关,这与脂肪细胞因子或肥胖背景下产生的其他相关因子可能增强肿瘤细胞存活及实体肿瘤的生长理论相一致[4]。总之,本研究通过体内实验研究较为清楚地阐释了肥胖通过改变肿瘤微环境及可能的旁分泌脂肪细胞因子促进移植瘤体内的生长。非肥胖、正常组小鼠在体质量、空腹血糖、胰岛素、内脂素等方面彼此之间无明显区别,致它们对胃癌的存活、生长、增殖、凋亡及基因表达方面均无明显的影响,这表明饮食所致肥胖对胃癌生物学行为的影响与饮食关系不大,而与肥胖程度有关。本研究初步探讨了肥胖在胃癌中的作用,为进一步阐明肥胖在胃癌发生发展中的作用及其调节通路提供了实验资料和理论依据。
[1]FOCK KM.The epidemiology and prevention of gastric cancer[J].Aliment Pharmacol Ther,2014,40(3):250-260.
[2]SLATTERY ML,CURTIN K,WOLFF RK,et al.Diet,physical activity,and body size associations with rectal tumor mutations and epigenetic changes[J].Cancer Causes Control,2010,21(8):1237-1245.
[3]MACCIO A,MADEDDU C,GRAMIGNANO G,et al.Correlation of body mass index and leptin with tumor size and stage of disease in hormone-dependent postmenopausal breast cancer:preliminary results and therapeutic implications[J].J Mol Med(Berl),2010,88(7):677-686.
[4]VUCENIK I,STAINS JP.Obesity and cancer risk:evidence,mechanisms,and recommendations[J].Ann N Y Acad Sci,2012,1271:37-43.
[5]YANG P,ZHOU Y,CHEN B,et al.Overweight,obesity and gastric cancer risk:results from a meta-analysis of cohort studies[J].Eur J Cancer,2009,45(16):2867-2873.
[6]PRIETO-HONTORIA PL,PEREZ-MATUTE P,FERNANDEZ-GALILEA M,et al.Role of obesity-associated dysfunctional adipose tissue in cancer:A molecular nutrition approach[J].Biochim Biophys Acta,2011,1807(6):664-678.
[7]BI TQ,CHE XM.Nampt/PBEF/visfatin and cancer[J].Cancer Biol Ther,2010,10(2):119-125.
[8]PATEL ST,MISTRY T,BROWN JE,et al.A novel role for the adipokine visfatin/pre-B cell colony-enhancing factor 1 in prostate carcinogenesis[J].Peptides,2010,31(1):51-57.
[9]KIM JG,KIM EO,JEONG BR,et al.Visfatin stimulates proliferation of MCF-7 human breast cancer cells[J].Mol Cells,2010,30(4):341-345.
[10]NAKAJIMA TE,YAMADA Y,HAMANO T,et al.Adipocytokines as new promising markers of colorectal tumors:Adiponectin for colorectal adenoma and resistin and visfatin for colorectal cancer[J].Cancer Sci,2010,101(5):1286-1291.
[11]REDDY PS,UMESH S,THOTA B,et al.PBEF1/NAmPRTase/Visfatin:apotential malignant astrocytoma/glioblastoma serum marker with prognostic value[J].Cancer Biol Ther,2008,7:663-668.
[12]NIEMAN KM,ROMERO IL,VAN HOUTEN B,et al.Adipose tissue and adipocytes support tumorigenesis and metastasis[J].Biochim Biophys Acta,2013,1831(10):1533-1541.
[13]OLEFSON S,MOSS SF.Obesity and related risk factors in gastric cardia adenocarcinoma[J].Gastric Cancer,2015,18(1):23-32.
[14]IYENGAR P,COMBS TP,SHAH SJ,et al.Adipocyte-secreted factors synergistically promote mammary tumorigenesis through induction of anti-apoptotic transcriptional programs and proto-oncogene stabilization[J].Oncogene,2003,22(41):6408-6423.
[15]AMEMORI S,OOTANI A,AOKI S,et al.Adipocytes and preadipocytes promote the proliferation of colon cancer cells in vitro[J].Am J Physiol Gastrointest Liver Physiol,2007,292(3):G923-929.
[16]CAERS J,DELEU S,BELAID Z,et al.Neighboring adipocytes participate in the bone marrow microenvironment of multiple myeloma cells[J].Leukemia,2007,21(7):1580-1584.
[17]ZHANG Y,DAQUINAG A,TRAKTUEV DO,et al.White adipose tissue cells are recruited by experimental tumors and promote cancer progression in mouse models[J].Cancer Res,2009,69(12):5259-5266.
[18]TILG H,MOSCHEN AR.Adipocytokines:mediators linking adipose tissue,inflammation and immunity[J].Nat Rev Immunol,2006,6(10):772-783.
[19]HENDERSON ST,BRIERLEY GV,SURINYA KH,et al.Delineation of the IGF-II C domain elements involved in binding and activation of the IR-A,IR-B and IGF-IR[J].Growth Horm IGF Res,2015,25(1):20-27.
