突变型低氧诱导因子1α加速骨缺损部位新血管生成的实验观察
2015-02-18郜玉忠
王 皓,李 谌,郜玉忠
(辽宁医学院附属第一医院:1.骨关节二病区;2.生物样本库,辽宁锦州 121001)
充足的血供是骨缺损再生的必要条件[1-4],只有尽早地在骨缺损局部构建有效的血管网络,才能为成骨分化活动提供营养支持和代谢保证。血管新生过程受一系列生长因子调节[5-7],这些生长因子相互协调及补充。人们在探索多基因治疗的同时,正在寻求能调控多基因表达的因子,以诱导生理功能完整的血管新生。低氧诱导因子1α(hypoxia-inducible factor 1α,HIF1α)在促血管新生中的作用日益显著,被认为是最具有临床应用前景的基因[8-12]。
HIF1作为促进血管内皮生长因子(vascular endothelial growth factor,VEGF)等刺激血管形成的上游基因,可以促进VEGF等基因及其受体的表达,在维持成骨微环境方面有更广泛的生理作用。但HIF1α仅能在低氧条件下表达并积累,其CDS区中氧依赖性降解结构域(oxygen dependent degradation domain,ODDD)中的第402、564位脯氨酸不能被羟化是HIF1α很快被降解(数分钟内)[13-16]的主要原因。同时LANDO等[17]报道 HIF1α的转录活性由于其CDS区第803位天冬酰胺的作用而减低。这提示第402、564位脯氨酸和第803位天冬酰胺都是HIF1α的重要位点。为了能够发挥HIF1α在常氧条件下的最强转录活性,本研究将同时突变第402、564和第803位氨基酸,并检测该基因mRNA、蛋白表达情况及在骨缺损区域促血管新生情况。
1 材料与方法
1.1 实验动物及主要试剂 纯种新西兰大白兔33只,月龄3~4个月,体质量2.0~2.8kg,雌雄不限,辽宁医学院实验动物中心提供,动物许可证号:SCXK(辽)2003-0007,实验动物操作过程遵循实验动物福利要求并获辽宁医学院实验动物伦理委员会批准。含人HIF1α基因供体质粒(美国Clontech公司),腺病毒pAdEasy-1系统、病毒滴度检测试剂盒(美国Stratagene公司),DNA连接试剂盒、凝胶回收试剂盒、质粒小提试剂盒、pMD19-T Simple Vector、Marker、RT-PCR 试 剂 盒、限 制 性 内 切 酶 (日 本TaKaRa公司),PmeⅠ、PacⅠ(美国 NEB公司),超纯质粒提取试剂盒(德国 QIAGEN公司),Lipofectamine 2000、OPTI-MEM、Trizol(美国Invitrogen公司),兔抗人HIF1α单克隆抗体、山羊抗兔二抗、βactin(美国Santa Cruz公司),DMEM 培养基、胰蛋白酶、胎牛血清(美国Gibco公司),HEK293A细胞,DH5α感受态细胞,A-W MGC生物载体及其他常规试剂(辽宁医学院附属第一医院中心实验室提供)。
1.2 引物序列 引物设计、合成,基因测序(日本TaKaRa公司):HIF1α基因定点突变区引物6条;RT-PCR反应引物4条(表1)。

表1 PCR引物序列Tab.1 PCR primers sequence
1.3 HIF1α基因定点突变、腺病毒载体构建及转染①基因定点突变。利用突变引物以含人HIF1α基因供体质粒为模板进行第1次PCR扩增(反应条件:98℃10s,55℃10s,72℃30s,30个循环;72℃10 min,1个循环)。回收PCR产物作为模板进行第2次PCR扩增(反应条件:98℃10s,55℃10s,72℃1min,共30个循环;72℃10min,1个循环)。回收约1 800bp产物片段后利用SalⅠ/PstⅠ进行双酶切,经乙醇沉淀纯化后与pMD19-T Simple Vector连接,连接产物转化DH5α后在LB固体培养基上划平板进行细菌培养16h,筛选阳性克隆进行HIF1α突变基因测序鉴定,完成突变体克隆(突变后HIF1α基因写作HIF1αmu)。②腺病毒载体的构建及包装。以突变克隆体和pAdEasy-1中pShuttle载体为底物建立两个双酶切反应体系,回收2.5kb的HIF1αmu片段和8.9kb的pShuttle载体片段,连接重组后筛选阳性克隆进行测序鉴定,构建成腺病毒穿梭重组体(pShuttle-HIF1αmu-IRES-hrGFP-1);上 述 产 物 经PmeⅠ酶切后与pAdEasy-1中BJ5183感受态细胞混合于电穿孔仪中以200Ω、2.5kV、25μF为条件电击1次,构建成pAd-HIF1αmu-IRES-hrGFP-1重组体;超纯提取该重组体后经PacⅠ酶切提纯大片段,通过Lipofectamine 2000转染HEK293A细胞7d进行病毒包装,利用示踪因子hrGFP观察转染效果,反复冻融3次获得Ad-HIF1αmu-IRES-hrGFP-1病毒液,检测病毒滴度后-80℃保存备用。同理分别包装Ad-HIF1α-IRES-hrGFP-1和 Ad-IRES-hrGFP-1。③重组腺病毒转染MSCs。取新西兰大白兔1只,麻醉后常规抽取右侧胫骨平台骨髓液,分离纯化培养兔MSCs并传至第3代,将上述3种病毒液分别以最佳感染复数(multiplicity of infection,MOI)=100转染,72h后在倒置荧光显微镜下观察转染效果。
1.4 制作骨缺损实验动物模型 ①生物骨架载体术前处理。将长1.5cm,直径0.5cm的A-W MGC生物活性载体消毒及表面处理后干燥备用。将病毒液转染MSCs后72h制成2×107/mL悬液,按5×106/侧将细胞移植入A-W MGC内以37℃、50mL/L CO2浓度旋转培养48h,使得细胞在载体内部空隙内充分贴壁均匀。②骨缺损动物模型制作。将新西兰大白兔麻醉后取右侧前臂桡骨中段咬除约1.5cm形成缺损,植入前期处理后的A-W MGC载体,断端吻合,术后肌注抗生素7d,观察动物日常活动及伤口愈合情况,8周后取材。
1.5 实验分组 ①细胞内实验分组。A组:转染突变HIF1α病毒液;B组:转染未突变HIF1α病毒液;C组:转染空病毒液;D组:不转染任何病毒(空白组)。4组MSCs细胞均常规培养72h。②体内实验分组。将32只新西兰大白兔随机分为4组,每组8只;分别将上述ABCD 4组细胞移植入A-W MGC生物活性载体后制作4组骨缺损动物模型。
1.6 检测指标 ①RT-PCR检测各组细胞中HIF1α基因mRNA的表达情况。利用Trizol分别提取4组细胞的总RNA,紫外分光光度计检测A260/A280,其比值均在1.8~2.0之间。配制反应液后进行RTPCR反应(反应条件:50℃30min,94℃2min,1个循环;94℃30s,60℃30s,72℃1min,30个循环)。反应结束后取反应液5μL直接进行10g/L琼脂糖凝胶电泳,凝胶成像系统分析各条带吸光度值(A),重复实验3次,分别计算相对A值。②Western blot检测各组细胞中HIF1α基因蛋白的表达情况。通过细胞蛋白裂解液提取各组细胞总蛋白,利用BCA试剂盒检测各组蛋白浓度;配制50g/L浓缩胶与80g/L分离胶,60V×30min,150V×1h进行聚丙烯酰胺凝胶电泳,电泳结束后取下分离胶洗涤3次放入转膜仪,以100mA×30min进行转膜,转膜后孵育一抗(1∶1 500),4℃摇摆过夜,洗膜后继续孵育二抗及显影液,室温避光孵育30min,洗脱液洗涤3次终止显色反应,凝胶成像系统分析膜上目的条带与内参照A值。重复实验3次,计算相对A值。③墨汁灌注透明切片血管形态学观察手术区血管新生情况。术后8周结扎近端肱动脉及静脉,离断肱静脉,向远端肱动脉插管,用肝素生理盐水冲洗血管床残余血液后再用浓度为40g/L的甲醛、50g/L墨汁灌入肱动脉追踪血管分布情况,直至从肱静脉端流出大量的浓黑墨汁为止。将标本低温放置2h后取移植骨及缺损区两端正常的骨组织制作切片,观察血管分布情况。选载体中心部位及距离其上下0.5cm处横切片做血管面积定量分析,用图像剖析仪将整个视野划分为1 024个统计场面积(单位U),计算出视野中被灌注血管所占的统计场面积。
1.7 统计学分析 采用SPSS 18.0for Windows软件包对所得结果进行统计学分析。计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组之间比较采用t检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 HIF1α基因测序及腺病毒载体的鉴定结果 通过基因测序显示,HIF1α基因CDS区第402位脯氨酸由CCA突变成GCA(丙氨酸),第564位脯氨酸由CCC突变成GCC(丙氨酸),第803位天冬酰胺由ATT突变成AGC丙氨酸(说明:第803位天冬酰胺测序的是反义链,所以天冬酰胺正义链应为AAT,而丙氨酸正义链应为GCT)(图1)。凝胶电泳成像显示,Ad-HIF1αmu-IRES-hrGFP-1 及 Ad-HIF1α-IRES-hrGFP-1经PacⅠ酶切后均出现30kb和3kb两个条带,提示腺病毒载体构建成功(图2)。
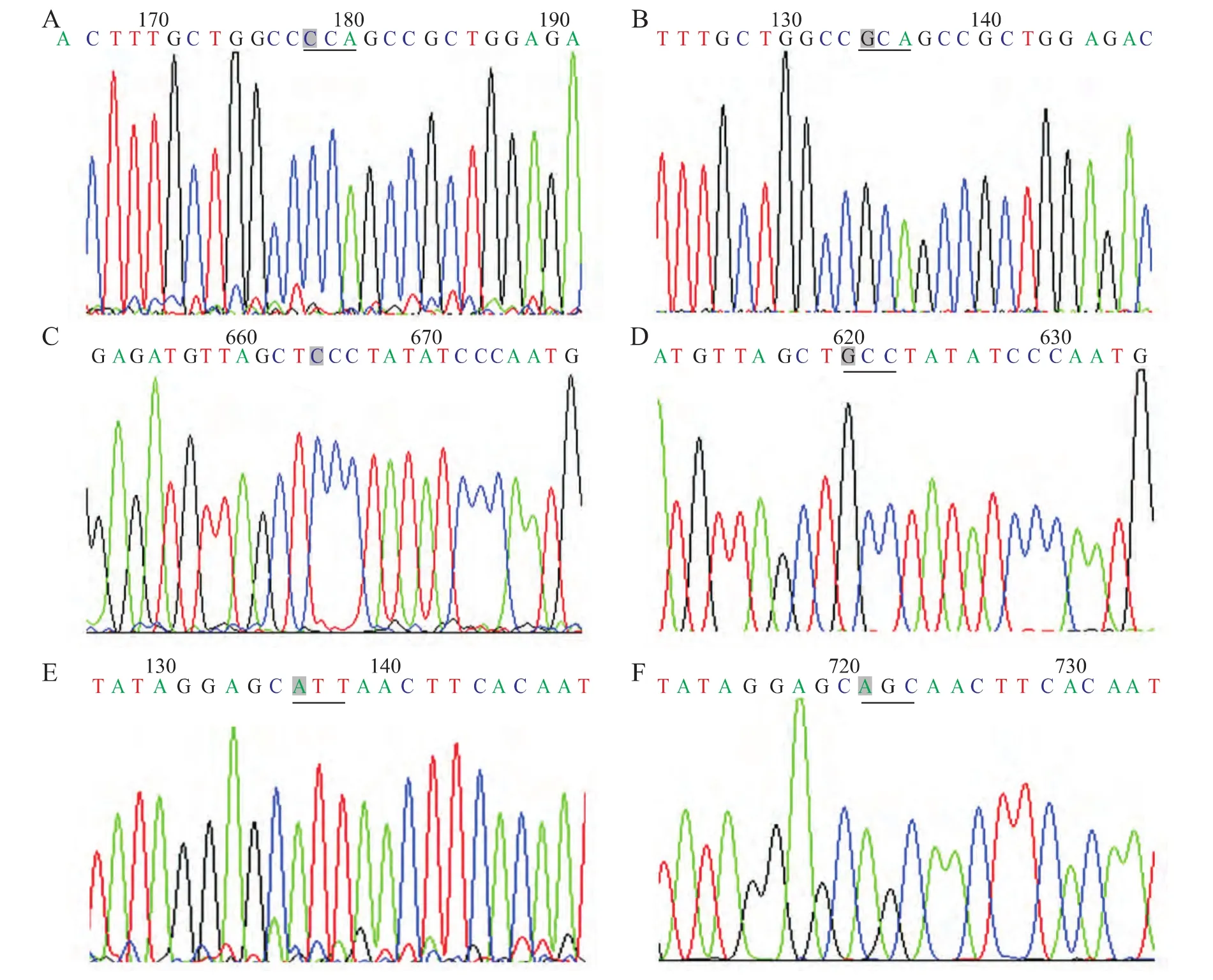
图1 HIF1α基因CDS区第402、564、803位氨基酸突变前后测序图Fig.1 The DNA sequence before and after mutation of the 402,564,and 803amino acids in CDS area of HIF1αgene

图2 HIF1α腺病毒载体酶切电泳鉴定图Fig.2 Electrophoretic map of adenovirus vectors digested by PacⅠ
2.2 腺病毒包装结果 经3种病毒重组体转染的HEK293A细胞在荧光显微镜下均观察到有大量绿色荧光蛋白表达(图3),同时均出现相似的细胞病变效应(cytopathic effect,CPE):细胞触角回收、肿胀变圆,一部分细胞脱落,悬浮于视野中(图4);病毒滴度检测结果依次为1.6×108pfu/mL、1.3×108pfu/mL和2.1×108pfu/mL。
2.3 病毒转染MSCs的表达结果 3种包装成功的病毒液在荧光显微镜下均观察到较强绿色荧光蛋白表达并且表达绿色荧光蛋白的MSCs细胞也较多,转染效率较高;而未转染任何病毒液的MSCs在荧光显微镜下并未显现出任何荧光效应(图5)。
2.4 RT-PCR 结果显示 A、B、C、D 4组细胞内HIF1αmRNA表达相对A值分别为0.91±0.12、0.98±0.10、0.05±0.02、0.04±0.01;其中,A、B两组之间差异无统计学意义(P>0.05);C、D两组之间差异也无统计学意义(P>0.05);而 A、B 2组细胞内HIF1αmRNA表达量均明显高于C、D 2组,存在统计学差异(P<0.05,图6)。
2.5 Western blot结果 A、B、C、D 4组细胞内 HIF1α蛋白表达相对 A值分别为0.86±0.11、0.07±0.02、0.05±0.02、0.06±0.03;其中B、C、D 3组之间差异无统计学意义(P>0.05);A组蛋白表达相对A值明显高于其他3组,存在统计学差异(P<0.05,图7)。
2.6 墨汁灌注透明切片血管形态学观察血管新生情况 术后8周行墨汁灌注透明切片血管形态学观察4组动物缺损区域新血管生成情况,可见A组不仅有新生血管形成,而且血管管径良好,内径完整,相互间桥接效果明显,构建成有效血管网络,均匀分布于体内骨缺损区域;而B、C、D 3组在骨折区域未见血管正常结构,无明显的血管网络生成(图8);血管面积定量分析得出A、B、C、D 4组被灌注血管所占统计场面积依次为297±27.61、2.26±0.11、1.94±0.06、3.09±0.14;B、C、D 3 组 之 间 无 显 著 性 差 异(P>0.05);A组新生血管面积明显高于其他3组,具有统计学差异(P<0.05)。

图3 腺病毒载体转染HEK293A细胞后绿色荧光分布图Fig.3 The green fluorescence expression of adenovirus vector-transfected HEK293Acells(×40)

图4 腺病毒载体转染HEK293A细胞后病毒包装图Fig.4 Virus packaging in adenovirus vector-transfected HEK293Acells(×40)

图5 转染病毒液的MSCs绿色荧光分布图Fig.5 The expression of green fluorescence in infected MSCs(×200)
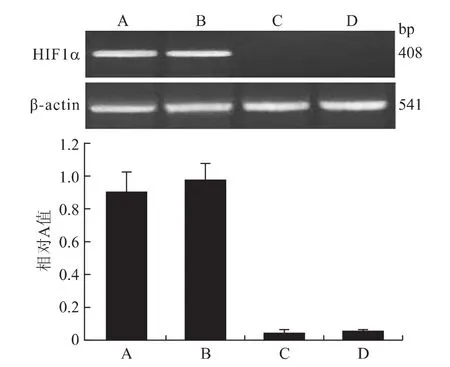
图6 各组细胞HIF1α基因mRNA表达的检测情况Fig.6 The expression of HIF1αmRNA in each group
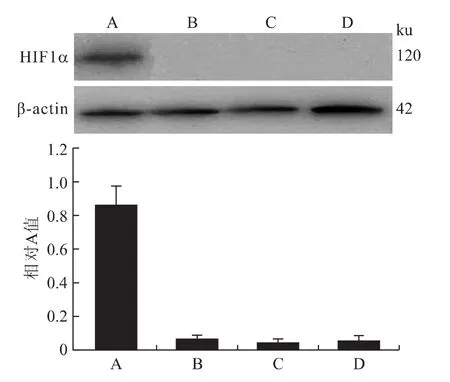
图7 各组细胞HIF1α基因蛋白表达的检测情况Fig.7 HIF1αprotein expression in each group

图8 HIF1α基因体内成血管检测墨汁灌注图Fig.8 The in vivo angiogenesis effects of HIF1αgenes
3 讨 论
3.1 HIF1α基因3点突变的意义 研究发现,HIF1α对于细胞和组织抗低氧,提高其在缺血环境下的生存能力及促进血管再生,微血管系统的形成方面有及其重要的意义[18]。本实验在不改变HIF1α其他氨基酸结构的基础上仅将ODDD中的3个关键氨基酸位点进行定点突变为丙氨酸,最大程度的保留了组成HIF1α基因的氨基酸的功能,不仅使得HIF1α在常氧条件下能够不被降解而稳定表达,又增强了其转录活性,提高了单位剂量内HIF1α蛋白的表达量。
有报道表明[19],不含ODDD的HIF1α基因转染细胞后在任何氧浓度下均可表达HIF1α活性蛋白;而在体实验表明能诱导新的成熟血管床生成,并且该重组HIF1α诱导的新生血管床稳定,转基因鼠的皮肤不出现水肿、炎症和血管渗漏且没有曲折和囊性血管形成,并在长达18个月观察期中未发现溃疡、血管瘤或皮肤原发肿瘤发生。但是,在通常情况下,大片段的基因缺失(如ODDD的缺失)可能引起蛋白某些还没被发现的功能丧失,显然发生定点突变的HIF1α所表达的蛋白从结构上和正常HIF1α蛋白要接近得多,在改变蛋白的某些特性,如易降解和易失活的同时,更有利于保留蛋白的生理功能。另有报道称[15],ODDD中的第402或564位脯氨酸单一突变也可以在任何氧浓度条件下表达该蛋白的活性。但是,一个降解羟基化位点的保留或多或少会对该基因的常氧表达起到一个抑制的作用,不如两者同时突变效果更加完善。因此,本研究中的3点突变法可能是该基因重组的较好选择。
3.2 常氧条件下HIF1αmRNA及蛋白表达结果的意义 通过对细胞内HIF1α基因mRNA和蛋白的检测发现,尽管B组细胞中HIF1α基因mRNA表达明显增加,但是蛋白检测并无任何发现,这提示了B组尽管可能引起HIF1α蛋白表达的增加,但是增加的蛋白由于其正常结构中第402和564位脯氨酸的存在,仍然被降解而不能在细胞内发生蓄积,可以推测出野生型HIF1α蛋白在常氧条件下是完全降解的,因而不能发挥它的任何功能。而C、D 2组由于未转染HIF1α基因,所以并未检测出mRNA与蛋白的表达。与B组不同的是,A组在用Western blot方法检测时能在常氧条件下检测到细胞内含有高水平的HIF1α蛋白,说明这种突变的表达载体在常氧条件下在MSCs内能够高效表达并且蛋白能在细胞内蓄积,提示降解对HIF1α表达的影响主要发生在转录后的翻译水平,即蛋白水平;而突变后HIF1α在常氧条件下较之野生型更加稳定、表达量大而不被降解。
3.3 在体实验血管新生的意义 在体实验结果表明,HIF1α基因3点突变后在体内更加复杂的生物环境下仍然能够大量聚集且表达高效蛋白,在骨缺损区域能够建立起有效的血管网络,并且新生成的血管管径完好,内径完整,能够给成骨以营养支持,促进骨折区的成骨进程;而未经突变的HIF1α在体内复杂的条件下并未形成有效的血管网络,也不能使之稳定存在,对于成骨并无任何良好效果。通过在体实验证实HIF1α3点突变后不光在体外的单一细胞环境下能够高效表达,而且将其移植入生理环境比细胞复杂百倍的动物体内后仍然可以继续高效表达并形成了新的血管网络,并且尚未发现受到体内环境中任何不可预知因素的影响,可以认为突变体在移植骨内的成血管效应是显著的。结果提示HIF1α基因3点突变体很可能为骨缺损疾病的血管新生治疗提供一种新的方向。
体内的血管新生过程中是一个极其复杂的生理过程,3点突变HIF1α基因的导入对于正常组织来说是一种非正常途径,虽然促进了新血管网络的生成,但对于参与血管新生过程中的其他因子本身的影响是未知的,并且突变后基因对于HIF1α本身其他功能的影响以及3种突变后的丙氨酸分别对HIF1α基因促血管新生功能的具体体现,都需要我们进一步进行实验研究。同时,由于我们的实验条件有限,并没有对HIF1α-VEGF促血管新生信号转导途径做进一步的实时监测与探索,对于其在体内具体的发生机制我们并不是十分的了解,仅仅通过最后得到的数据推测是局限的,还需要我们在后期的工作中继续完成。
[1]NISHIMURA R,OKUDA K.Hypoxia is important for establishing vascularization during corpus luteum formation in cattle[J].J Reprod Dev,2010,56(1):110-116.
[2]LIU D,HU L,ZHANG Z,et al.Construction of human BMP2-IRES-HIF1αmu adenovirus expression vector and its expression in mesenchymal stem cells[J].Mol Med Rep,2013,7(2):659-663.
[3]WANG GX,HU L,HU HX,et al.In vivo osteogenic activity of bone marrow stromal stem cells transfected with Ad-GFP-hBMP-2[J].Genet Mol Res,2014,13(2):4456-4465.
[4]WANG GX,HU L,ZHANG Z,et al.Construction of an adenoviral expression vector carrying FLAG and hrGFP-1 genes and its expression in bone marrow mesenchymal stem cells[J].Genet Mol Res,2014,13(1):1070-1078.
[5]SEREGIN SS,AMALFITANO A.Overcoming pre-existing adenovirus immunity by genetic engineering of adenovirus-based vectors[J].Expert Opin Biol Ther,2009,9(12):1521-1531.
[6]FIORENZO P,MONGIARDI MP,DIMITRI D,et al.HIF1-positive and HIF1-negative glioblastoma cells compete in vitro but cooperate in tumor growth in vivo[J].Int J Oncol,2010,36(4):785-791.
[7]GIATROMANOLAKI A,FISKA A,PITSIAVA D,et al.Erythropoietin receptors in endometrial carcinoma as related to HIF1{alpha}and VEGF expression[J].In Vivo,2009,23(5):699-703.
[8]SEMENZA GL.Evaluation of HIF-1inhibitors as anticancer agents[J].Drug Discov Today,2007,12(19-20):853-859.
[9]WAN C,GILBERT SR,WANG Y,et al.Activation of the hypoxia-inducible factor-1-alpha pathway accelerates[J].Proc Nat Acad Sci,2008,105(2):686-691.
[10]WANG Y,WAN C,DENG L,et al.The hypoxia-inducible factor 1 alpha pathway couples angiogenesis to osteogenesis during skeletal development[J].J Clin Invest,2007,117(6):1616-1626.
[11]KHAN TA,SELLKE FW,LAHAM RJ.Gene therapy progress and prospects:therapeutic angiogenesis for limb and myocardial ischemia[J].Gene Ther,2003,10(4):285-291.
[12]GIACCIA A,SIIM BG,JOHNSON RS.HIF-1 as a target for drug development[J].Nat Rev Drug Discov,2003,2(10):803-811.
[13]CERADINI DJ,YAO D,GROGAN RH,et al.Decreasing intracellular superoxide corrects defective ischemia-induced new vessel formation in diabetic mice[J].J Biol Chem,2008,283(16):10930-10938.
[14]EVANS CE,HUMPHRIES J,MATTOCK K,et al.Hypoxia and upregulation of hypoxia-inducible factor 1{alpha}stimulate venous thrombus recanalization[J].Arterioscler Thromb Vasc Biol,2010,30(12):2443-2451.
[15]KAZI AA,MOLITORIS KH,KOOS RD.Estrogen rapidly activates the PI3K/AKT pathway and hypoxia-inducible factor 1 and induces vascular endothelial growth factor A expression in luminal epithelial cells of the rat uterus[J].Biol Reprod,2009,81(2):378-387.
[16]BRUICK RK,MCKNIGHT SL.A conserved family of prolyl-4-hydroxylases that modify HIF[J].Science,2001,294(5545):1337-1340.
[17]LANDO D,PEET DJ,WHELAN DA,et al.Asparagine hydroxylation of the HIF transactivation domain a hypoxic switch[J].Science,2002,295(5556):858-861.
[18]LI C,LIU D,ZHANG Z,et al.Triple point-mutants of hypoxia-inducible factor-1αaccelerate in vivo angiogenesis in bone defect regions[J].Cell Biochem Biophys,2013,67(2):557-566.
[19]ELSON DA,THURSTON G,HUANG LE,et al.Induction of hypervascularity without leakage or inflammation in transgenic mice overexpressing hypoxia-inducible factor-1alpha[J].Genes Dev,2001,15(19):2520-2532.
