Survivin反义核酸联合紫杉醇对皮下荷瘤Balb/c小鼠模型的治疗作用
2015-02-18吴丽贤黄立森陈瑞家
吴丽贤,黄立森,陈瑞家,田 崛,柯 方
(1.福建医科大学药学院药理系,福建省天然药物药理学重点实验室,福建福州 350108;2.福建医科大学药学院药化系,福建福州 350108)
结肠癌是全球第三个癌症致死原因,在西方国家已经成为了导致死亡的第二大癌症疾病[1]。近年来,通过药物与药物、药物与基因及药物与蛋白等方式的联合使用大大提高了晚期结肠癌的治疗效果。生存素(survivin)是细胞凋亡蛋白家族(inhibitor of apoptosis,IAP))的新成员,其分子质量最小,作用最重要[2]。研究表明,survivin在肿瘤细胞有显著的特异性表达,survivin在分化完全的细胞组织中很少表达,但在胚胎性组织及未分化完全的组织中高表达,而在如肺癌、结肠癌、胰腺癌、乳腺癌和前列腺癌等肿瘤组织高表达中[3],其基因的反义核酸可以诱导肿瘤细胞凋亡[4-5]。紫杉醇(paclitaxel,PTX)是目前在临床应用广泛的抗癌瘤化疗药物之一,对结肠癌[6]、肺癌[7]、乳腺癌[8]、肝癌[9]等多种肿瘤具有明显的抗癌活性。然而在临床用药过程中发现,该制剂会引起严重的副作用。因此,本文拟通过建立小鼠皮下荷瘤模型,研究紫杉醇与survivin反义核酸的联合使用治疗结肠癌的作用及其机制,为临床用药提供参考。
1 材料与方法
1.1 实验动物 SPF级雄性Balb/c小鼠,5周龄,体质量(20±2)g,购自达硕生物有限公司,合格证号:FJXK(闽)2008-11;鼠源结肠癌细胞株(C26)由福建医科大学药学院天然药物药理学重点实验室培养、传代、保种。
1.2 主要试剂 类标准胎牛血清(兰州民海);鼠抗人 survivin 单 克 隆 抗 体 (Santa Cruz);一 步 法TUNEL细胞凋亡检测试剂盒(碧云天生物技术研究所);Lipofectamine2000(Life Technologies);β-actin(博奥森);survivin反义核酸(上海生工);ELC发光液(上海碧云天生物科技研究所);紫杉醇(海南轻骑海药);DAB显色剂(北京中杉)。
1.3 主要仪器 AUW120D电子分析天平(上海医用设备公司);CO2培养箱(日本SANYO公司);病理组织漂烘仪(常州中威仪器);倒置显微镜(日本OLYMPUS);垂直电泳仪及转膜仪(北京六一);细胞计数板(武汉成龙科贸有限公司);石蜡切片机、石蜡包埋仪(德国Leica);超净工作台(苏净安泰)。
1.4 实验方法 ①细胞培养。将C26细胞接种于25mL培养瓶中,用含100mL/L类标准胎牛血清的1640培养基于37℃,50mL/L CO2恒温培养箱中孵育,细胞进入对数生长期便可用于动物体内接种,细胞接种浓度为5×106个/mL。②荷瘤Balb/c小鼠模型的建立。C26细胞进入对数生长期后,以1.25g/L的胰酶消化1~2min,1 500r/min离心3min,弃上清液,用无血清的1640培养液反复冲洗细胞3次,使细胞悬浮制成细胞悬液,调整为相应浓度,取Bal b/c小鼠35只,于小鼠右侧胁肋部皮下进行接种,8d左右接种部位可见米粒状隆起,触手可及,提示C26细胞在体内正常生长增殖,且体积逐渐增大。15d后,小鼠皮下形成明显的瘤体,瘤体不规则,表面粗糙,有的表面可见结节,成瘤率为100%。各组移植瘤小鼠活动、饮食情况、大小便等反应均正常,未出现异常情况。
1.5 指标检测 待接种15d后,肿瘤长至50mm3[10],记为0天。将小鼠随机分成5组,即空白对照组(C)、Lipo2000对照组(L)、survivin反义核酸组(A)、紫杉醇组(T)、survivin反义核酸联合紫杉醇组(A+T),每组7只。每隔1d尾静脉注射给药一次,共给药7次,给药剂量为空白组给予相应体积的生理盐水,Lipo2000对照组给予相应体积的脂质体,survivin反义核酸剂量为50μg/kg,survivin反义核酸质粒取50μg与50μL的Lipo2000+转染液200μL混悬均匀后局部瘤内多点注射[11],紫杉醇10mg/kg,survivin反义核酸联合紫杉醇组除同反义组一样注射survivin反义核酸外,隔天加注一次紫杉醇溶液。从0d起,每隔1d测量1次肿瘤半径及小鼠体质量,先测量肿瘤的最大径(a),再测量与最大径线垂直的最长径(b),单位为mm,按V(mm3)=a×b2/2计算肿瘤体积:记录每次肿瘤体积,根据以下公式计算相对肿瘤体积(relative tumor volumn,RTV)及相对肿瘤增殖率(T/C):RTV(相对肿瘤体积)=Vt/V0,式中V0为第0天测量的肿瘤体积,Vt为第t天测量的肿瘤体积。T/C(相对肿瘤增殖率)=TRTV/CRTV×100%,TRTV代表治疗组的相对肿瘤体积;CRTV代表空白组的相对肿瘤体积。
与此同时,记录各组小鼠的体质量情况,取平均值,根据统计数据绘小鼠体质量变化曲线。待给药结束后,迅速取出肿瘤并称取质量,并根据以下公式计算抑瘤率。抑瘤率(TIR)=(对照组平均瘤质量-给药组平均瘤质量)/对照组平均瘤质量×100%。
1.5.1 TUNEL检测凋亡细胞 取出各组小鼠的肿瘤组织后,称取质量,用刀片沿肿瘤组织正中间剖开,剥离坏死部分,剥离干净后,以40g/L多聚甲醛固定,置于4℃冰箱冷藏备用,具体操作过程按照Promega说明书进行TUNEL检测。
1.5.2 Western blot检测survivin蛋白的表达 收集各组肿瘤组织100mg,将组织置于预冷的培养皿中,将其剪碎,滴加RIPA液使组织悬浮,将组织置于冰上匀浆,直至匀浆光滑,转移匀浆至EP管中,4℃2 000 r/min离心20min,将上清液转移至另外EP管中,4℃18 000r/min离心45min,保存上清液,考马斯亮兰测定蛋白质浓度,样品以上样缓冲液稀释后煮沸5min使蛋白变性,备用。灌制80g/L SDS-PAGE凝胶,取已制备好的细胞蛋白,每孔上样量20μL在150V稳压电场中电泳,电泳后用250mA电流将蛋白置于纤维素滤膜上,脱脂奶粉封闭1h,按照分离胶的形状和大小剪膜,根据分子质量分开后分别以加入PBS缓冲液按1∶1 000稀释的一抗(survivin)室温孵育1h,洗膜3次,将膜与以1∶500稀释的HRP标记二抗共同孵育1h后洗膜,暗室中X光片曝光,Gel-analyze分析软件分析条带灰度,进行半定量比较分析,每个条带重复分析5次,取均值。
1.6 统计学处理 应用SPSS 17.0统计软件进行统计学分析,采用单因素方差分析进行两两比较,各组数据均用均数±标准差(±s)表示,以P<0.05为差异有统计学意义。
2 结 果
2.1 联合用药对瘤体相对肿瘤增殖率及抑瘤率的影响 取材后立即称取小鼠的肿瘤质量并记录,计算相对肿瘤增殖率(T/C)及抑瘤率数据(表1)。由表1的数据可知,上述各治疗组均达到了(T/C)<60%且P<0.05,体内证实有效。小鼠瘤质量的抑瘤率显示各给药组均有一定的治疗效果,且与C组相比均存在显著性差异(P<0.05)。从抑制肿瘤质量增长方面而言,二者联合用药[瘤质量抑瘤率为(54.16±0.32%)]将紫杉醇[瘤重抑瘤率为(21.82±0.84)%]的抗癌活性提高了59%以上。
表1 肿瘤平均质量、抑瘤率及T/C的比较Tab.1 Comparison of average tumor weight,inhibition rate and T/C(n=7,±s)

表1 肿瘤平均质量、抑瘤率及T/C的比较Tab.1 Comparison of average tumor weight,inhibition rate and T/C(n=7,±s)
表中P值表示给药组T/C与L组T/C比较的所得值;与L组比较,*P<0.05,**P<0.01。
组别 肿瘤质量(g) 抑瘤率(%) T/C(%) P值C 4.21±1.03 0.00±0.00 - -L 4.06±1.34 3.56±1.34 - -T 3.29±0.84* 21.82±0.84* 54.39±2.57 0.041 A 2.89±0.57* 31.35±0.57* 56.29±3.24 0.043 A+T 1.93±0.32** 54.16±0.32**31.05±2.40 0.022
2.2 TUNEL染色法检测联合用药对肿瘤细胞凋亡指数的影响 凋亡指数[12](apoptosis index)是指每张TUNEL阳性切片(显示绿色荧光的切片)中(图1),选取4个阳性细胞数(肿瘤凋亡阳性细胞为细胞核被染为棕黄色的细胞)最多的高倍视野(×400),计算400个腺泡细胞中阳性细胞所占的百分比,该百分比记为凋亡指数。凋亡指数的统计数据(图2)。由图1的TUNEL染色图及图2的凋亡指数可知,空白对照组几乎没有肿瘤细胞凋亡。T组及A组有一定量的凋亡细胞,以上试验结果提示,紫杉醇具有促进肿瘤细胞凋亡的能力,A+T不仅加强了对肿瘤细胞的杀伤作用,而且二者的协同作用可能对肿瘤耐药性有所影响,最终使得其促肿瘤细胞凋亡的作用尤为显著。
2.3 联合用药对荷瘤小鼠肿瘤组织survivin蛋白表达的影响 结果显示,A+T组survivin蛋白表达明显降低,而不影响β-actin的表达,C组和L组相比无明显变化,T组、A组、A+T组A值的比值分别为0.705±0.011、0.654±0.037、0.345±0.019。经方差分析,A+T组与C、L、A、T组的积分吸光度(IA)比值存在统计学差异(P<0.05,表2、图3)。
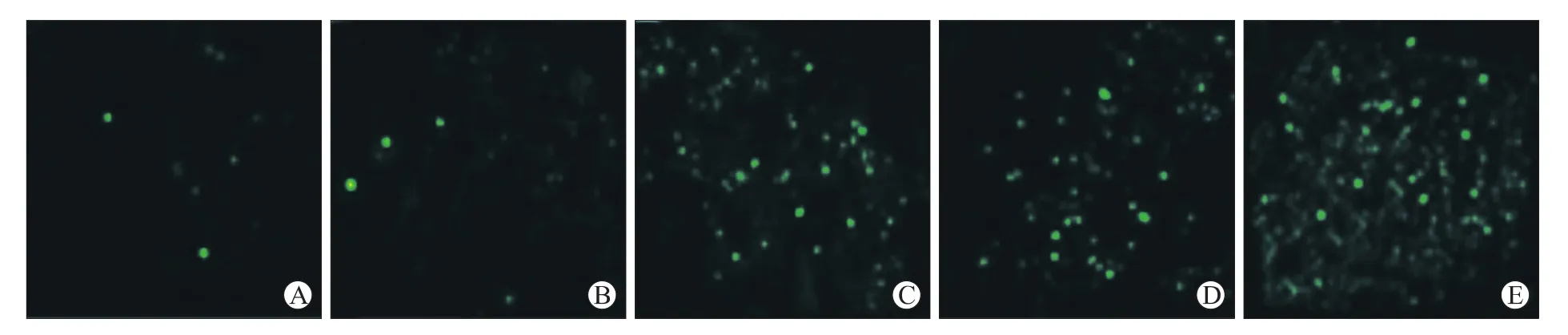
图1 肿瘤组织TUNEL免疫组化染色情况Fig.1 TUNEL immunohistochemical staining of tumor tissue(×400)

图2 TUNEL染色法检测各组对荷瘤小鼠肿瘤组织凋亡指数的影响Fig.2 Effects of apoptosis index of subcutaneous xenograft Bal b/c in each group by TUNEL immunohistochemical staining

表2 联合用药对荷瘤小鼠肿瘤组织survivin蛋白表达的影响Tab.2 Effects of survivin antisense nucleic acid combined with paclitaxel on survivin protein expression in tumor tissue in subcutaneous xenograft Bal b/c

图3 各组肿瘤组织survivin蛋白表达的情况Fig.3 The survivin protein expression in tumor tissue in each group
3 讨 论
研究发现,针对survivin基因的反义核酸能诱导肿瘤细胞凋亡并提高肿瘤细胞对化疗药物的敏感性,体外研究证实利用survivin反义核酸封闭survivin基因表达,能提高耐药结肠癌细胞株LoVo/Adr对泰素帝的敏感性[13]。近年有关survivin的研究,肿瘤中存在有survivin蛋白水平和mRNA水平的增高,其高表达及由此导致的凋亡抑制与肿瘤的发生、发展有密切的关系[3]。紫杉醇是一种紫杉类高效抗肿瘤药物,能抑制肿瘤细胞的有丝分裂和增殖。因此,推测封闭survivin蛋白表达并与紫杉醇联合应用可发挥两者的协同抗肿瘤作用。但是,单用反义核酸体内治疗肿瘤用量大、成本高;单用化疗药物用量大,副作用多,而采用反义核酸和化疗药物联合使用,可从不同的机制来抑制肿瘤细胞的生长,不仅减少了各种药物的用量、降低药物耐药性,而且还能发挥协同抗肿瘤作用[14]。
研究证明,药物干预的末次相对肿瘤增殖率(T/C)<60%且P<0.05,则表示该药物抗肿瘤功效确切[15]。本研究中,各治疗组末次相对肿瘤增殖率均达到了(T/C)<60%,与L组比较差异有统计学意义(P<0.05),说明药物干预体内证实有效;小鼠瘤质量的抑瘤率的观察显示各给药组均有一定的治疗效果,且与空白组相比,差异均具有统计学意义(P<0.05);从抑制肿瘤质量增长方面而言,survivin反义核酸与紫杉醇联合用药[瘤质量抑瘤率为(54.16±0.32)%]将紫杉醇 [瘤质量抑瘤率为 (21.82±0.84%)]的抗癌活性提高了59%以上。TUNEL法是目前最常用的检测凋亡方法之一,细胞凋亡时早期DNA可出现断裂而产生很多带3′-OH末端的DNA片段,DNA末端转移酶(TdT)可将经直接或间接标记的dNTP连接到3′-OH端,再通过酶联显色或荧光检测定量分析凋亡[3]。由本研究凋亡指数可知,空白对照组几乎没有肿瘤细胞凋亡,T组及A组有一定量的凋亡细胞,以上试验结果提示,紫杉醇具有促进肿瘤细胞凋亡的能力,survivin反义核酸与紫杉醇联合用药不仅加强了对肿瘤细胞的杀伤作用,而且二者的协同作用可能对肿瘤耐药性有所影响,最终使得其促肿瘤细胞凋亡的作用尤为显著。Survivin蛋白表达的结果显示,survivin反义核酸与紫杉醇联合用药组survivin蛋白表达明显降低,而不影响β-actin的表达,C组和L组相比无明显变化,T组、A组、A+T组A 值的比值分别为0.705±0.011、0.654±0.037、0.345±0.019,经方差分析,A+T组与C、L、A、T组的蛋白表达量差异具有统计学意义(P<0.05),提示二者联合用药可能通过降低survivin蛋白表达诱导细胞凋亡。
综上所述,survivin反义核酸、紫杉醇能降低荷瘤小鼠结肠癌组织中survivin蛋白表达,抑制肿瘤增殖,促进凋亡;但二者联用后,抗瘤作用更明显,将单用紫杉醇抗癌的活性提高了59%以上,说明survivin反义核酸能增强紫杉醇抗癌的敏感性,二者协同作用使其促肿瘤细胞凋亡的作用尤为显著。
[1]POHL M,SCHMIEGEL W.Colorectal cancer-personalized,stageadjusted tumour therapy[J].Dtsch Med Wochenschr,2013,138(36):1790-1795.
[2]MOBAHAT M,NARENDRAN A,RIABOWOL K.Survivin as a preferential target for cancer therapy[J].Int J MolSci,2014,15:2494-2516.
[3]朱晓东.Survivin在紫杉醇抗肿瘤机制中作用及其反义核酸干预胃癌形成的研究[D].复旦大学,2003.
[4]DOUGLAS G,PAUL JK,SIMONA T.Transgenic expression of survivin in keratinocytes counteracts UVB-induced apoptosis and cooperates with loss of p53[J].J Clin Invest,2001,117(2):487-487.
[5]YAMAMOTO T,MANOME Y,NAKAMURA M,et al.Downregulation of survivin expression by induction of the effector cell protease receptor-1reduces tumor growth potential and results in an increased sensitivity to anticancer agents in human colon cancer[J].Res Gate,2002,38(17):2316-2324.
[6]SMITH KT,ANITHA A,FURUIKE T,et al.In vitro evaluation of paclitaxel loaded amorphous chitin nanoparticles for colon cancer drug delivery[J].Colloids Surf B Biointerfaces,2013,104(3):245-253.
[7]SHIN J,YANG Y,HEO P,et al.pH-responsive high-density lipoprotein-like nanoparticles to release paclitaxel at acidic pH in cancer chemotherapy[J].Int J Nanomedicine,2012,7:2805-2816.
[8]CAI J,CHEN S,ZHANG W,et al.Paeonol reverses paclitaxel resistance in human breast cancer cells by regulating the expression of transgelin2[J].Phytomedicine,2014,21(7):984-991.
[9]JIN X,MO R,DING Y,et al.Paclitaxel-loaded N-octyl-O-sulfate chitosan micelles for superior cancer therapeutic efficacy and overcoming drug resistance[J].Mol Pharm,2014,11(1):145-157.
[10]KIM D,LEE IH,KIM S,et al.A specific STAT3-binding peptide exerts antiproliferative effects and antitumor activity by inhibiting STAT3 phosphorylation and signaling[J].Cancer Res,2014,74(8):2144-2151.
[11]连彦,陈道达,黄韬.生存素反义核酸联合泰素帝治疗荷耐药结肠癌移植瘤裸鼠的初步观察[J].肿瘤防治研究,2007,34(11):833-835.
[12]LIAN Y,XIE L,CHEN M,et al.Effects of an astragalus polysaccharide and rhein combination on apoptosis in rats with chronic renal failure[J].Evid based Complem Altern Med,2014,11(3):291-299.
[13]连彦军,陈道达,黄韬.生存素反义核酸增加人结肠癌对泰素帝的化疗敏感性[J].中华胃肠外科杂志,2005,8(5):455-458.
[14]吴风云,黄光胜,蒋建伟,等.生存素反义核酸抑制肝癌细胞增殖及对5.FU的增敏作用[J].南方医科大学学报,2010,30(2):304-307.
[15]沈富兵,杨春,雷宁,等.特异性溶瘤重组腺病毒KH901对荷瘤鼠肿瘤生长的抑制作用和表达GM-CSF的研究[J].四川大学学报:医学版,2007,38(3):386-390.
