CHOP在间歇低氧大鼠认知功能减退中的表达及意义
2015-02-18王红阳段丽君赵雅宁韩广超王亚囡曹进丽
王红阳,段丽君,赵雅宁,韩广超,张 敏,王亚囡,王 玲,曹进丽
(河北联合大学:1.附属医院呼吸内科;2.康复医学院社区护理学;3.呼吸病研究所,河北唐山 063000)
睡眠呼吸暂停低通气综合征(sleep apnea-hypopnea syndrome,SAHS)是常见的一种呼吸系统疾病,其中以阻塞性(OSAHS)最多见。有文献报道,OSAHS患者存在神经心理的改变[1]。进一步的研究证实,OSAHS对大脑的精神运动功能、认知领域有深刻的影响,并引起注意力、记忆力和执行功能等方面的减退[2-3]。C/EBP同源蛋白(C/EBP homologous protein,CHOP)是介导细胞凋亡的重要分子之一。有实验表明,CHOP参与了高血压全脑缺血、局灶性脑缺血再灌注及帕金森等疾病的神经元凋亡[4-6],但关于CHOP在OSAHS导致的认知功能减退中的意义鲜见相关报导。本研究通过建立慢性间歇低氧大鼠模型模拟睡眠呼吸暂停低通气模式低氧的病理特点,结合行为学的变化观察大鼠海马神经元CHOP、细胞凋亡的动态变化,探讨CHOP与间歇性低氧大鼠认知功能减退的关系。
1 材料与方法
1.1 主要材料 成年雄性 Wistar大鼠75只,体质量(150±10)g,购于天津市山川红实验动物科技有限公司;CHOP兔抗鼠多克隆抗体(北京博奥森生物技术有限公司);TUNEL试剂盒(Roche公司);Morris水迷宫系统DMS-2型,购自中国医学科学院药物研究所HMIAS-2000。
1.2 动物分组与模型制备 用随机数字表法将大鼠分为正常组(NC组)、5%间歇低氧组(5%CIH组)、10%间歇低氧组(10%CIH组),各组又分为3、7、14、21、28d时间亚组,每个时间亚组各5只。参照相关文献[7-8],NC 组、10%CIH 组、5%CIH 组于每日8∶00~16∶00暴露8h。NC组:向低氧箱内持续注入空气120s,流速为10L/min,监测氧浓度维持在21%;5%CIH组:向氧舱内循环充入氮气30s(流速为10L/min),其次输入40s高流量压缩空气(流速为10L/min复氧时间),最后50s为低流量压缩空气(流速为5L/min常氧维持时间),每120s为1循环,使得舱内浓度在5%~21%间循环;10%CIH组:向氧舱内循环充入氮气30s(流速为5L/min),其次输入40s高流量压缩空气(流速为10L/min复氧时间),最后50s为低流量压缩空气(流速为5L/min常氧维持时间),维持氧浓度在21%,每2min为1循环,使得舱内浓度在10%~21%间循环。用数字测氧仪监测舱内氧浓度变化,使舱内氧浓度维持在各自的氧浓度内,使其氧浓度波动范围在±0.5%以内。实验结束后取出实验动物,送入常规饲养箱内自由饮水与摄食,生活环境及饲养条件相同。分别在实验第3、7、14、21、28天结束后进行所设指标检测。
1.3 水迷宫测试大鼠学习记忆功能 采用Morris水迷宫进行检测。每只动物晨起进行逃避潜伏期及穿越目标象限训练5次后,分别在上午、下午各测试6次,分别记录各组大鼠逃避潜伏期时间(s)及撤去平台后动物穿越目标象限的时间,取检测记录的总均值。
1.4 海马CA1区CHOP的免疫组化检测 常规麻醉动物,开胸、暴露心,40g/L多聚甲醛行心灌流,断头取脑,在视交叉后1mm和6mm处冠状面切开,取中间块入40g/L多聚甲醛溶液固定,石蜡包埋,切片(片厚5μm)。切片常规脱蜡至水,枸橼酸盐高压修复,滴加CHOP抗体(1∶200),湿盒中4℃过夜,IgG抗体-HRP多聚体(PV二步法),37℃温箱40min,DAB显色,脱水、透明、封片。以PBS代替一抗作阴性对照。镜下观察并摄片,取各组各时间点10张标本片在光学显微镜下以相同倍数(40×10)分别选取不同部位摄片,利用Motic医学图像分析系统对免疫组化分析模块行单点分割法分析,取相同面积阳性目标的积分吸光度值(IA)。
1.5 海马神经细胞凋亡的测定及判定 采用DNA末端原位标记法(TUNEL)检测,切片常规脱蜡水化,30mL/L H2O2室温处理10min后Proteinase K 37℃消化20min,TBS洗5min×3次,滴加TUNEL工作液20μL置于湿盒中,37℃标记70min,TBS洗5min×3次,滴加POD-转化液20μL,置于湿盒中,37℃孵育30min,TBS洗5min×3次。DAB显色,苏木素复染、酸化、水化,梯度乙醇脱水、二甲苯透明,中性树胶封片。镜下观察,每张切片在相同倍数(20×10)镜下随机选取10个高倍视野,分别计算凋亡细胞数和总细胞数,细胞凋亡指数(apoptotic index,AI)=凋亡细胞数/总细胞数×100%。
1.6 统计学处理 采用SPSS 17.0统计软件包进行数据分析。数据用均数±标准差(±s)表示,各组间均数比较采用单因素方差分析,两两比较采用LSD法,采用Pearson相关进行相关分析,双侧检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠学习记忆功能的比较 与NC组比较,5%、10%CIH组动物逃避潜伏期的时间均延长,跨越目标象限的时间均缩短;与10%CIH组比较,5%CIH组的变化有统计学意义(P<0.05);模型组各时间亚组间两两比较均有统计学意义,且动物逃避潜伏期的时间随观察时间的延长而延长,跨越目标象限的时间随观察时间的延长而缩短(P<0.05,表1、表2)。
表1 各组大鼠逃避潜伏期时间的比较Tab.1 Comparison of the rats'escape latency time in each group(s,±s)

表1 各组大鼠逃避潜伏期时间的比较Tab.1 Comparison of the rats'escape latency time in each group(s,±s)
与NC组比较,▲P<0.05;与10%CIH 组比较,▼P<0.05;与3 d组比较,*P<0.05;与7 d组比较,#P<0.05;与14 d组比较,■P<0.05;与21 d比较,●P<0.05.
组别 NC组 10%CIH组 5%CIH组3 d 21.05±1.09 26.79±1.12▲ 28.97±1.59▲▼7 d 21.08±1.34 31.45±0.61▲* 38.45±1.12▲▼*14 d 21.81±2.07 36.43±1.23▲# 45.70±1.22▲▼#21 d 21.90±1.78 41.58±3.09▲■ 55.70±4.15▲▼■28 d 23.30±3.91 48.67±4.93▲● 69.28±3.61▲▼●
2.2 各组大鼠海马神经细胞CHOP蛋白表达的变化 间歇性低氧/复氧损伤后,CHOP于各组、各时间段均有表达。光学显微镜下观察阳性细胞以胞质表达为主,呈棕黄色或棕褐色。NC组有微量的表达,10%CIH组CHOP蛋白表达3d时少,于28d出现强表达;5%CIH组CHOP蛋白表达3d时少,于21d出现最强表达后下降(表3、图1)。
表2 各组大鼠跨越目标象限时间的比较Tab.2 Comparison of the rats'time spent crossing the target quadrant in each group(s,±s)

表2 各组大鼠跨越目标象限时间的比较Tab.2 Comparison of the rats'time spent crossing the target quadrant in each group(s,±s)
与NC组比较,▲P<0.05;与10%CIH 组比较,▼P<0.05;与3 d组比较,*P<0.05;与7 d组比较,#P<0.05;与14 d组比较,■P<0.05;与21 d比较,●P<0.05.
组别 NC组 10%CIH组 5%CIH组3 d 54.44±2.57 50.90±1.86▲ 46.00±3.10▲▼7 d 54.43±3.50 47.96±0.90▲* 39.34±0.73▲▼*14 d 51.19±5.67 42.55±2.24▲# 33.80±1.89▲▼#21 d 49.64±4.35 36.23±3.17▲■ 28.32±1.83▲▼■28 d 50.24±3.83 29.80±1.83▲● 23.74±1.99▲▼●
表3 各组大鼠海马CA1区CHOP蛋白的表达Tab.3 The expression of CHOP protein in the rats'hippocampal CA1area in each group(±s)

表3 各组大鼠海马CA1区CHOP蛋白的表达Tab.3 The expression of CHOP protein in the rats'hippocampal CA1area in each group(±s)
与NC组比较,▲P<0.05;与3 d组比较,*P<0.05;与7 d组比较,#P<0.05;与14 d组比较,■P<0.05;与21 d比较,●P<0.05。
组别 NC组 10%CIH组 5%CIH组3 d 6.14±0.82 9.64±4.87▲ 14.54±8.27▲7 d 6.24±0.66 34.67±21.44▲* 41.81±13.34▲*14 d 6.31±0.67 46.14±15.05▲# 50.11±14.07▲#21 d 6.17±0.61 60.28±10.15▲■ 90.70±33.04▲■28 d 6.20±0.69 78.61±19.21▲● 62.62±8.52▲
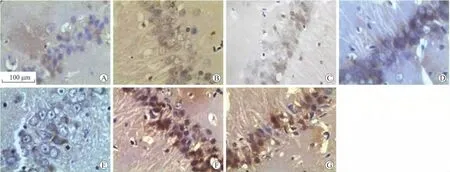
图1 不同程度间歇低氧后CHOP在海马CA1区神经元胞质中的表达变化Fig.1 Changes of CHOP expression in the rats'hippocampal CA1neurons after different degree of intermittent hypoxia(SP,×400)
2.3 各组大鼠海马CA1区神经细胞凋亡的变化间歇性低氧/复氧损伤后,各时间段均出现神经细胞凋亡。光学显微镜下观察发生凋亡的神经细胞形态不规整,大小不一致,呈圆形或椭圆形,胞核呈棕黄色或棕褐色,而非凋亡细胞胞核被苏木素复染呈蓝色,核相对较大,形态大小较为一致。与NC组比较,5%、10%CIH组海马CA1区细胞凋亡均增多,与10%CIH组比较,5%CIH组变化有统计学意义(P<0.05);3d时细胞凋亡不明显且3组间的差异无统计学意义(P>0.05);模型组各时间亚组间两两比较均有统计学意义(P<0.05),且随着低氧时间的延长,凋亡指数逐渐升高,凋亡均逐渐加重(表4,图2)。
2.4 CHOP表达与细胞凋亡、动物学习记忆功能的相关分析 双变量相关分析显示,两个间歇低氧组其CHOP蛋白表达与凋亡指数、动物逃避潜伏期均呈正相关,与跨越目标象限时间均呈负相关(表5)。
表4 各组大鼠海马CA1区神经元凋亡指数的比较Tab.4 Comparison of neuronal apoptosis index in the rats'hippocampal CA1area in each group(±s)

表4 各组大鼠海马CA1区神经元凋亡指数的比较Tab.4 Comparison of neuronal apoptosis index in the rats'hippocampal CA1area in each group(±s)
与NC组比较,▲P<0.05;与10%CIH 组比较,▼P<0.05;与3 d组比较,*P<0.05;与7 d组比较,#P<0.05;与14 d组比较,■P<0.05;与21 d比较,●P<0.05。
组别 NC组 10%CIH组 5%CIH组3 d 0.042±0.016 0.046±0.011 0.050±0.019 7 d 0.074±0.023 0.160±0.020▲* 0.248±0.029▲▼*14 d 0.073±0.024 0.271±0.055▲# 0.390±0.052▲▼#21 d 0.077±0.020 0.445±0.047▲■ 0.506±0.046▲▼■28 d 0.073±0.021 0.503±0.045▲● 0.580±0.053▲▼●

图2 不同程度间歇低氧后海马CA1区神经元的凋亡情况Fig.2 Different degree of intermittent hypoxia neuron apoptosis in hippocampal CA1area(TUNEL,×200)
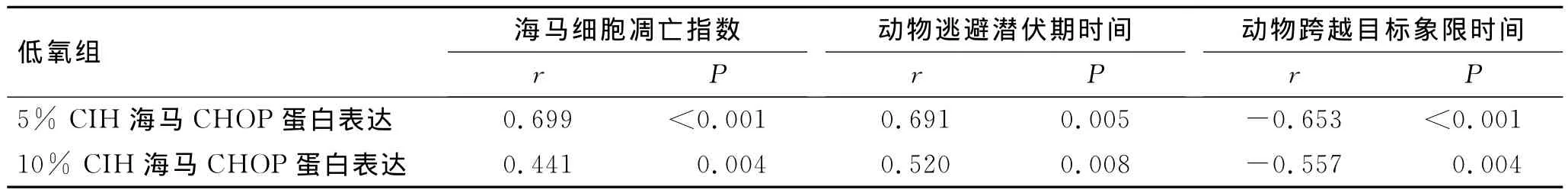
表5 间歇低氧组CHOP表达与细胞凋亡、动物学习记忆功能的相关分析Tab.5 Correlation of the expression of CHOP with cell apoptosis and learning and memory function detection in CIH groups
3 讨 论
认知功能减退的病理基础是各种理化、生物、社会心理等因素引起的学习记忆相关脑区:前额叶、边缘系统、海马等神经元、突触数目减少,导致神经递质合成下降、突触间信息传递障碍。张存雪等[9]研究认为,氧化应激可能是导致间歇低氧幼鼠认知功能障碍的主要机制,而李琳等[10]在成年大鼠的研究亦证实间歇性低氧伴有认知功能减退,并推测与缺氧后海马神经元及突触丢失等有关。本实验中Morris水迷宫学习记忆结果显示,在不同程度间歇低氧组中随着时间的延长,大鼠的学习、记忆功能严重受损,以5%CIH组为著,与既往研究结果一致。
研究表明,缺氧、氧化应激等刺激可诱导CHOP高表达,并激活其介导的上调BAX、下调Bcl-2,GADD43,活化 Caspases等细胞凋亡途径[11-12]。认知功能的减退与相关脑区的神经元丢失密切相关,有关的实验性研究已证实[13-15],高血糖、脑缺血或缺血/再灌注及急性低压低氧等损伤可引起海马神经元数量减少、形态异常或生化改变,进而导致神经元功能障碍。在HIV-1相关认知障碍研究中发现,CHOP同源蛋白之一C/EBPβmRNA及其蛋白质异形体在脑内表达增加,可刺激星形胶质细胞分泌TIMP-1,进而调节细胞外基质的合成和细胞生长/凋亡[16]。GORDON等[17]研究表明,糖原合酶-3(glycogen synthase kinse-3)抑制剂能显著的降低CHOP的表达,进而改变应激后神经元凋亡的命运[17]。在实验中,我们同时观察到随着间歇低氧时间的延长模型组海马神经元中CHOP蛋白表达逐渐升高,神经元的凋亡也逐渐增多,认知功能减退也逐渐加重,同时5%CIH组晚期CHOP表达下降可能与其神经元大量凋亡有关。由此我们推测:在间歇低氧损伤的初期,CHOP表达弱,海马神经元凋亡并不显著,认知功能减退也较轻,随着低氧损伤的持续存在,CHOP的表达增强,并激活了其介导的各种凋亡通路,导致神经元大量凋亡、神经元丢失过多,认知功能减退也随之加重。CHOU等[18]的研究亦认为减少内源性CHOP的表达可以对OSA的神经元起到保护作用。同时本实验中的相关研究结果还显示,CHOP表达趋势与细胞凋亡、动物逃避潜伏期时间呈明显正相关(P<0.01),与动物穿越目标象限时间呈明显负相关(P<0.01),更进一步说明了CHOP与间歇低氧所致认知功能减退存在着紧密的联系。
综上所述,本研究表明间歇性低氧复氧后CHOP表达水平上调,其介导的凋亡途径可能是导致低氧损伤后认知功能减退的重要机制之一。这可能对OSAHS患者认知功能障碍的治疗具有潜在的意义。
[1]LIUKKONEN K,VIRKKULA P,HAAVISTO A,et al.Symptoms at presentation in children with sleep related disorders[J].Int J Pediatr Otorhinolaryngol,2012,76(3):327-333.
[2]SALES LV,BRUIN VM,D'AlMEIDA V,et al.Cognition and biomarkers of oxidative stress in obstructive sleep apnea[J].Clinics(Sao Paulo),2013,68(4):449-455.
[3]赵雅宁,曹书华,郭霞,等.葡萄籽原花青素对慢性间歇性低氧大鼠脑组织炎症反应及学习记忆能力的影响[J].郑州大学学报:医学版,2014,49(1):29-32.
[4]赵雅宁,李建民,张盼,等.CAAT/增强子结合蛋白同源蛋白在高血压全脑缺血大鼠海马区的表达[J].西安交通大学学报:医学版,2013,34(3):320-324.
[5]申向明,杨期东,谭利明,等.大鼠局灶闹缺血再灌注后凋亡分子C/EBP同源蛋白的表达变化[J].中国动脉硬化杂志,2012,18(1):43-46.
[6]赵卿,高俊鹏,李文伟,等.前凋亡分子CHOP/GADD153的生物学特性及其在帕金森病发病中的意义[J].国际神经病学神经外科学杂志,2009,36(5):451-455.
[7]冯靖,陈宝元,郭美南,等.间歇低氧气体环境模型的建立[J].天津医科大学学报,2006,12(4):509-515.
[8]王璋,司良毅,廖友斌.大鼠睡眠呼吸暂停综合征动物模型的建立[J].中国实验动物学报,2006,14(1):40-43.
[9]张存雪,李源,周永海,等.慢性间歇低氧幼鼠认知损伤机制的研究[J].浙江医学,2007,29(12):1268-1270.
[10]李琳,王红阳,陈宝元,等.重度间歇性低氧对大鼠认知功能及海马超微结构的影响[J].西安交通大学学报:医学版,2011,32(6):687-689.
[11]YOSHIDA H.ER stress and diseases[J].FEBS J,2007,274(3):630-658.
[12]TESKE B,FUSAKIO E,ZHOU DH,et al.CHOP induces activating transcription factor 5 (ATF5)to trigger apoptosis in response to perturbations in protein homeostasis[J].Mol Biol Cell,2013,24(15):2477-2490.
[13]和亚强,马洪伟,付文亮,等.糖尿病海马损伤与认知功能障碍研究进展[J].承德医学院学报,2010,24(7):427-429.
[14]陈志则,钱巍,祁月红,等.大鼠全脑缺血再灌注损伤后神经元凋亡及认知功能的研究[J].四川医学,2010,31(5):553-555.
[15]史清海,伏建峰,葛迪,等.急性低压低氧应激导致大鼠认知功能损伤研究[J].西北国防医学杂,2012,33(1):4-7.
[16]穆卫卫,程晓莹,张艳,等.C/EBPβ与阿尔茨海默病[J].中国神经免疫学与神经病学杂志,2014,21(3):207-210.
[17]GORDON P,MARJELO A,ElEONORE B,et al.Glycogen synthase kinse-3 regulates endoplasmic reticulum (ER)stressinduced CHOP expression in neuronal cells[J].Exp Cell Res,2011,317(11):1621-1628.
[18]CHOU YT,ZHAN GX,ZHU Y,et al.C/EBP homologous binding protein(CHOP)underlies neural injury in sleep apnea model[J].Sleep,2013,36(4):481-492.
