鳀功能性水解鱼蛋白的研究
2015-02-17姜梦云洪滨杨晓霞高玉琛赵鹏马永生刘俊荣
姜梦云,洪滨,杨晓霞,高玉琛,赵鹏,马永生,刘俊荣
(1.大连海洋大学食品科学与工程学院,辽宁大连116023;2.中华人民共和国大连出入境检验检疫局,辽宁大连116600)
2013年中国鱼类海洋捕捞量达871.77万 t,其中海产低值鱼 (鳀、蓝圆鲹、金线鱼等)总产量为 223.5 万 t,约占 25.64%[1]。低值鱼的利用主要是针对鱼蛋白,主要有食用和饲用两种途径,其共同目的是提高低值鱼蛋白原料的附加值。吴忠等[2]对低值鱼分离蛋白的凝胶性进行了综述。而就饲用而言,主要有两种途径,一是用于养殖业直接投喂,二是加工成鱼粉、鱼油后,经饲料加工业再用于养殖业。
鳀是鳀属Engraulis鱼类的统称,根据FAO[3]公布的《The State of World Fisheries and Aquaculture 2014》数据表明,在海洋捕捞量前十的鱼种中,秘鲁鳀Engraulis ringens和日本鳀Engraulis japonicus分别位列第一和第九。鳀主要分布于南北半球温带水域,中国黄海和东海海域含有丰富的鳀鱼资源。近30年来,随着鱼粉工业的快速发展,鳀大多被加工成普通鱼粉作为鱼禽饲料[4]。目前中国鳀鱼捕获量逐年下降,且幼鱼比例越来越高,趋于崩溃态势;此外,鱼粉作为鱼蛋白的大宗利用形式,其对低值鱼蛋白资源价值的挖掘极其有限,因此,进一步开发高附加值功能性生物蛋白制品,将有利于中国鳀鱼资源的高效利用。
国际上,一般利用低值鱼、水产加工副产物制备生物蛋白制剂来提高鱼蛋白附加值。法国学者Ghorbel等[5]以沙丁鱼为原料,使用碱性蛋白酶、中性蛋白酶制备的脱脂沙丁鱼肉蛋白水解物,可以为米曲霉的生长提供氮源并且产生脂肪酶。巴西学者Vieira等[6]研究了巴西异鳞石首鱼的鱼片废弃物,水解后冷冻干燥,冻干产物可以作为大肠杆菌培养基。本研究中,从中国鳀鱼资源的高附加值利用为出发点,以开发生物蛋白制品为目标,对功能性生物鱼蛋白制品进行初步探索,对于实现海洋资源高效利用具有重要的研究价值,对于寻找海洋动物源培养基具有实际意义。
1 材料与方法
1.1 材料
试验用原料为鳀Engraulis ringens鱼蛋白浓缩制品即蒸汽鱼粉,由秘鲁Copeinca公司生产。
试剂主要有:MRS培养基、牛肉膏、LB培养基 (北京陆桥技术有限责任公司)、酵母膏、胰蛋白胨 (英国Oxoid公司)、商品鱼蛋白胨 (国药集团化学试剂有限公司)、碱性蛋白酶 (美国Genencor公司)和风味蛋白酶 (丹麦Novozymes公司)。
设备与仪器主要有:SW-CJ-1FD超净工作台(苏净集团苏州安泰空气技术有限公司)、ZWY-103B恒温培养振荡器 (上海智城分析仪器制造有限公司)、LDZX-30FB立式压力蒸汽灭菌器 (上海申安医疗器械厂)、PHS-3C精密pH计 (上海精密科学仪器有限公司)、HH-2数显恒温水浴锅(常州智博瑞仪器制造有限公司)、JJ-1精密增力电动搅拌器 (常州国华电器有限公司)、GL-21M高速冷冻离心机 (长沙湘仪离心机仪器有限公司)、721型可见分光光度计 (上海光谱仪器有限公司)、QZR-5移动式高速离心喷雾干燥机 (江苏省无锡市林州干燥机)。
1.2 方法
1.2.1 水解鱼蛋白的制备 准确称取鱼粉100 g,按1∶4加入蒸馏水,添加风味蛋白酶和碱性蛋白酶各0.5%,用氢氧化钠调节pH至8后,置于55℃水浴中酶解6 h;再将酶解产物置于85℃水浴中15 min后,于10 000 g下离心10 min,弃上层漂浮油脂及底部沉淀,采用硅藻土对所得酶解液过滤两次后得到水解鱼蛋白 (hydrolyzed fish protein,HFP),进一步经喷雾干燥得到浓缩分离的水解鱼蛋白 (hydrolyzed fish protein isolate,HFPI)。
(1)水解度。酶解起始和结束时分别取酶解产物15 mL,灭酶活后离心,取酶解液5 mL,加蒸馏水定容至100 mL,根据甲醛滴定法测定酶解液中氨基态氮的含量[7],用凯氏定氮法测定鱼粉的总氮含量。水解度的计算公式为

(2)得率。酶解产物灭酶活后,分别取离心前后各2 mL进行水分含量的测定。水解鱼蛋白得率计算公式为

(3)蛋白质回收率。计算公式为

1.2.2 水解鱼蛋白分析
(1)溶解性。将用硅藻土处理后得到的水解鱼蛋白 (HFP)用蒸馏水稀释至1%。取稀释液10 mL用0.5 mol/L氢氧化钠或盐酸调节pH为3、4、5、6、7、8、9、10,每个 pH组设3个平行。静置30 min后,以蒸馏水为空白,用721型可见分光光度计测量410 nm处的吸光度。
(2)一般化学组成。采用GB 5009.3—2010直接干燥法测定水分含量,采用GB 5009.4—2010测定灰分含量,采用GB/T 5009.6—2003索氏抽提法测定脂肪含量,采用GB 5009.5—2010凯氏定氮法测定粗蛋白质含量。
(3)色度。使用CR-410色彩色差仪来测定水解鱼蛋白 (HFPI)以及鱼粉 (FM)的色度,每个样品测量3次。白度计算公式为
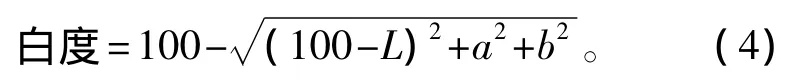
其中:L为样品的亮度,即从黑 (0)到白 (100)的颜色;a为红度 (+)或绿度 (-);b为黄度(+)或蓝度 (-)。
(4)矿物质与重金属。采用电感耦合等离子体原子发射光谱法,对最终产物即水解鱼蛋白 (HFPI)中的Zn、Cu、Ca、Na、Mg、K和 Mn等矿物质元素含量,以及Pb、Cr和Cd等重金属元素的含量进行分析。
1.2.3 微生物培养 选择牛肉膏、胰蛋白胨、酵母膏、商品鱼蛋白胨和所制备的水解鱼蛋白 (HFPI)做对比,培养菌分别为大肠杆菌Escherichia coli、枯草芽孢杆菌Bacillus subtilis、保加利亚乳酸杆菌Lactobacillus bulgaricus和酿酒酵母菌Saccharomyces cerevisiae。用LB培养基先对大肠杆菌、枯草杆菌、酵母菌隔夜振荡培养,用MRS培养基对乳酸杆菌隔夜振荡培养,各取1 mL 4种菌的菌悬液接种到100 mL自制水解鱼蛋白浓缩产物培养基中,35 ℃下振荡培养,在 0.5、1、1.5、2、3、4、5、6、7、8、24 h时测定OD600nm值。同样方法继续用其余4种市购蛋白胨对微生物进行培养,绘制出生长曲线,并计算比生长速率以及代时[8]。比生长速率 (μmax)、代时 (td)计算公式如下:

1.3 数据处理
试验数据均用Excel 2007软件进行分析处理。
2 结果与讨论
2.1 水解鱼蛋白的理化特性
2.1.1 基本化学组成 在设定条件下,经6 h酶解处理,得到水解产物的水解度为6.55%,水解鱼蛋白 (HFPI)得率为59.53%,蛋白回收率为64.61%(表1)。从表1可见,残渣中仍然残留很多蛋白质 (59.08%),可以通过对试验中的酶解条件进行优化解决,或者针对酶解残渣寻求新的利用途径;残渣中的脂肪含量过高 (15.82%),可能是由于对酶解产物离心后,部分脂肪悬挂在离心管内壁上,和残渣一起被取出。而水解蛋白浓缩产物中的脂肪含量最低 (0.52%),证明了酶解脱油效果强,用硅藻土脱油效果好,这点在实际试验过程中也能通过肉眼判断。Shahidi等[9]在研究毛鳞鱼水解产物时也发现,使用碱性蛋白酶酶解可以使油脂含量显著下降。然而,本试验中水解鱼蛋白(HFPI)的粗蛋白质、灰分和脂肪相加不足100%,这是由于水解鱼蛋白吸水性强,与空气接触后立即聚集成结块,从而导致干基质量变大。与鱼粉相比,水解鱼蛋白 (HFPI)的粗蛋白质含量升高,杂质明显下降。

表1 鱼粉、残渣、水解鱼蛋白 (HFPI)的基本成分Tab.1 Proximate composition of fish meal,residues,and hydrolyzed fish protein isolate(HFPI) %
2.1.2 水解鱼蛋白色度分析 图1为鱼粉和水解鱼蛋白 (HFPI),表2为色差分析结果。由此看出,水解鱼蛋白较鱼粉白度有较大提高,这可能是因为脱脂使其中的色素被去除,从而使颜色变浅。
2.1.3 矿物质 水解鱼蛋白 (HFPI)的矿物质和重金属元素组成中,K、Ca、Na、Mg、Zn、Cu、Mn、Pb、Cd、Cr 浓 度 分 别 为 235.00、9.80、540.90、19.09、1.75、0.17、0.03、0.16、0.12、0.18 mg/L。可以发现,所制备的功能性水解鱼蛋白 (HFPI)不仅含有 K、Ca、Na、Mg、Zn、Cu和Mn等矿物质元素,还含有微量的Pb、Cd和Cr等重金属元素,这可能是由原料鱼粉中存留所致。

图1 鳀分离鱼蛋白 (HFPI)Fig.1 Anchovy fish protein isolate(HFPI)

表2 水解鱼蛋白 (HFPI)和鱼粉色差分析Tab.2 Color analysis of fish meal and hydrolyzed fish protein isolate(HFPI)
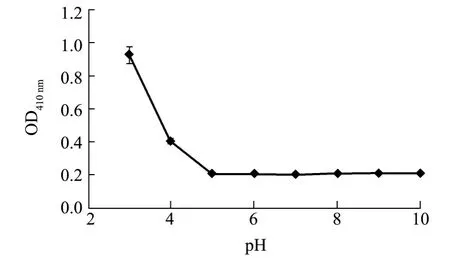
图2 pH对水解鱼蛋白 (HFP)溶解度的影响Fig.2 Effects of pH on solubility of hydrolyzed fish protein(HFP)
2.2 水解鱼蛋白对微生物的促生长特性
2.2.1 对微生物的适应范围 图2为水解鱼蛋白(HFP)在不同pH条件下的溶解度曲线。从图2可见:在低 pH范围内 (pH<5),水解鱼蛋白(HFP)开始出现浑浊,溶解性明显下降;当pH>5时,水解鱼蛋白 (HFP)保持稳定状态。理论上,水解鱼蛋白是两性的,在极端pH条件下应促进溶解性,这里出现反常,据推测可能是由于离子强度的干扰所致,在pH调节过程中,酸性范围离子强度逐渐增加,从而导致水解鱼蛋白 (HFP)发生聚集且呈现浑浊状态。Klompong等[10]在研究黄色条纹鲹的蛋白水解产物时也发现了水解物的溶解度在低pH时较差。由此可以推断,此水解鱼蛋白产物不适宜用来培养嗜酸微生物。
2.2.2 对4种微生物的促生长作用 为验证水解鱼蛋白 (HFPI)是否具备微生物促生长功能,以水解鱼蛋白 (HFPI)为对照样与商品微生物培养基进行比较,选用的4种商品微生物培养基包括牛肉膏、酵母膏、胰蛋白胨和商品鱼蛋白胨。
选择大肠杆菌、枯草芽孢杆菌、保加利亚乳酸杆菌和酿酒酵母菌4个菌种进行微生物效应分析。其中图3~图6分别为4种菌的生长曲线,表4为根据生长曲线计算出的代时比生长速率。从图3~图6可见,与4种商品培养基相比,水解鱼蛋白(HFPI)具有同样的促微生物生长特性;4种菌均在2 h左右进入指数增长期,8 h左右进入稳定期。从图4和图6的生长曲线不难发现:水解鱼蛋白(HFPI)在培养枯草芽孢杆菌及酿酒酵母上和商品鱼蛋白胨接近;在培养保加利亚乳酸杆菌上,水解鱼蛋白 (HFPI)与其他商品蛋白相比效果较优(图5)。Safari等[11]在利用黄鳍金枪鱼头部废弃制备微生物培养基的研究中发现,利用碱性蛋白酶酶解得到的水解鱼蛋白可以作为保加利亚乳酸杆菌等乳酸菌的氮源。从代时和比生长速率可以看出(表4),水解鱼蛋白(HFPI)与4种商品培养基均有相同效果。这与Aspmo等[12]利用大西洋鳕鱼内脏水解物作为微生物培养基成分的研究结果相似。
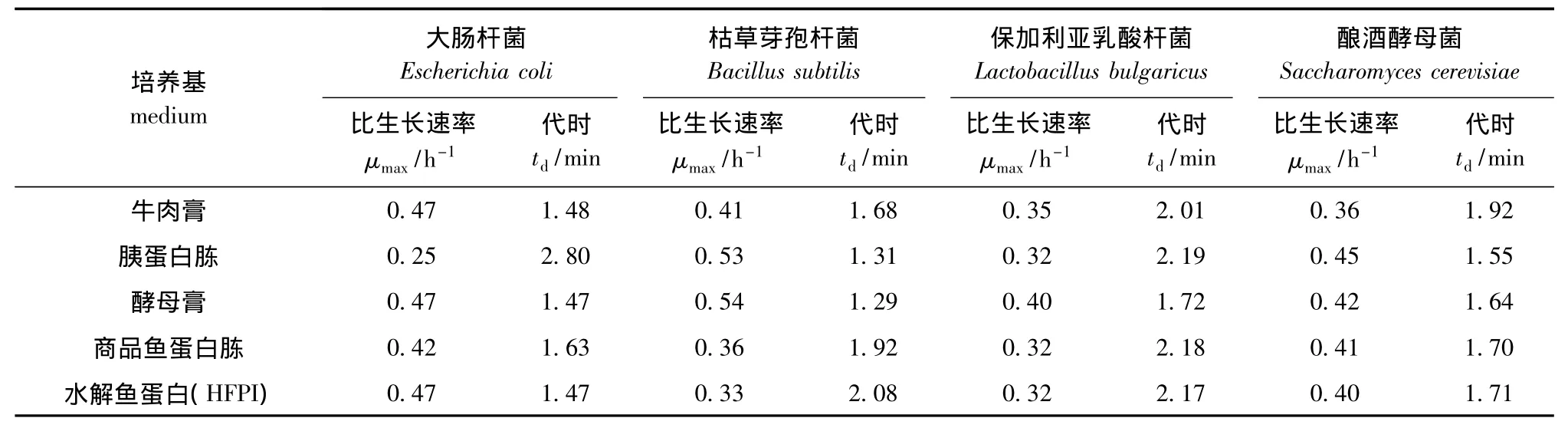
表4 4种微生物生长的代时和比生长速率Tab.4 Specific growth rate and generation time of 4 species of microorganisms
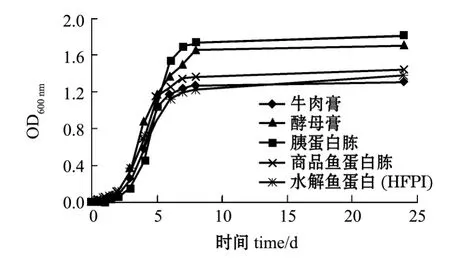
图3 大肠杆菌生长曲线Fig.3 Growth curves of Escherichia coli
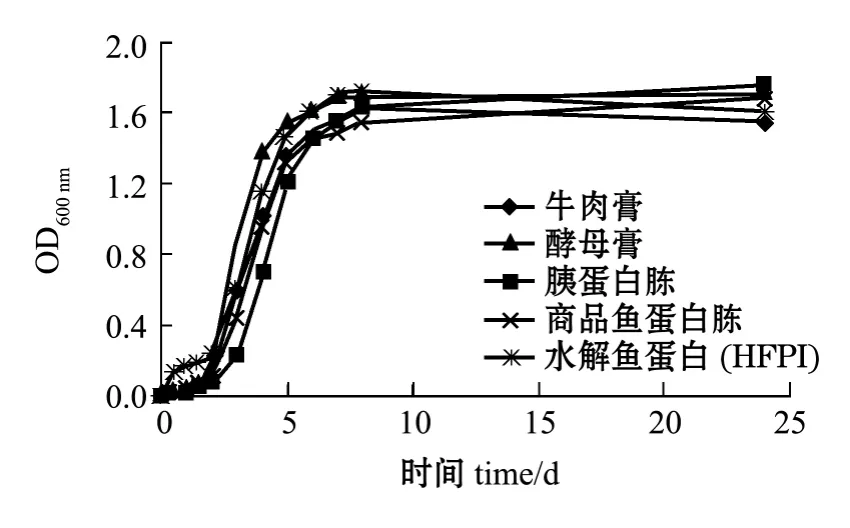
图4 枯草芽孢杆菌生长曲线Fig.4 Growth curves of Bacillus subtilis
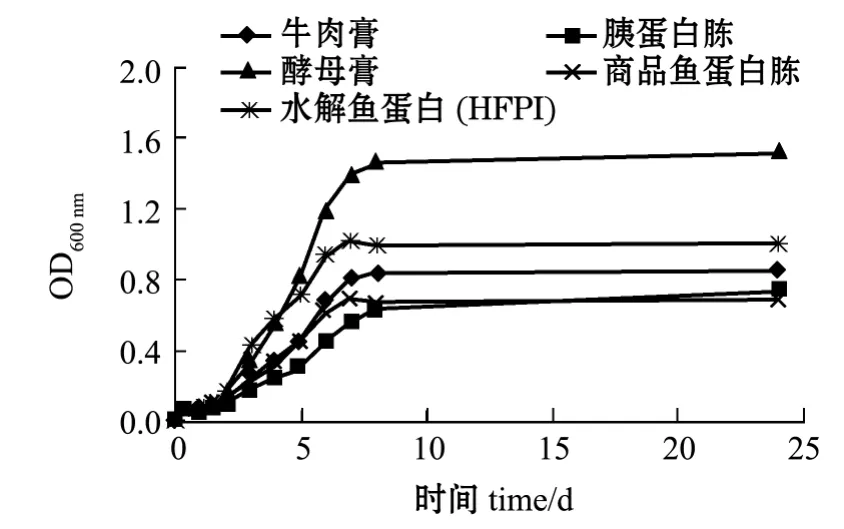
图5 保加利亚乳酸杆菌生长曲线Fig.5 Growth curves of Lactobacillus bulgaricus
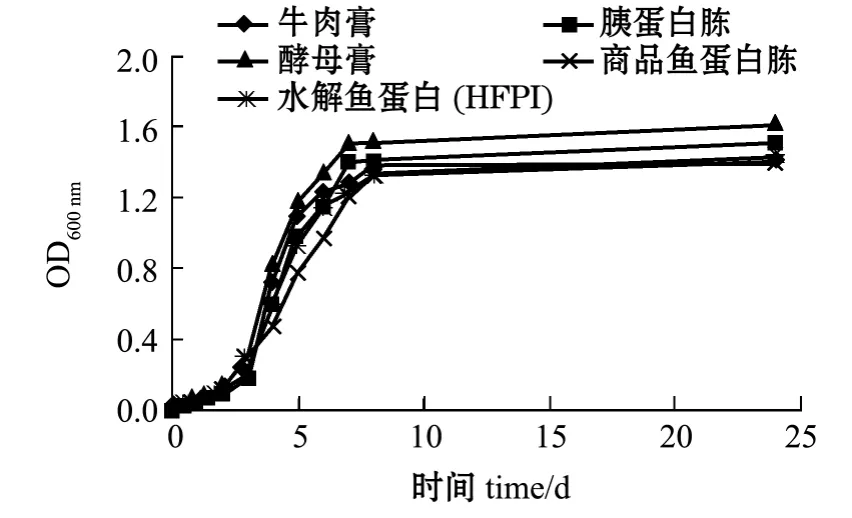
图6 酿酒酵母菌生长曲线Fig.6 Growth curves of Saccharomyces cerevisiae
3 结语
基于酶解修饰的功能性鳀分离鱼蛋白,得到的浓缩水解鱼蛋白 (HFPI)具备以下几个优势:蛋白纯度明显提高,脱脂效果良好,白度提高,且质地细腻。就微生物生长来看,除嗜酸微生物外,该水解鱼蛋白对枯草芽孢杆菌、保加利亚乳酸杆菌、大肠杆菌和酿酒酵母菌等微生物的促生长效果均显著。因此,具有微生物培养基功能的分离鱼蛋白,是提高低值鱼类附加值的有效解决途径之一。本研究表明,对鳀鱼粗分离蛋白进一步进行功能性修饰,可以获得具有更高附加值的功能性鱼蛋白制品。本研究的出发点在于探索具有促微生物生长功能性的鱼蛋白,并未针对酶解条件进行优化,今后应在此方面进一步探讨。
[1]农业部渔业渔政管理局.中国渔业统计年鉴[M].北京:中国农业出版社,2014.
[2]吴忠,刘俊荣,马永生.鱼蛋白的浓缩分离及其凝胶性的研究进展[J].大连海洋大学学报,2014,29(5):536-542.
[3]FAO.The State of World Fisheries and Aquaculture[EB/OL].Rome:FAO,2014[2015-01-12].http://www.fao.org/3/ai3720e/index.htm.
[4]康从民,王新宇,吕英波.鳀鱼的酶解加工利用[J].化学与生物工程,2011,28(3):74-77.
[5]Ghorbel S,Souissi N,Ellouz Y T,et al.Preparation and testing of Sardinella protein hydrolysates as nitrogen source for extracellular lipase production by Rhizopus oryzae[J].World Journal of Microbiology & Biotechnology,2005,21:33-38.
[6]Vieira G,Vieira R,Macrae A,et al.Short communication peptone preparation from fishing by-products[J].Journal of the Science of Food and Agriculture,2005,85:1235-1237.
[7]中华人民共和国轻工业部.GB/T 5009.39-2003酱油卫生标准的分析方法[S].北京:中国标准出版社,2003.
[8]Klompong V,Benjakul S,Kantachote D,et al.Use of protein hydrolysate from yellow stripe trevally(Selaroides leptolepis)as microbial media[J].Food Bioprocess Technol,2012,5:1317-1327.
[9]Shahidi F,Han X Q,Synowiecki J.Production and characteristics of protein hydrolysates from capelin(Mallotus villosus)[J].Food Chemisrry,1995,53:285-293.
[10]Klompong V,Benjakul S,Kantachote D,et al.Characteristics and use of yellow stripe trevally hydrolysate as culture media[J].Journal of Food Science,2009,74(6):219-225.
[11]Safari R,Motamedzadegan A,Ovissipour M,et al.Use of hydrolysates from yellowfin tuna(Thunnus albacares)heads as a complex nitrogen source for lactic acid bacteria[J].Food Bioprocess Technol,2012,5:73-79.
[12]Aspmo S I,Horn S J,Eijsink V J.Hydrolysates from Atlantic cod(Gadus morhua L.)viscera as components of microbial growth media[J].Process Biochemistry,2005,40:3714-3722.
