纳米TiO2和Cu(Ⅱ)、Zn(Ⅱ)对小球藻和新月菱形藻的毒性研究
2015-02-17胡冰王华张冬冬于春艳刘恒明
胡冰,王华,张冬冬,于春艳,刘恒明
(1.大连海洋大学水产与生命学院辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023;2.国家海洋环境监测中心,辽宁大连116023;3.大连海洋大学海洋科技与环境学院,辽宁大连116023)
纳米科技的迅猛发展,推动了纳米材料在医药、化工、环保等领域的应用[1]。其中,纳米TiO2具有良好的热稳定性、耐化学腐蚀性、光催化特性和防紫外线功能,成为目前应用最广泛的纳米半导体材料之一。但是,纳米TiO2在生产和使用过程中可能出现流失,并随着水的环境循环进入到水域生态系统中,对水生生物产生一定的毒害作用[2]。目前,纳米TiO2对水生生物的生态毒理学效应已逐渐引起人们的关注。有研究表明:纳米TiO2作用于蛋白核小球藻Chlorella pyrenoidesa时,由于TiO2极高的比表面积,可以吸附其他污染物并具有运载其进入生物体内的能力,导致其毒性增加[3];纳米TiO2还能促进藻细胞内超氧自由基的产生,抑制SOD、CAT等抗氧化酶系的抗氧化能力,并对藻类的光合速率和呼吸速率产生影响[4]。
近年来,沿海地区经济和工业的迅速发展,有毒重金属元素随工农业废水排放进入水环境,部分近岸海域重金属污染状况日益严重。海洋生态系统中的重金属污染可以引起生态系统中各级生物的不良反应,甚至危害生态系统中各类生物的生存[5]。Zn和Cu是藻类生长所必须的微量元素,但高浓度Zn能导致细胞膜通透性增加并引起细胞形态变异[6],高浓度Cu是一种典型的细胞抑制剂[7]。
微藻是水生生态系统中最重要的初级生产者,微藻的种群结构可以影响水域生态系统的物质循环和能量流动[8]。关于单一毒物对微藻的毒性作用已有较多研究[9],但在实际的水环境中,微藻可能受到多种毒物的共同作用。当纳米材料与重金属污染物在水环境中共存时,可能对微藻产生联合毒性作用,但目前有关纳米材料与重金属共存对海洋微藻联合毒性作用的研究较少。本研究中,以小球藻Chlorella sp.和新月菱形藻Nitzschia closterium为受试生物,选择TiO2纳米颗粒、重金属Cu(Ⅱ)和Zn(Ⅱ)作为毒物,考察不同浓度TiO2纳米颗粒、重金属Cu(Ⅱ)、Zn(Ⅱ)的单一急性毒性,以及TiO2纳米颗粒和Cu(Ⅱ)、TiO2纳米颗粒和Zn(Ⅱ)对小球藻和新月菱形藻的联合毒性,研究结果可为纳米材料的环境安全性评价提供参考资料。
1 材料与方法
1.1 材料
小球藻 Chlorella sp.和新月菱形藻 Nitzschia closterium由大连海洋大学藻种间提供。
纳米 TiO2(P25,Degussa),含量>99.5%,粒径约为 20 nm,混晶型。CuSO4·5H2O和ZnSO4·7H2O均为分析纯 (国药集团化学试剂有限公司)。
1.2 方法
1.2.1 试验液的配制 纳米 TiO2、Cu(Ⅱ)和Zn(Ⅱ)的储备液均用超纯水配制而成,浓度均为1 g/L,使用时稀释至试验所需浓度。试验用海水为经沙滤的大连市黑石礁近岸表层海水,盐度为30,pH为8.0,煮沸后使用。本试验中所用自然海水中Cu(Ⅱ)的本底值为 0.16 μg/L,Zn(Ⅱ)的本底值为 0.28 μg/L。
1.2.2 微藻培养 将处于指数生长期的小球藻与新月菱形藻接种到含有康威营养盐[10]的海水中,培养温度为 (20±1)℃,明暗周期为12 h∶12 h,光照强度约为3000 lx,每天摇瓶3次。小球藻起始密度约为1×106cells/mL,新月菱形藻起始密度约为 2×105cells/mL。
1.2.3 纳米 TiO2、Cu(Ⅱ)、Zn(Ⅱ)的单一毒性试验 参照微型 (单细胞)藻类毒性试验方法[11],采用96 h EC50(引起50%微藻生长被抑制的毒物浓度)作为评价指标。在预试验基础上,将纳米TiO2、Cu(Ⅱ)、Zn(Ⅱ)的浓度均设为 3.0、6.0、9.0、12.0、15.0 mg/L,空白对照组不加任何毒物,每个试验组设置3个平行。自接种之日起每隔24 h取样一次,用血球计数板计数,记录96 h的微藻生长情况。
采用SPSS 19.0软件通过概率单位法[12]计算出各个毒物的 EC50值,通过单因素方差分析法(ANOVA)对3种毒物的EC50数据进行分析,显著性水平设为0.05。
1.2.4 纳米 TiO2+Cu(Ⅱ)、TiO2+Zn(Ⅱ)的联合毒性试验 对纳米TiO2和重金属的联合毒性评定采用Marking相加指数 AI(Additive index)法[11]。以纳米TiO2、Cu(Ⅱ)、Zn(Ⅱ)的单一急性毒性试验为基础,按TiO2和Cu(Ⅱ)以及TiO2和Zn(Ⅱ)浓度比均为1∶1接种藻液,进行联合毒性试验。每隔24 h取样计数。
用SPSS 19.0软件的Probit过程计算出TiO2+Cu(Ⅱ)、TiO2+Zn(Ⅱ)对两种海洋微藻的 EC50。计算公式为

其中:M实际联合毒性生物学作用之和;a1和b1分别为纳米TiO2和重金属Cu(Ⅱ)或Zn(Ⅱ)单独暴露时的毒性;am和bm分别为纳米TiO2和重金属混合暴露下,溶液达到相同毒性时纳米TiO2和重金属的浓度。将M转换为纳米TiO2和重金属联合毒性的相加指数AI,当M≤1时,AI=1/M-1;当M≥1时,AI=1-M。通过AI可以确定纳米TiO2和重金属联合毒性的作用类型,当AI=0时,纳米TiO2和重金属联合毒性为加和作用;当AI>0时,纳米TiO2和重金属联合毒性作用为协同作用,AI加1即为混合物的毒性增大系数;当AI<0时,表示纳米TiO2和重金属联合毒性作用为拮抗作用,AI减1后绝对值的倒数即为混合毒物的毒性增大系数。
2 结果与讨论
2.1 纳米TiO2、Cu(Ⅱ)、Zn(Ⅱ)对小球藻和新月菱形藻的单一毒性
图1为纳米TiO2、Cu(Ⅱ)、Zn(Ⅱ)对小球藻24 h至96 h的EC50。从图1可见,3种毒物对小球藻的EC50均随着暴露时间的延长而降低。在24 h和48 h时,纳米TiO2对小球藻的EC50显著高于Cu(Ⅱ)、Zn(Ⅱ)的 EC50(P<0.05),说明在本试验条件下48 h内,重金属Cu(Ⅱ)和Zn(Ⅱ)的毒性强于纳米 TiO2;但在 72h时,纳米 TiO2、Cu(Ⅱ)、Zn(Ⅱ)对小球藻的EC50值相近,三者的毒性无显著性差异 (P>0.05);到96 h时,纳米TiO2和Zn(Ⅱ)对小球藻的EC50值相近,两者的毒性无显著性差异 (P>0.05),但二者对小球藻的EC50值显著高于Cu(Ⅱ)对小球藻的 EC50值 (P<0.05),说明在此时间点上Cu(Ⅱ)的毒性强于纳米TiO2和Zn(Ⅱ)。由图1还可知,从48 h至72 h,纳米TiO2对小球藻的EC50值下降极为显著,表明纳米TiO2对小球藻的毒性作用在48 h后表现更为突出。
图2为纳米TiO2、Cu(Ⅱ)、Zn(Ⅱ)对新月菱形藻在24 h至96 h的EC50。从图2可见,3种毒物对新月菱形藻的EC50均随着时间的延长而略有下降。在24 h时,3种毒物对新月菱形藻的毒性强弱顺序依次为Cu(Ⅱ)>Zn(Ⅱ)>纳米TiO2,3种毒物对新月菱形藻的毒性有显著性差异 (P<0.05);在48 h时,3种毒物对新月菱形藻的毒性强弱顺序与24 h时相同,3种毒物的毒性有显著性差异(P<0.05);在 72 h和 96 h 时,纳米 TiO2、Zn(Ⅱ)对新月菱形藻的毒性无显著性差异 (P<0.05),但Cu(Ⅱ)对新月菱形藻的毒性明显强于纳米 TiO2和Zn(Ⅱ)(P<0.05)。

图1 纳米TiO2、Cu(Ⅱ)和Zn(Ⅱ)对小球藻的EC50Fig.1 EC50of TiO2nanoparticles,Cu(Ⅱ)and Zn(Ⅱ)to Chlorella sp.

图2 纳米 TiO2、Cu(Ⅱ)和Zn(Ⅱ)对新月菱形藻的EC50Fig.2 EC50ofTiO2nanoparticles, Cu(Ⅱ)and Zn(Ⅱ)to Nitzschia closterium
此外,由图1和图2还可知,纳米TiO2对小球藻和新月菱形藻24 h EC50分别为45.843、17.591 mg/L,48 h EC50分别为 39.973、17.457 mg/L,72 h EC50分别为 11.793、13.406 mg/L,96 h EC50分别为11.655、13.693 mg/L。以上结果表明,在24 h、48 h,纳米TiO2对新月菱形藻的毒性强于对小球藻;但在72 h、96 h,纳米TiO2对小球藻的毒性强于对新月菱形藻。张宁等[13]研究发现,纳米TiO2(粒径为20~35 nm)对小球藻Chlorella sp.、中肋骨条藻Skeletonemaceae costatum、微囊藻Microcystis sp.、斜生栅藻 Scenedesmus obliquus、莱茵衣藻Chlamydomonas reinhardi的72 h EC50为10~26 mg/L,毒性表现为叶绿素a和可溶性蛋白质含量下降,脂质氢过氧化物含量积累。朱小山等[14]研究发现,纳米TiO2(粒径为20 nm,锐钛矿型)对斜生栅藻的96 h EC50为15.262 mg/L。Hund-Rinke等[15]研究了纳米TiO2对近具刺链带藻Desmodesmus subspicatus的毒性,结果表明,6 h EC50为 14 mg/L。Wang等[16]研究表明,纳米 TiO2(平均粒径为21 nm)浓度≥10 mg/L时会抑制衣藻Chlamydomonas sp.的生长。本试验研究结果基本与上述研究结果相类似。
Cu(Ⅱ)和Zn(Ⅱ)是工业发达地区近岸海域海水中常见的重金属污染物。Cu(Ⅱ)和Zn(Ⅱ)对牟氏角毛藻Chaetoceros muelleri[17]、三角褐指藻Phaeodactylum tricornutum[18]、栅藻 Scenedesmus sp.[19]的毒性顺序均为Cu(Ⅱ)>Zn(Ⅱ)。在本试验中,对两种海洋微藻的毒性强弱顺序也均为Cu(Ⅱ)>Zn(Ⅱ),与已有的研究报道一致。
2.2 纳米 TiO2+Cu(Ⅱ)、纳米 TiO2+Zn(Ⅱ)对小球藻和新月菱形藻的联合毒性效应
表1为TiO2+Cu(Ⅱ)、TiO2+Zn(Ⅱ)对小球藻和新月菱形藻联合毒性的 EC50。从表1可见,TiO2+Cu(Ⅱ)、TiO2+Zn(Ⅱ)对小球藻的96 h EC50分别为9.287、11.084 mg/L,对新月菱形藻的96 h EC50分别为 10.632、12.954 mg/L。对小球藻和新月菱形藻的联合毒性强弱顺序均为TiO2+Cu(Ⅱ)>TiO2+Zn(Ⅱ)。这可能是由于纳米TiO2粒径小,有高的表面活性、表面能和比表面积,对Cu(Ⅱ)、Zn(Ⅱ)具有一定的吸附能力[20],而Cu(Ⅱ)对海洋微藻的毒性强于Zn(Ⅱ),导致TiO2+Cu(Ⅱ)的联合毒性强于TiO2+Zn(Ⅱ)。同时,在96 h内,新月菱形藻对 TiO2+Cu(Ⅱ)或 TiO2+Zn(Ⅱ)联合毒性的耐受能力均强于小球藻,这可能与不同微藻种类对联合毒物的耐受能力不同有关。从表1还可知,TiO2+Cu(Ⅱ)、TiO2+Zn(Ⅱ)的联合效应EC50值随暴露时间的延长而减小,但减小的幅度低于单独TiO2对两种海洋微藻EC50值随暴露时间的延长而下降的幅度。
纳米TiO2在水中易于吸附其他污染物,使其对水生生物的毒性发生变化[21-22]。Hartmann等[23]研究发现,粒径为30 nm的TiO2能快速吸附水中的Cd(Ⅱ),并增加对绿藻生长的抑制,说明Cd(Ⅱ)有效浓度的减少不一定意味着重金属的毒性减弱。但是,辛元元[9]研究发现,纳米 TiO2与重金属Cd(Ⅱ)共存时,因其可吸附水中的Cd(Ⅱ),从而降低了对绿藻的毒性。本研究中运用Marking相加指数法求得纳米TiO2和重金属联合毒性的相加指数AI,结果见表2。由于纳米TiO2和重金属联合毒性的AI值均为负数,可见 TiO2+Cu(Ⅱ)、TiO2+Zn(Ⅱ)对小球藻和新月菱形藻24 h至96 h的联合毒性效应均为拮抗作用,即TiO2+Cu(Ⅱ)和TiO2+Zn(Ⅱ)对海水中小球藻或新月菱形藻的毒性效应,均小于它们分别单独作用所产生的毒性效应。本研究表明,纳米TiO2和重金属离子共同存在于海水中时,对两种海洋微藻的毒性作用会有所降低。

表1 TiO2+Cu(Ⅱ)、TiO2+Zn(Ⅱ)对小球藻和新月菱形藻的EC50Tab.1 Joint EC50of TiO2+Cu(Ⅱ)and TiO2+Zn(Ⅱ)to Chlorella sp.and Nitzschia closterium mg/L
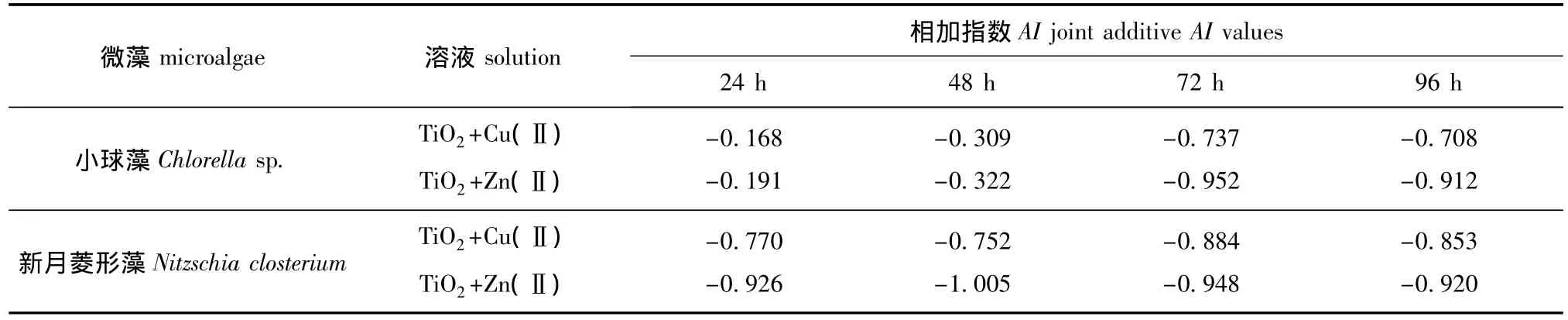
表2 TiO2+Cu(Ⅱ)、TiO2+Zn(Ⅱ)对小球藻和新月菱形藻的联合毒性相加指数AITab.2 Joint AI values of TiO2+Cu(Ⅱ)and TiO2+Zn(Ⅱ)to Chlorella sp.and Nitzschia closterium
表3为TiO2+Cu(Ⅱ)、TiO2+Zn(Ⅱ)对小球藻和新月菱形藻联合毒性的增大系数。根据相加指数与毒性增大系数的关系,96 h时,TiO2+Cu(Ⅱ)、TiO2+Zn(Ⅱ)混合物的毒性增大倍数均约为0.5。范传刚[24]研究发现,纳米TiO2与Cd对大肠杆菌的抗氧化酶、蛋白质和DNA均有毒性作用,而二者的联合作用低于二者毒性的相加作用,表现为拮抗作用。但是,田冰心等[25]研究则发现,纳米TiO2(1 mg/L)与菲、芘的联合作用表现出比单一污染物更大的毒性作用;Zhu等[26]研究表明,纳米TiO2和三丁基锡的相互作用会对鲍鱼胚胎表现出更大的毒性效应,两者表现为协同作用。由此可见,对于纳米TiO2的环境生态效应不应只关注其本身的毒性,而应关注纳米TiO2与环境污染物共同作用的结果,这更能反映纳米TiO2的环境暴露风险。

表3 TiO2+Cu(Ⅱ)、TiO2+Zn(Ⅱ)对小球藻和新月菱形藻联合毒性的增大系数Tab.3 Joint augmentation coefficient of TiO2+Cu(Ⅱ)and TiO2+Zn(Ⅱ)to Chlorella sp.and Nitzschia closterium
[1]Brumfiel G.Nanotechnology:a little knowledge[J].Nature,2003,424:246-248.
[2]熊道文,李政,方涛.纳米材料的水生态毒理学研究进展[J].环境污染与防治,2009,31(4):71-77.
[3]陆长梅,张超英,吴国荣,等.纳米级TiO2抑制微囊藻生长的实验研究[J].城市环境与城市生态,2002,15(4):13-18.
[4]尹海川,柳清菊,林强,等.纳米TiO2负载贵金属Pd抑制蓝藻的生长[J].西北植物学报,2005,25(9):1884-1887.
[5]Stumm W,Morgan J J.Chemical equilibrium and rates in natural waters[M]//Aquatic Chemistry.Hoboken,New Jersey:John Wiley& Sone Inc,1995.
[6]路艳君,姜爱莉,窦柏蕊,等.Cd(Ⅱ)和Zn(Ⅱ)对新月菱形藻生长及生化成分的影响[J].大连水产学院学报,2010,25(2):178-182.
[7]姜彬慧,林碧琴.重金属对藻类的毒性作用研究进展[J].辽宁大学学报,2000,27(3):281-286.
[8]李燕,朱琳,刘硕.铅、汞单一及联合胁迫对栅藻的生长、GSH含量及相关酶活性的影响[J].环境科学,2009,30(1):519-523.
[9]辛元元.纳米二氧化钛的水生生物毒理效应研究[D].绍兴:浙江工业大学,2012.
[10]李坤,李琳,候和胜,等.Cu(Ⅱ)、Cd(Ⅱ)、Zn(Ⅱ)对两种单胞藻的毒害作用[J].应用与环境生物学报,2002,8(4):395-398.
[11]雷衍之.养殖水环境化学[M].北京:中国农业出版社,2003.
[12]倪利晓,任高翔,陈世金,等.酚酸和不饱和脂肪酸对铜绿微囊藻的联合作用[J].环境科学,2011,30(8):1424-1431.
[13]张宁,金星龙,李晓,等.人工纳米材料对藻类的毒性效应研究进展[J].安徽农业科学,2011,39(10):6000-6003.
[14]朱小山,朱琳,田胜艳,等.三种重金属氧化物纳米颗粒的水生态毒性[J].生态学报,2008,28(8):3507-3516.
[15]Hund-Rinke K,Simon M.Ecotoxic effect of photocatalytic active nanoparticles TiO2on algae and daphnia[J].Environmental Science Pollutant Research,2006,13:225-232.
[16]Wang J,Zhang X,Chen Y,et al.Toxicity assessment of manufactured nanomaterials using the unicellular green alga Chlamydomonas reinhardtii[J].Chemosphere,2008,73(7):1121-1128.
[17]陈贞奋.四种重金属对牟氏角毛藻生长率和叶绿素含量的影响[J].海洋学报,1985,7(3):342-352.
[18]张道临,刘明星,李国基,等.4种重金属离子对海洋三角褐指藻生长影响的研究[J].海洋与湖沼,1995,26(6):582-585.
[19]Rai L L,Gaur J P,Kamar H D.Phycology and heavy metal pollution[J].Biological Reviews,1981,56:99-151.
[20]Kaegi R,Ulrich A,Sinnet B,et al.Synthetic TiO2nanoparticle emission from exterior facades into the aquatic environment[J].Environmental Pollution,2008,156:233-239.
[21]Fan W H,Cui M M,Liu H,et al.Nano-TiO2enhances the toxicity of copper in natural water to Daphnia magna[J].Environmental Pollution,2011,159(3):729-734.
[22]章军,杨军,朱心强.纳米材料的环境和生态毒理学研究进展[J].生态毒理学报,2006,1(4):350-356.
[23]Hartmann N B,Kammer F V,Hofmann T,et al.Algal testing of titanium dioxide nanoparticles-testing considerations,inhibitory effects and modifications of cadmium bioavailability[J].Toxicology,2010,269:190-197.
[24]范传刚.纳米TiO2和重金属铅对环境微生物E.coli联合毒性作用的评价研究[D].武汉:华中科技大学,2011.
[25]田冰心,吴荔生,王桂忠.nTiO2与菲、芘对日本虎斑猛水蚤联合毒性的研究[J].集美大学学报,2013,18(4):241-245.
[26]Zhu X S,Zhou J,Cai Z H.TiO2nanoparticles in the marine environment:impact on the toxicity of tributyltin to abalone(Haliotisdiversicolor supertexta)embryos[J].Environmental Science and Technology,2011,45:3753-3758.
