白头翁皂苷H3糖苷酶的分离纯化及酶性质
2015-02-17林迪,金凤燮,鱼红闪
林 迪, 金 凤 燮, 鱼 红 闪
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
白头翁皂苷H3糖苷酶的分离纯化及酶性质
林 迪,金 凤 燮,鱼 红 闪
( 大连工业大学 生物工程学院, 辽宁 大连116034 )
摘要:对Absidia sp.P39r所产白头翁皂苷H3糖苷酶进行了分离纯化,得到了电泳纯的酶蛋白,并对其性质做了进一步研究。结果表明,该酶分子质量约为40 ku;最适反应温度为40 ℃,最适反应pH为5.0;在pH 4.0~7.0,温度低于40 ℃条件下具有相对稳定的酶活力;金属离子Na+、K+、Mg2+对酶反应无显著影响,而Fe3+、Cu2+、Zn2+对其有较强的抑制作用;米氏常数为17.01 mmol/L,最大反应速度为0.38 mmol/(L·min)。
关键词:白头翁皂苷;糖苷酶;酶性质


0引言
白头翁皂苷是白头翁干燥根重要的活性成分,质量分数在8%~10%[1],大部分为多糖基皂苷,需要转化为低糖基皂苷才可被人体吸收[2]。这种转化通常是在人体肠道中由肠道菌群完成。如果能将这一转化在人体外完成,不仅能提高皂苷的生物活性,利用率也能得到显著提升[3]。
白头翁皂苷H3是具有6个糖基的多糖基皂苷[4]。目前,对白头翁皂苷的研究主要集中在白头翁皂苷的分离纯化及其药理作用等方面[5-6],对白头翁皂苷的糖苷酶研究较少。本实验室前期在白头翁皂苷的分离纯化以及生物转化方面做了一定工作,制备出了高纯度的白头翁皂苷H3;在皂苷糖苷酶方面,发现了对白头翁皂苷有明显水解作用的糖苷酶,但该酶对白头翁皂苷H3水解效果并不明显[7-8]。本实验室对具有白头翁皂苷H3水解能力的酶进行了重新筛选,从Absidiasp. P39r菌株中得到一种酶,该酶对白头翁皂苷H3有较强的水解能力,能将其水解为更利于人体吸收的低糖基皂苷,暂时将该酶命名为白头翁皂苷H3糖基水解酶。对白头翁皂苷H3糖苷酶分离纯化并研究其酶学性质。
1材料与方法
1.1材料
菌种:Absidiasp.P39r,大连工业大学生物工程学院保藏;白头翁皂苷H3,实验室制备;低分子质量标准蛋白,北京索莱宝科技有限公司。
HDL-组合式紫外检测仪,上海金达生化仪器有限公司;JM-250蛋白电泳仪,大连捷迈科贸有限公司。
1.2方法
1.2.1培养基
白头翁粉100 g,加水500 mL,水浴8 h(水浴过程中注意补水)。过滤、离心,得到的上清液补水至300 mL备用。将6°麦汁同制备好的白头翁浸出液按4∶1混匀,制成白头翁皂苷H3糖苷酶液体发酵培养基,备用。
1.2.2菌株的发酵及粗酶液的提取
将Absidiasp.P39r接种到灭菌过的发酵培养基中,然后将接好菌的培养基置于恒温振荡培养箱中培养6 d,培养条件为30 ℃,150 r/min。
酶的提取方法参照文献[9]。收集得到的蛋白沉淀,用20 mmol/L的pH 5.0的醋酸-醋酸钠缓冲液溶解,透析24 h。将透析液离心10 min,离心条件为4 ℃、8 000 r/min。得到的上清液即为粗酶液,4 ℃保存备用。
1.2.3酶的分离纯化
采用DEAE-Cellulose DE52阴离子交换柱(Φ2 cm×12 cm)对粗酶液进行分离纯化。将粗酶液加入到离子交换柱中,上样量为10 mL,待粗酶液完全吸附后,先用缓冲液洗脱,再分别用60,90,120,150,180 mmol/L的KCl溶液进行梯度洗脱;其中KCl溶液以20 mmol/L的pH 5.0的醋酸-醋酸钠缓冲液配制。洗脱液在280 nm紫外光下测定吸光度,检测后的洗脱液利用自动分部收集器收集。
1.2.4蛋白质含量的测定
用Folin-酚法测定溶液中蛋白质含量。
1.2.5酶蛋白分子质量的测定
采用SDS-PAGE法测定提纯酶的纯度及分子质量。标准蛋白为磷酸酶b(97.4 ku)、牛血清蛋白(66.2 ku)、肌动蛋白(43 ku)、碳酸酐酶(31 ku)、胰蛋白酶抑制剂(22 ku)、溶菌酶(14.4 ku)。
1.2.6酶活力的测定
用TLC法检测酶活力。将白头翁皂苷H3制成2 mg/mL标准品溶液作为酶反应的底物,溶剂为20 mmol/L的pH 5.0的醋酸-醋酸钠缓冲液。将白头翁皂苷H3溶液与酶液按照体积比1∶1 充分混合,40 ℃条件下反应24 h,加入2倍体积水饱和正丁醇终止反应,振荡,离心,取上层液体作为TLC检测的样品,展开剂氯仿-甲醇-水体积比为6.5∶4∶0.5,10%硫酸显色。通过Bandscan分析酶反应产物含量。酶活力定义为:在40 ℃条件下,每小时水解1 μmol白头翁皂苷H3所需的酶量为一个酶活力单位。
2结果与讨论
2.1粗酶的纯化及其分子质量的测定
按“1.2.3”的方法对粗酶液进行分离纯化,各纯化步骤结果如表1所示。

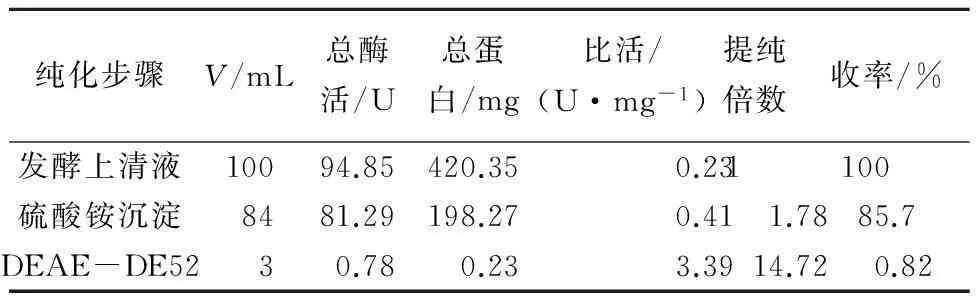
表1 白头翁皂苷H3糖苷酶纯化结果
对DEAE-DE52得到的酶液进行纯度及分子质量测定结果如图1所示。由图1可知,62号管为目标单带。测定62号管酶液的酶活力,发现其对白头翁皂苷H3具有较强的水解能力。由此可认定第62管为电泳纯的白头翁皂苷H3糖苷酶。根据图1得到回归方程:lgY=2.086 0-1.030 7X。计算出其分子质量约为40 ku。
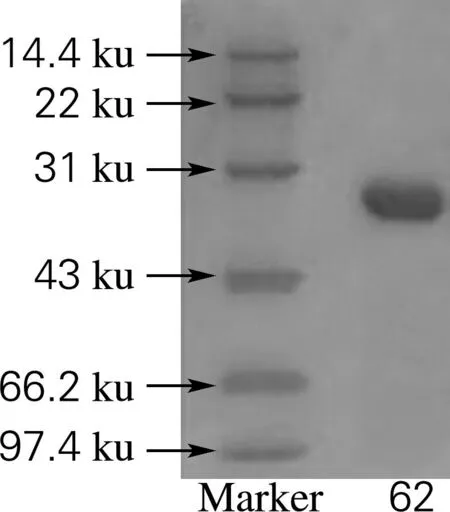
图1 纯化样品的SDS-PAGE图
2.2酶学性质
2.2.1pH对酶反应的影响
将提纯的酶置于pH 2.0~9.0缓冲体系中,于4 ℃下保存24 h,相对酶活力结果如图2所示。由图2可以看出,当pH为5.0时,白头翁皂苷H3糖苷酶的酶活力达到最大;pH在4.0~7.0时,相对酶活力较高,且酶活稳定。
2.2.2温度对酶反应的影响
由图3可以看出,随着温度的升高,该酶的相对酶活力随之升高,当温度达到40 ℃时,酶活力达到最高;当温度超过40 ℃,随着温度的升高,其相对酶活力反而随之下降。因此,该酶的最适反应温度为40 ℃,在40 ℃下酶活稳定。
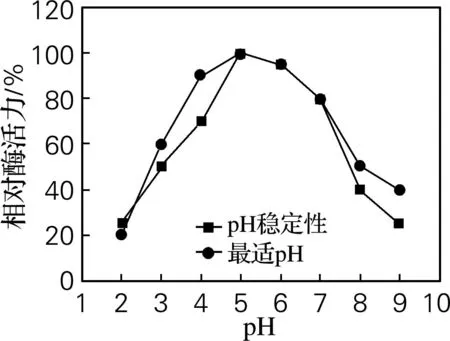
图2 最适pH及pH稳定性曲线
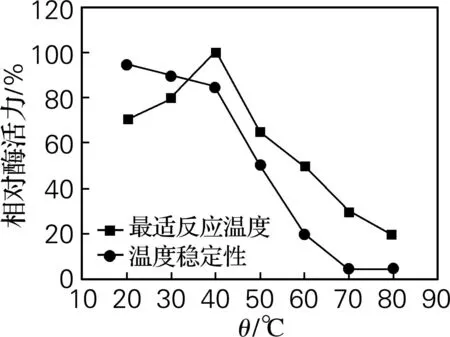
图3 最适温度及温度稳定性曲线
2.2.3金属离子对酶反应的影响
向反应体系中加入不同浓度的金属离子,以检测金属离子对白头翁皂苷H3糖苷酶酶活力的影响,结果见表2。其中K+、Mg2+、Na+对酶反应基本没有影响;而Fe3+、Cu2+、Zn2+随着离子浓度的增大,对酶反应的抑制作用明显增强。

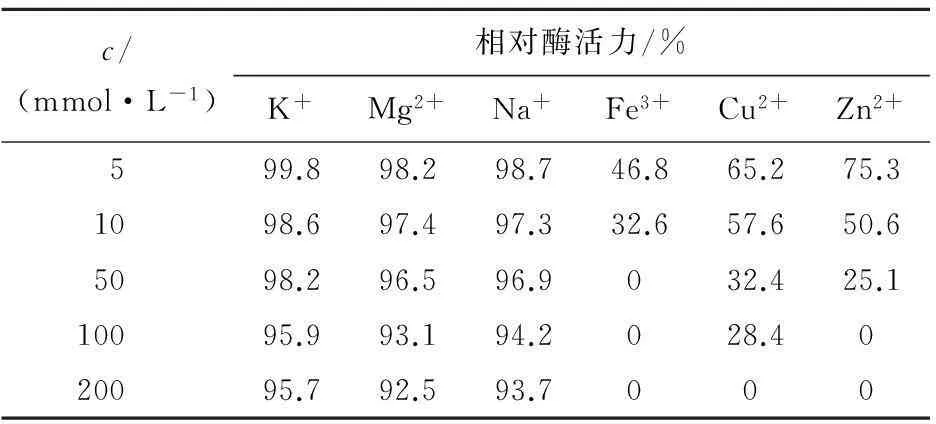
表2 金属离子对酶活力的影响
2.2.4反应动力学
配制浓度为8,10,12,16,25 mmol/L的白头翁皂苷溶液,与等体积的酶液混合,在pH 5.0条件,40 ℃下反应1 h,根据米氏方程:1/V=2.64+44.88/S,计算得到米氏常数Km=17.01 mmol/L,最大反应速度Vmax=0.38 mmol/(L·min)。
3结论
通过对Absidiasp.P39r菌株发酵得到的粗酶液的分离纯化,得到较纯的白头翁皂苷H3糖苷酶。确定了该酶的分子质量为40 ku。对纯酶做进一步的酶性质研究,得到该酶的最适反应pH为5.0,最适反应温度为40 ℃。该酶在pH 4.0~7.0,温度低于40 ℃条件下酶活力相对稳定。金属离子K+、Mg2+、Na+对酶反应无显著影响;而Fe3+、Cu2+、Zn2+对其有较强的抑制作用。根据反应动力学方程得到米氏常数Km=17.01 mmol/L,Vmax=0.38 mmol/(L·min)。
参考文献:
[1] 国家药典委员会. 中华人民共和国药典(一部):2005版[S]. 北京:化学工业出版社, 2005:68.
[2] 金凤燮. 天然产物生物转化[M]. 北京:化学工业出版社, 2009:123-124.
[3] 王征魁,曹体爽,刘廷强,等. 白头翁皂苷及其酶解产物的分离纯化[J]. 大连工业大学学报, 2013, 32(2):98-100.
(WANG Zhengkui, CAO Tishuang, LIU Tingqiang, et al. Purification of saponin from Pulsatilla chinensis and its enzymatic products[J]. Journal of Dalian Polytechnic University, 2013, 32(2):98-100.)
[4] KANG S S, KIM J S, KIM Y H, et al. A triterpenoid saponin from patrinia scabiosaefolia[J]. Journal of Natural Products, 1997, 60(10):1060-1062.
[5] 宋科标,时维静,周杰,等. 提取分离工艺对白头翁皂苷的影响[J]. 安徽科技学院学报, 2011, 25(5):42-46.
[6] 王伟,李红捷,鱼红闪,等. 白头翁皂苷及次生物的研究[J]. 安徽农业科技, 2007, 35(28):8779-8780.
[7] 王伟,唐正军,鱼红闪,等. 白头翁皂苷酶解产物的分离纯化[J]. 大连轻工业学院学报, 2005, 24(1):4-7.
(WANG Wei, TANG Zhengjun, YU Hongshan, et al. Separation and purification of Pulsatilla Saponin products by gradient elution and enzyme hydrolysis[J]. Journal of Dalian Institute of Light Industry, 2005, 24(1):4-7.)
[8] 杨宇,王东明,金凤燮,等. 白头翁皂苷糖苷酶的纯化及其酶学性质[J]. 大连工业大学学报, 2009, 28(6):404-407.
(YANG Yu, WANG Dongming, JIIN Fengxie, et al. Purification of pulchinenoside-glycosidase and its enzymatic characteristics[J]. Journal of Dalian Polytechnic University, 2009, 28(6):404-407.)
[9] 高大海,梅乐和,盛清,等. 硫酸铵沉淀和层析法分离纳豆激酶的研究[J]. 高校化学工程学报, 2006, 20(1):63-67.
Isolation and properties of pulchinenoside H3 glycosidase
LINDi,JINFengxie,YUHongshan
( School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China )
Abstract:Glycosidase capable of degrading pulchinenoside H3 from Absidia sp.P39r was purified and characterized. The results showed that its molecular weight was 40 ku, and the maximal activity was obtained at pH 5 and 40 ℃ and stable at pH 4.0-7.0 and 40 ℃. Ions of Fe3+, Cu2+, Zn2+inhibit glycosidase but Na+, K+, Mg2+had no effect on the activity. The maximum reaction rate was 0.38 mmol/(L·min) and Kspanwas 17.01 mmol/L.
Key words:pulchinenoside; glycosidase; enzymatic characteristics
文章编号:1674-1404(2015)06-0404-04
通信作者:
作者简介:林 迪(1991-),男,硕士研究生;鱼红闪(1968-),男,教授.
基金项目:“重大新药创制”科技重大专项(2012ZX09503001-003).
收稿日期:2014-12-16.
中图分类号:TS201.2;Q556.2
文献标志码:A
