沙生针茅种子破除休眠的方法
2015-02-15刘克彪李发明张元恺甘肃省治沙研究所甘肃兰州730070甘肃民勤荒漠草地生态系统国家野外科学观测研究站甘肃兰州730070甘肃沙生植物工程技术研究中心甘肃兰州733070甘肃省荒漠化与风沙危害防治重点实验室培育基地甘肃武威733000
刘克彪,李发明,张元恺(1.甘肃省治沙研究所,甘肃 兰州 730070; 2.甘肃民勤荒漠草地生态系统国家野外科学观测研究站,甘肃 兰州 730070;3.甘肃沙生植物工程技术研究中心,甘肃 兰州 733070; 4.甘肃省荒漠化与风沙危害防治重点实验室(培育基地),甘肃 武威 733000)
沙生针茅种子破除休眠的方法
刘克彪1,2,3,李发明1,2,4,张元恺1,2,4
(1.甘肃省治沙研究所,甘肃 兰州 730070; 2.甘肃民勤荒漠草地生态系统国家野外科学观测研究站,甘肃 兰州 730070;3.甘肃沙生植物工程技术研究中心,甘肃 兰州 733070; 4.甘肃省荒漠化与风沙危害防治重点实验室(培育基地),甘肃 武威 733000)
为破除沙生针茅(Stipaglareosa)种子休眠,采用不同种子处理方法,测定各种处理对种子萌发的影响,明确解除种子休眠的有效途径。结果显示,1)解除种皮休眠:60 ℃蒸馏水浸泡种子24 h,种子吸水率、发芽率、发芽势分别达到26.32%、38%和32%;机械划破种皮,种子发芽率达到34%。2)解除胚生理休眠:-20、-20 ℃变温处理96 h,发芽率、发芽势分别达到48%和46%;切除种子3/4胚乳,发芽率、发芽势分别达到58%和54%;用80 mg·L-1赤霉素(GA3)水溶液浸泡种子24 h,发芽率、发芽势分别达到54%和48%。3)解除种子综合休眠:采用变温+浸泡+GA3方法,发芽率、发芽势分别达到78%和76%。种子存在的萌发抑制物对种子发芽的影响大于种皮不透性对种子发芽的影响。种子发芽高峰期集中于前2~5 d,切除胚乳和GA3水溶液浸泡种子,发芽高峰期集中于前2~8 d。
沙生针茅;休眠机制;休眠解除;发芽率;发芽势
沙生针茅(Stipaglareosa)为禾本科针茅属多年生密丛型旱生草本,分布于我国内蒙古西部、宁夏、甘肃、青海西部、新疆、西藏西北部等地,前苏联 (西伯利亚南部,中亚)、阿富汗、蒙古也有分布。生于荒漠地带砂砾质棕钙土和干燥砾质山坡、浅覆沙丘间低地及沟谷等。常构成白沙蒿(Artemisiasphaerocephala)—沙生针茅旱生植物群落(民勤、金昌、古浪),或为温性荒漠草原草地主要建群种[1](西藏阿里),也是白刺(Nitrariatangutorum)—绵刺(Potaniniamongolica)、矮锦鸡儿(Caraganapygmaea)荒漠旱生植物群落的伴生种(阿拉善盟)。沙生针茅具有发达密集的根系,须根具保水功能的沙套适应干旱的荒漠环境。耐寒、耐旱、耐高温,喜适度沙埋,形成不同程度的灌丛化,不耐风蚀和重度沙埋。在民勤,2次开花结实,第1次5月中旬至下旬开花,6月上旬种子成熟,第2次9月下旬开花,10月上旬种子成熟。成熟颖果具密被白色绒毛的长芒,芒针常弧形弯曲,随风传播。正常单株第1次结实200~1 400粒,第2次结实160~1 100粒,特别干旱的年份,植株保持3~8片叶片正常营养生长,1~3穗结实,得以延续种群。野外调查发现,沙生针茅呈片状或带状分布,天然更新困难。沙生针茅牧草产量虽低,但营养丰富,含有较高的粗蛋白质和粗脂肪,是荒漠草原地带优质上等牧草之一。沙生针茅种子萌发机理的研究较少,在国外,德国学者Ronnenberg等[2]对分布在中亚蒙古一带的沙生针茅种子萌发进行过研究,在国内,李发明等[3]研究了光照和沙埋对沙生针茅种子萌发和幼苗出土的影响。因此,对解除沙生针茅种子休眠的方法进行研究,对发展培育优质牧场、恢复和保护沙生针茅植物群落、丰富干旱区旱生草坪植物种具有一定的意义。
1 材料和方法
1.1 参试材料
1.1.1 种子来源 沙生针茅参试种子于2013年6月和10月、2014年6月上旬采自甘肃民勤南湖,精选后,测得其发芽率为8%,千粒重为3.35 g。含水量6.08%。盛于纸质种子袋中,在暗室常温下储藏。
1.1.2 试验仪器 解剖镜、RQX-400人工气候箱、冰柜、冰箱、三申YM系列N型立式压力蒸汽灭菌器、FA2004N电子天平、Eppendorf移液枪、发芽皿、滴管、量筒、滤纸等。
1.1.3 试验药品 溶质为浓H2SO4、NaOH、、赤霉素(GA3)、KMnO4。溶剂为蒸馏水和酒精(C2H6O)。
1.2 试验方法
1.2.1 试验时间 2013年11月10-30日、2014年3月5-21日进行预试验,2014年3月27日-4月20日进行系统试验。2014年6月进行补充试验。
1.2.2 试验地点 甘肃省荒漠化与风沙灾害防治国家重点实验室(武威),甘肃民勤治沙综合试验站。
1.2.3 种子处理
种子消毒:参试种子水选后,用5‰ KMnO4溶液消毒10min,蒸馏水清洗后用于各种处理。
热水浸泡处理:分别用30、40、50、60、70 ℃的蒸馏水浸泡种子24 h,自然冷却。
低温处理:将种子置于-5、-10、-15、-20、-25 ℃环境中96 h。
变温处理:将种子置于-5、-10、-15、-20、-25 ℃环境中12 h,放入培养箱20 ℃环境中12 h后,再放入上述温度环境内,循环96 h。
GA3浸泡处理:用酒精溶解GA3,配置成20、40、60、80、100 mg·L-1浓度GA3水溶液200 mL,分别用不同浓度的GA3水溶液浸泡种子24 h。
切除胚乳:在解剖镜下分别切除种子胚乳1/4、1/2、3/4。
胚休眠试验:将储存1年和2年的种子,用60 ℃水浸泡24 h,自然冷却。
综合处理:将种子置于-20 ℃环境中12 h,取出置于培养箱20 ℃环境中12 h后,再放入-20 ℃内,循环96 h,取出,用60 ℃水浸泡24 h,自然冷却后,再置于80 mg·L-1GA3水溶液浸泡种子24 h。
以未经任何处理的种子作为对照(CK)。
1.3 发芽试验
1.3.1 吸水率测定 分别将50粒种子置于盛有100 mL 30、40、50、60、70 ℃蒸馏水的烧杯中,将烧杯放入20 ℃培养箱中,每隔6 h取出用吸水纸吸干,迅速称重,测定24 h内的种子吸水率。每个处理重复3次。
吸水率(S)=(浸种后质量-浸种前质量)/浸种前质量×100% 。
1.3.2 发芽率和发芽势的测定 在每个经过消毒的发芽皿内滤纸上置入各种处理后(蒸馏水浸泡、GA3浸泡、综合处理的种子,用滤纸吸干表面水分)的种子50粒,加入蒸馏水6 mL,共27个处理,每个处理重复3次,共计81个。将试验处理后的发芽皿放入人工气候箱,设定温度为25 ℃,相对湿度60%,光照为全暗[4-5]。每天观测时用移液枪加蒸馏水0.6 mL,保持滤纸湿润,不积水,保证芽床内相对湿度为80~90%。发芽率F=n/N×100%(n为正常发芽粒数,N为供试种子数)。发芽势FS=n1/N×100%(n1为种子发芽达到高峰期发芽种子数)。
1.3.3 种子形态观察 选取休眠种子在显微镜下观察种子结构。
1.4 观测指标
每天15:00开始观测记录沙生针茅种子发芽情况,统计发芽数。发芽始期:胚根伸出种皮2 mm时的天数;发芽高峰期:发芽粒数>2粒的天数[6];发芽结束期:连续3天不再有种子发芽的天数(10 d)。
1.5 数据处理
数据均用Excel方差分析并制图。
2 结果与分析
2.1 解除种皮休眠
2.1.1 形态结构 成熟沙生针茅种子表面密被绒毛,去稃的种子种皮硬而致密,种皮表面具有蜡质,硅非常丰富,分布不均一,对胚乳及胚保护严密(图1),一方面保护种子在炎热的夏季和不利于种子发芽的环境中不至于失水过多损失发芽力,而另一方面导致种皮的透性差,形成种皮休眠[7]。
2.1.2 吸水率 用不同温度的蒸馏水浸泡沙生针茅种子,在6 h时70 ℃蒸馏水浸泡种子吸水率是30 ℃浸泡种子的4.88倍(图2),浸泡24 h时,前者是后者的2.9倍,最大吸水率在浸泡种子24 h时,为27.74%,其次为用60 ℃蒸馏水浸泡种子24 h,最大吸水率26.32%。60~70 ℃蒸馏水浸泡种子,吸水率明显大于30~50 ℃浸泡种子。种子吸水主要是在浸泡后的6 h,18 h后吸水率相对稳定。不同温度蒸馏水浸泡种子,随着浸泡蒸馏水初始温度的升高,吸水率明显增大,不同温度蒸馏水浸泡种子的吸水率存在极显著差异(P<0.01)(表1)。
2.1.3 蒸馏水浸泡对种子萌发的影响 预试验表明,用浓H2SO4处理不同时间和不同浓度NaOH水溶液腐蚀种皮,不能有效地解除种皮休眠,对种子发芽几乎没有影响;机械划破种皮能提高种子发芽率至34%;用不同温度蒸馏水浸泡种子,种子发芽高峰期在试验的2~5 d(图3),60 ℃蒸馏水浸泡种子,发芽率、发芽势达到峰值(图4),分别为38%和32%,在试验的2、3、4 d,发芽率分别是CK的4.5、5.5、3.5倍,发芽第10天,发芽率是CK的4.8倍,发芽势是CK的4倍,其次是70 ℃蒸馏水浸泡种子,发芽第10天,发芽率是CK的4.5倍,发芽势是CK的3.3倍。用蒸馏水浸泡种子,随着水温的升高,发芽率、发芽势逐步升高,水温达到60 ℃时,发芽率、发芽势达到最大值,发芽整齐,时间集中,温度超过60 ℃浸泡种子,发芽受到抑制,发芽率降低,方差分析表明,不同温度蒸馏水浸泡种子,种子发芽率存在极显著差异(P<0.01)(表2)。

图1 种子结构形态Fig.1 Morphology ofStipaglareosaseeds
注:A,带稃的种子表面密被绒毛;B,去稃的种子种皮硬而致密;C,去稃种子种皮表面具有蜡质,硅非常丰富。
Note: A, the seed surface densely villi with lemma. B, the seed coat peeling hard and dense peeling the lemma. C, the seed coat surface is covered with wax, silicon is very rich peeling the lemma.
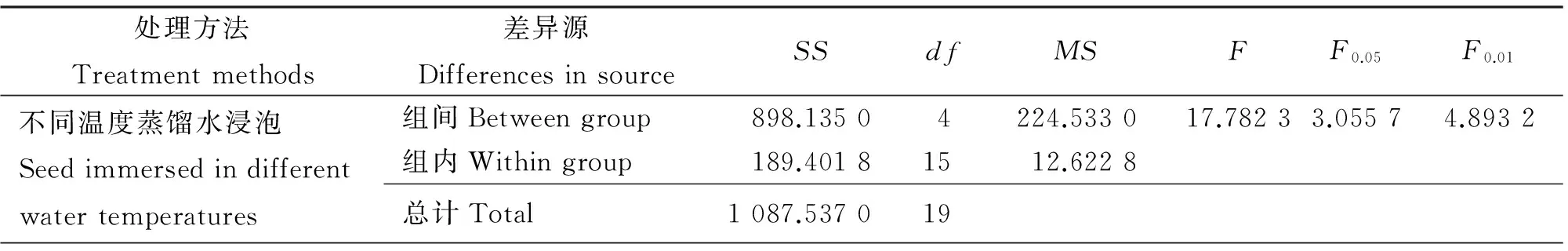
表1 不同温度蒸馏水浸泡种子吸水率方差分析Table 1 Analysis of variance of effect of water temperature on seeds water uptake

图2 不同温度蒸馏水浸泡种子吸水曲线Fig.2 Absorption curve of water temperature on seeds water uptake

图3 不同温度蒸馏水浸泡种子发芽率Fig.3 The germination percentage of soaked seeds in different water temperatures

图4 不同温度蒸馏水浸泡种子发芽势Fig.4 Germination potential of seed soaked in different water temperatures
注:不同字母表示不同温度处理之间差异显著(P<0.05)。下同。
Note: Different lower case letters indicate significant difference among different water temperatures at 0.05 level. The same below.
2.2 解除胚生理休眠
2.2.1 低温处理对种子萌发的影响 用储藏1年和2年的沙生针茅种子进行发芽试验,发芽率和发芽势没有明显的差异,说明种子没有形态后熟,即胚形态休眠。不同低温处理种子,种子发芽的高峰期在试验的2~5 d ,-20 ℃冷冻处理种子,发芽率和发芽势最高(图5,图6),达到34%和28%,分别是CK的4.25倍和3.5倍。低温冷冻处理沙生针茅种子,随着温度的降低,种子发芽率、发芽势逐步升高,温度至-20 ℃,发芽率、发芽势达到最大值,继续降低,种子发芽率、发芽势率也随之降低。方差分析表明不同低温冷冻处理种子,发芽率差异不显著(P<0.01)(表2)。
2.2.2 变温处理对种子萌发的影响 变温处理后,种子发芽的高峰期在试验的2~5 d,低温变温温度越高,发芽高峰期向后推迟(图7),发芽第10天,-20 ℃低温变温处理种子较其他处理发芽率和发芽势最高(图8),达到48%和46%,发芽率是CK的6倍,发芽势是CK的3.5倍。随着低温的降低,种子发芽势明显升高,在-20 ℃时,达到最大值,温度继续降低,种子发芽势随之降低。方差分析表明不同变温处理种子,种子发芽率存在极显著差异(P<0.01)(表2)。
2.2.3 切除胚乳对种子萌发的影响 在显微镜下,不同程度切除沙生针茅种子胚乳,发芽高峰期在试验的2~8 d,切除绝大部分胚乳(3/4),种子发芽率、发芽势分别可达到58%和54%(图9,图10),发芽率是CK的7.25倍,发芽势是CK的6.75倍。胚乳切除越多,发芽率和发芽势越高,方差分析表明不同程度切除种子胚乳,种子发芽率存在极显著差异(P<0.01)(表2)。

图5 不同低温处理种子发芽率Fig.5 Germination percentage of seed at different low temperature

图6 不同低温处理种子发芽势Fig.6 Germination potential of seed at different low temperature

图7 不同变温处理种子发芽率Fig.7 Germination percentage of seed by temperature fluctuation treatments
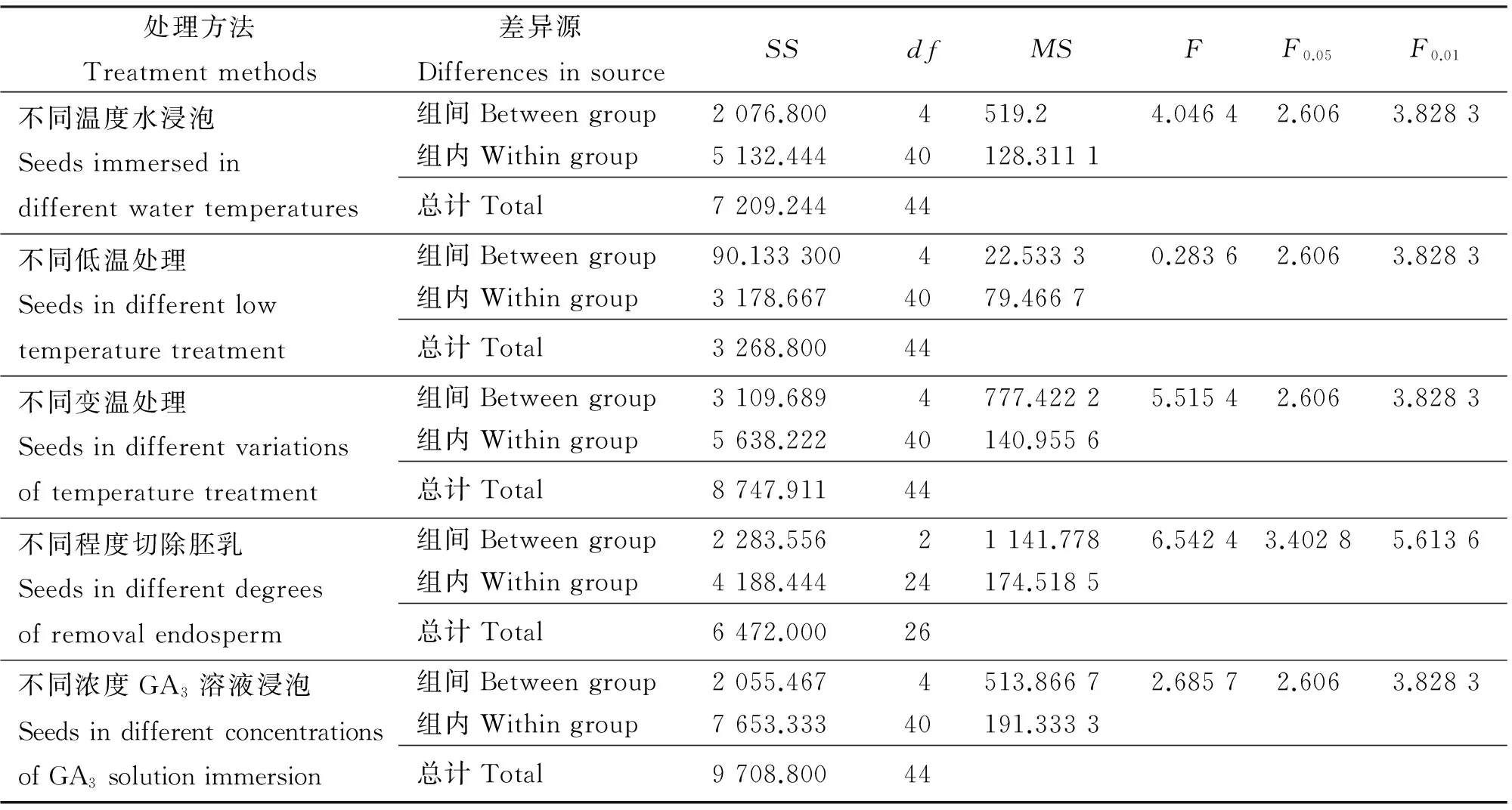
表2 不同处理方法种子发芽率方差分析Table 2 Analysis of variance of effect of different treatments on seeds

图8 不同变温处理种子发芽势Fig.8 Germination potential of seed by temperature fluctuation treatments

图9 不同程度胚乳切除种子发芽率Fig.9 Germination percentage of seed by removal endosperm treatments

图10 不同程度切除胚乳种子发芽势Fig.10 Germination potential of seed by removal endosperm treatments
2.2.4 激素处理对种子萌发的影响 用不同浓度GA3水溶液处理种子,种子发芽高峰期集中于2~8 d(图11)。用GA380 mg·L-1浸泡种子,发芽率和发芽势达到最高值(图12),分别为54%和48%,在发芽的第10天,发芽率是CK的6.75倍,发芽势是CK的6倍。GA3浓度超过80 mg·L-1,发芽率和发芽势开始降低。不同GA3浓度溶液处理种子,种子发芽率存在显著差异(P<0.05)(表2),GA3对种子发芽率的影响表现为低浓度促进,高浓度抑制的趋势,和于晓丹等的研究一致[8]。

图11 不同GA3溶液处理种子发芽率Fig.11 Germination percentage of seed by different GA3concentration treatments

图12 不同GA3浓度处理种子发芽势Fig.12 Germination potential of seed by different GA3concentration treatments
2.3 解除种子休眠综合处理
通过方差分析(表2),将最有效的解除种皮休眠方法组合,形成综合处理方法。种子发芽高峰期集中于试验的2~8 d(图13),试验第10天,种子发芽率78%,发芽势76%(图14),是单纯采取变温处理种子最高发芽率(48%)和发芽势(47%)的1.63倍和1.65倍,温水浸泡种子最高发芽率(38%)和发芽势(32%)的2.05倍和2.38倍,80 mg·L-1GA3水溶液浸泡种子最高发芽率(54%)和发芽势(48%)的1.44倍和1.58倍,发芽率和发芽势分别是CK的9.75倍和9.5倍。

图13 综合处理种子发芽率Fig.13 Germination percentage of seed by comprehensive treatment

图14 综合处理种子和对照发芽势Fig.14 Germination potential of seed by comprehensive treatment
采用低温变温(解除种皮休眠、促进种子萌发抑制物的转化)、60 ℃温水浸泡(解除种皮休眠)、80 mg·L-1GA3水溶液浸泡(促进种子萌发抑制物的转化),能有效的解除种子综合休眠。
3 讨论和结论
3.1 解除种皮休眠
有学者认为,如果种子的含水量超过14%,种皮是透水的,含水量低于3%,种皮是不透水的[9]。沙生针茅种子自然含水率6.08%,介于二者之间,有极少量的种子具透水性。种子被坚硬的颖壳包裹,种皮在成熟过程中逐渐加厚变硬和致密,种皮具蜡质层和分布不均硅的沉积,对胚乳及胚保护严密,导致种皮透性很差,阻止了水分和空气从颖果果皮和种皮孔进入,CO2和其他一些化学抑制性物质不能迅速排出,从而抑制种子的萌发[10];种子表面密被绒毛,即可起到降低种子在干燥的荒漠环境中水分散失过快,又可在种子发芽时保持周围土壤较长时间的湿润,有利于种子的保存和萌发。采用物理方法和化学药剂处理种子,改变种壳的物理性状,增强种皮透性,从而解除种皮休眠[10]。解除种皮休眠的方法很多,本研究表明,热水浸泡可以软化种皮,去掉种皮表层的蜡质,增强种皮透性,从而促进萌发。用60 ℃浸泡种子24 h,吸水率、发芽率、发芽势分别达到26.32%、38%和32%。机械划破种皮能使种子发芽率提高至34%,发芽高峰期集中于前2~5 d,这与孙树坤等[11]的研究结果一致。说明较高温度的水浸泡种子和机械划破种皮,能有效地解除种皮休眠,促进种子的萌发。
3.2 解除胚生理休眠
沙生针茅种子胚乳含有萌发抑制物,萌发抑制物具体作用机制目前还不是十分清楚[12-13]。抑制物造成种子胚具生理休眠[14]。适当的低温冷冻处理能够克服种皮的不透性,增进种子内部的新陈代谢,从而促进种子的萌发[15]。通过机械的方法切除胚乳、模拟沙生针茅种子自然状态下越冬环境,用不同低温变温处理种子解除因种子萌发抑制物存在而引起的休眠[16-17]。陶俊和陈去志[18]认为脱落酸和赤霉素平衡对种子的休眠和萌发起主导作用,处于休眠状态的种子脱落酸水平较高,而萌发状态种子中的赤霉素含量较高,激素处理的目的就是通过使用外源激素达到调节内源激素的目的,从而解除种子休眠状态。本研究表明,用-20 ℃低温、在-20和20 ℃变温环境中处理种子96 h,种子发芽率、发芽势分别达到用34%、28%和48%、46%,发芽高峰期集中于前2~5 d;通过切除种子胚乳的绝大部分(3/4),可将种子发芽率、发芽势提高到58%和54%,说明萌发抑制物主要存在于胚乳中;用80% mg·L-1GA3水溶液浸泡种子24 h, 发芽率、发芽势分别为54%和48%,发芽高峰期集中于2~8 d,说明沙生针茅种子内部萌发抑制物可与GA3相拮抗[19]。用赤霉素和低温变温处理种子,能有效降低抑制物的含量,改变激素水平,增强酶的活性,缩短和解除由于脱落酸等萌发抑制物导致的种子休眠[20]。切除大部分种子胚乳和用80 mg·L-1赤霉素水溶液浸泡种子是解除萌发抑制物导致胚休眠的有效方法。
3.3 解除综合休眠
导致休眠的因子可分为外源休眠(种壳休眠)、内源休眠(胚休眠)以及二者的各种组合(综合休眠),胚休眠可又分为形态休眠和生理休眠。沙生针茅种子休眠属于种皮休眠和胚生理休眠形成的综合休眠类型,胚乳存在的萌发抑制物,对种子萌发的影响大于种皮不透性对种子萌发的影响,必须采用解除种子综合休眠的技术措施[21],解除种子综合休眠,首先要除去种皮的透性障碍,然后施用外源激素使种子内部的激素达到平衡[22-23],从而到达彻底解除种子休眠的目的,采取种子综合处理方法,可将沙生针茅种子发芽率、发芽势分别提高到78%和76%。
3.4 沙生针茅种子自然萌发机制
野外调查发现,沙生针茅群落靠有性繁殖天然更新。夏秋季结实的种子,种皮不透性和胚乳存在萌发抑制物,有利于种子在高温干燥的荒漠环境中不至于丧失水分过多而失去萌发力,安全渡过不适合萌发的夏秋季,随着冬季降雪和春季降雨,土壤的冻溶交替,种子被大自然低温、变温处理,部分解除了种皮和胚乳中萌发抑制物对种子萌发的影响,利用春季土壤返潮的有利时机,促进少部分种子2~5 d内萌发成苗,这种萌发机制,是种子在长期的进化历程中演化出了与严酷生境相适应的萌发对策[24],对延续和保护物种具有积极的作用[25]。种子的综合休眠、生境地表状况、温度、降水量、蒸发量等因素不协调[26-29],是造成沙生针茅种群面积、数量不能迅速扩大、天然更新十分脆弱的主要原因,这和野外调查未发现夏秋季有沙生针茅幼苗出土生长相一致。
[1] 张锦华,周忠浩,尼玛洛卓,张新全,梁川.临时公路干扰对高寒荒漠草原草地群落的影响[J].山地学报,2003,21:13-16.
[2] Ronnenberg K,Wesche K,Pietsch M,Hensen I.seed germination of five mountain teppe species of central Asia[J].Jourmal of Arid Environ,2007,71(4):12-16.
[3] 李发明,刘淑娟,张莹花,朱淑娟,刘克彪,王理德.光照和沙埋对沙生针茅种子萌发和幼苗出土的影响[J].中国农学通报,2013,29(31):47-52.
[4] 刘丽莉,冯涛,严明理,向言词.几种解除美洲商陆种子休眠的方法[J].植物生理学通讯,2007,43(4):795-796.
[5] 张勇,薛林贵,高天鹏,晋玲,安黎哲.荒漠植物种子萌发研究进展[J].中国沙漠,2005,25(1):106-112.
[6] 张慧勤,卢春霞,王慈民.油松发芽高峰期的预测[J].河南林业科技,1996,54(4):30-36.
[7] 杨期和,叶万辉,宋孙泉,殷寿华.植物种子休眠的原因及休眠的多形性[J].西北植物学报,2003,23(5):837-843.
[8] 于晓丹,毛培胜.激素对草本植物种子休眠.萌发的影响[J].草业科学,2014,31(1):150-160.
[9] 黄振英.鄂尔多斯高原固沙禾草沙鞭种子休眠和萌发与环境的关系[J].西北植物学报,2003,23(7):1128-1133.
[10] 陈伟,马绍宾,陈宏伟.种子休眠类型及其解除方法概述[J].安徽农业科学,2009,37(33):16237-16239.
[11] 孙树坤,施展,胡晓玲.紫云英种子机械处理对发芽率的效应[J].种子科技,2001,19(1):36-37.
[12] 鱼小军,王芳,龙瑞军.解除种子休眠方法研究进展[J].种子,2005,24(7):46-49.
[13] 王继朋,王贺,张福锁,毛达如.解除结缕草种子休眠的方法研究[J].草业科学,2004,21(2):25-29.
[14] 孙啐,刘鹏,徐根娣.栝楼种子休眠特性分析[J].中国农业科学,2008,41(12):4273-7280.
[15] 鱼小军,王彦荣,张健全,孙建华,董强.无芒隐子草和条叶车前种子解除休眠方法研究[J].草业学报,2004,13(6):883-887.
[16] 房丽宁,李青丰,李淑君,徐军.解除苔草种子休眠方法的研究[J].草业科学,1998,15(5):39-48.
[17] 唐安军,龙春林,刀志灵.种子休眠机理研究概述[J].云南植物研究,2004,26(3):241-251.
[18] 陶俊,陈去志.桃种子休眠与萌发研究一种皮的调控作用[J].果树科学,1996,13(4):233-236.
[19] 郑光华.种子生理研究[M].北京:科学出版社,2004:706.
[20] 傅强,杨期和,叶万辉.种子休眠的解除方法[J].广西农业生物科学,2003,22(3):230-234.
[21] 钱永强,孙振元,李云,韩蕾.中华结缕草种子解除休眠方法研究[J].林业科学研究,2004,17(1):54-59.
[22] 朱宇旌,刘艳.牧草种子休眠解除方法综述[J].草业科学,2003,20(3):24-27.
[23] 萱倩倩,范亚丽,牛亚洁,袁金凤,汪晓峰,刘忠华.毛乌素沙地4种沙生植物种子的形态解剖研究[J].种子,2013,32(7):68-71.
[24] 黄振英,吴鸿,胡正海.30种新疆沙生植物的结构及其对沙漠环境的适应[J].植物生态学报,1997,21(6):521-530.
[25] 何学青,胡小文,王彦荣.羊草种子休眠机制及解除方法研究[J].西北植物学报,2010,30(1):120-125.
[26] 黄振英,Gutterman Y,胡正海,张新时.白沙蒿种子萌发特性的研究II.环境因素的影响[J].植物生态学报,2001,25(2):240-246.
[27] 韩建国.实用牧草种子学[M].北京:中国农业大学出版社,1997.
[28] 余玲.虎尾草种子萌发特性的研究[J].草业科学,1999,16(3):51-54.
[29] 李望.种子休眠的机理及其解除方法[J].中国农学通报,1997,13(3):49-50.
(责任编辑 张瑾)
The methods to breaking seed dormancy ofStipaglareosa
LIU Ke-biao1,2,3, LI Fa-ming1,2,4, ZHANG Yuan-kai1,2,4
(1.Gansu Desert Control Research Institute, Lanzhou 730070, China; 2.Gansu Minqin National Studies Station for Desert Steppe Ecosystem, Lanzhou 730070, China; 3.Gansu Psammophyte Engineering Technology Research Center, Lanzhou 730070, China;4.State Key Laboratory of Desertification and Aeolian Sand Disaster Combating, Wuwei 733000, China)
In order to effectively break theStipaglareosaseed dormancy, different seed treatment methods were employed and their effects on seed germination were measured. The results showed that the seed water absorption percentage, germination percentage, and germination potential were 26.32%, 38%, and 32%, respectively, if soaking seed in 60 ℃ distilled water for 24 h to break the seed coat dormancy. Seed germination percentage was 34% if mechanical pierced the seed coat. Germination percentage and germination potential were 48% and 46%, respectively, if seed kept in -20 and -20 ℃ cryogenic alterating temperature for 96 h to break the embryo physiological dormancy. Seed germination percentage and germination potential were 58% and 54%, respectively, if removing three-quarters of endosperm. And seed germination percentage and germination potential were 54% and 48%, respectively, if soaking seed in 80 mg·L-1GA3solution for 24 h. The germination percentage and germination potential were 78% and 76%, respectively, if combined the above treatments with alternating temperature + soaking + GA3. The effects of germination inhibitors in seeds on germination percentage ofS.glareosawere greater than that of impermeable coat of seed. The germination peaked time was in first 2~5 d, as well as in first 2~8 d by removal of the endosperm and GA3solution soaking seeds.
Stipaglareosa; dormancy mechanism; dormancy breaking; germination percentage; germination potential
LIU Ke-biao E-mail:1548473585@qq.com
10.11829j.issn.1001-0629.2014-0435
2014-09-26 接受日期:2015-02-09
国家地区基金项目“荒漠区沙生针茅种子萌发机理研究”(31160264)
刘克彪(1964-),男,甘肃张掖人,高级工程师,本科,主要从事沙旱生植物栽培。E-mail:1548473585@qq.com
Q945.35
A
1001-0629(2015)07-1099-08*
刘克彪,李发明,张元恺.沙生针茅种子破除休眠的方法[J].草业科学,2015,32(7):1099-1106.
LIU Ke-biao,LI Fa-ming,ZHANG Yuan-kai.The methods to breaking seed dormancy ofStipaglareosa[J].Pratacultural Science,2015,32(7):1099-1106.
