诱导物及种间诱导对白腐菌的锰过氧化物酶(MnP)的诱导
2015-02-15钟紫旋
钟紫旋,刘 丽,张 勇,罗 锋
(西南大学 资源环境学院 能源生物资源开发重庆市重点实验室,重庆 400716)
诱导物及种间诱导对白腐菌的锰过氧化物酶(MnP)的诱导
钟紫旋,刘 丽,张 勇,罗 锋*
(西南大学 资源环境学院 能源生物资源开发重庆市重点实验室,重庆 400716)
本实验通过添加外源诱导物诱导和不同白腐菌种间相互诱导两种途径来研究Trametesversicolor、Pleurotusostreatus、Dichomitussqualens、Bjerkanderaadusta四种白腐菌产MnP活性,发现这些白腐菌在一些诱导条件下可产生大量MnP。结果表明,外源诱导物中,2,5-二甲基苯胺是有效的MnP诱导剂,对四种菌产MnP均有不同程度的诱导作用。异丙醇能提高T.versicolor、P.ostreatus和D.squalens产MnP活性,且诱导效果优于乙醇。Cu2+能显著提高T.versicolor和D.squalens产MnP活性。 Mn2+能显著提高P.ostreatus和B.adusta产MnP活性。不同白腐菌相互作用时,T.versicolor、P.ostreatus和D.squalens三种菌两两共培养均有明显的MnP种间诱导效果。本研究为大量产MnP并将其应用于工业提供可能。
白腐菌,锰过氧化物酶,外源诱导物,种间诱导
白腐菌是已知的唯一具有彻底降解木质素能力的真菌[1],这类真菌所分泌的非特异性氧化还原酶中,锰过氧化物酶(Manganese Peroxidase,MnP)对木质素降解起着至关重要的作用。此外,MnP对许多结构不同的高毒性、大分子、难降解的芳香族化合物具有广泛的降解能力,包括氯苯、联苯、苯胺、氯酚、以及硝基芳烃化合物等[2],能使这些底物经过多步反应逐步降解为二氧化碳和其它小分子产物。由于MnP对植物残体的高效生物转化作用,它们在纸浆和造纸、食品、纺织、染料等工业,生物修复等各种生物技术应用领域有着广阔前景[2-4]。但MnP的有限来源是制约其大量产业化应用的关键难点,因此如何获取大量MnP成为我们面临的直接而现实的问题。
诱导物对MnP合成及表达具有重要作用,添加合适的外源诱导物是增加MnP产量最有效的方法之一。诱导物不仅能诱导MnP产量增加,还起到分散剂和保护剂的作用[3,5]。虽然单一培养的一些白腐菌MnP降解木质素机理已被较大程度的揭示[6],但对不同白腐菌共培养的生化和酶学性质研究较少。目前国内外有关白腐菌产MnP的研究仍主要集中于工业应用[4,7-9],而缺乏对白腐菌产MnP的外源化合物诱导和近缘种间诱导研究,MnP诱导表达调控机制尚不清楚[10]。另外,诱导物对MnP产量及活性的影响也因菌种而异,不同的菌种在不同的环境条件下其产酶所需的最适诱导物及其浓度差异较大。因此本实验采用外源诱导物诱导和真菌种间相互诱导两种途径来对Trametesversicolor、Pleurotusostreatus、Dichomitussqualens和Bjerkanderaadusta四株白腐菌如何大量诱导产MnP进行初步研究。为进一步优化白腐菌MnP合成条件及构建MnP超量表达的工程菌株提供理论基础,也为深入研究MnP诱导表达调控机制,将MnP广泛应用于工业提供可能。
1 材料与方法
1.1 材料与仪器
Trametesversicolor(NBRC30388),Pleurotusostreatus(NBRC30776),Bjerkanderaadusta(NBRC106826) 日本生物资源保藏中心;Dichomitussqualens(DSMZ9615) 德国微生物菌种保藏中心。
恒温摇床 Thermo;全自动高压灭菌锅 TOMY;立式高速冷冻离心机 TOMY;UV2600紫外可见分光光度计 岛津;冷冻摇床培养箱 IKA;霉菌培养箱 上海齐欣;干热灭菌箱 松下。
1.2 实验方法
1.2.1 菌液制备 在100mL三角瓶中装50mL PDB培养基,121℃高压蒸汽灭菌20min。再分别从培养好的四种菌的PDA平板中取相同大小的菌块(直径Φ7mm)至50mL PDB培养基中,于28℃恒温摇床中振荡培养5d,转速180r/min。用无菌匀浆器搅拌均匀,得到菌液。
1.2.2 外源诱导物诱导
1.2.2.1 不添加诱导物 以5%(v/v)的接种量接种菌液至50mL PDB培养基/100 mL三角瓶,摇床振荡培养(28℃,180r/min),每隔48h取样并离心(12000r/min,4℃,4 min),测定酶活,每组3个平行。
1.2.2.2 添加诱导物 在摇床振荡培养第3d,分别添加0.1mmol/L CuSO4·5H2O,0.1mmol/L MnSO4·H2O,20g/L乙醇,20g/L异丙醇,0.5mmol/L 2,5-二甲基苯胺,0.5mmol/L 4-甲氧基苯胺,0.5mmol/L松柏醇,0.5mmol/L焦性没食子酸,0.5mmol/L藜芦醇,0.5mmol/L 2,6-二甲氧基酚(DMP)至上述四种真菌的PDB培养基中,继续摇床振荡培养,以1.2.2.1作为对照。每隔48h取样并离心(12000r/min,4℃,4min),测定酶活,每组3个平行。
1.2.3 共培养 分别从培养好的两种菌的平板中取相同大小的两个菌块(直径均为Φ7mm),接种于新的同一PDA平板上,两菌块间保持约4cm距离,且距平板边缘约2cm。将该平板放在恒温培养箱中28℃培养7d左右(如图4所示)。每组3个平行。从上述培养好的共培养平板中分别取中间交界线菌块及两种菌单独培养菌块(直径均为Φ7mm)于2mL离心管中,并加入1mL 50mmol/L醋酸钠缓冲液,置于恒温摇床中振荡约8h,离心(12000r/min,4℃,4min)后取上清液测定酶活。
1.2.4 MnP活力测定 愈创木酚法[11-12]:测定体系中含0.4mmol/L愈创木酚,0.1mmol/L H2O2,0.2mmol/L MnSO4,50mmol/L(pH4.5)琥珀酸钠缓冲液。通过加入H2O2启动反应,测定反应液在465nm处吸光度随反应时间的变化。
2 结果与分析
2.1 芳香族化合物对MnP活性影响
MnP能够催化芳香族化合物的氧化反应,其催化反应过程是底物的单电子氧化,生成相应的活性自由基[2,13-14]。同时这些芳香类底物酚氧环上不同位置的取代也影响着MnP的合成。文献报道一些大分子木质素及其亚结构类似物是木质素降解酶生成的有效诱导剂。有些研究者认为白腐真菌受诱导分泌木质素降解酶类,可能是用于从培养基质中消除某些有害芳香族化合物的毒害作用,因此可以提高木质素降解酶产量[15]。本实验选择了6种普遍使用的芳香族化合物来考察它们对T.versicolor、P.ostreatus、D.squalens和B.adusta四种菌产MnP活性的影响。
对四种菌产MnP有诱导现象的芳香族化合物如图1所示(对相应菌无诱导现象的诱导物未在图中显示)。结果表明,2,5-二甲基苯胺是有效的MnP诱导剂,对该四种菌产MnP均有不同程度诱导效果。其中,添加2,5-二甲基苯胺后,T.versicolor、D.squalens和B.adusta都在培养的第7d MnP活性达到最大值,分别为5.76、18.39和81.62U/L,较对照组提高了18.77倍、2.52倍和1.56倍(图1a,b,d),而P.ostreatus在培养的第13d酶活达到最大值6.02U/L,较对照组提高了8.63倍(图1b)。其次,在接种T.versicolor的培养基中,松柏醇的诱导效果最为明显,并在培养的第5d酶活达到峰值13.81U/L,较对照组提高了164.80倍(图1a)。尽管藜芦醇是报道最多的MnP诱导剂,但在本实验中只对T.versicolor和P.ostreatus产MnP有一定诱导作用,其中对P.ostreatus的诱导效果最好,酶活达到峰值时为对照组的8.00倍(图1b)。将四株菌的对照组酶活进行对比,结果显示B.adusta产MnP能力比其它菌更强,酶活最高可达31.83U/L,且在4-甲氧基苯胺的诱导下,第5d酶活达130.125U/L,是所有芳香类物质诱导中出现的最高值(图1d)。
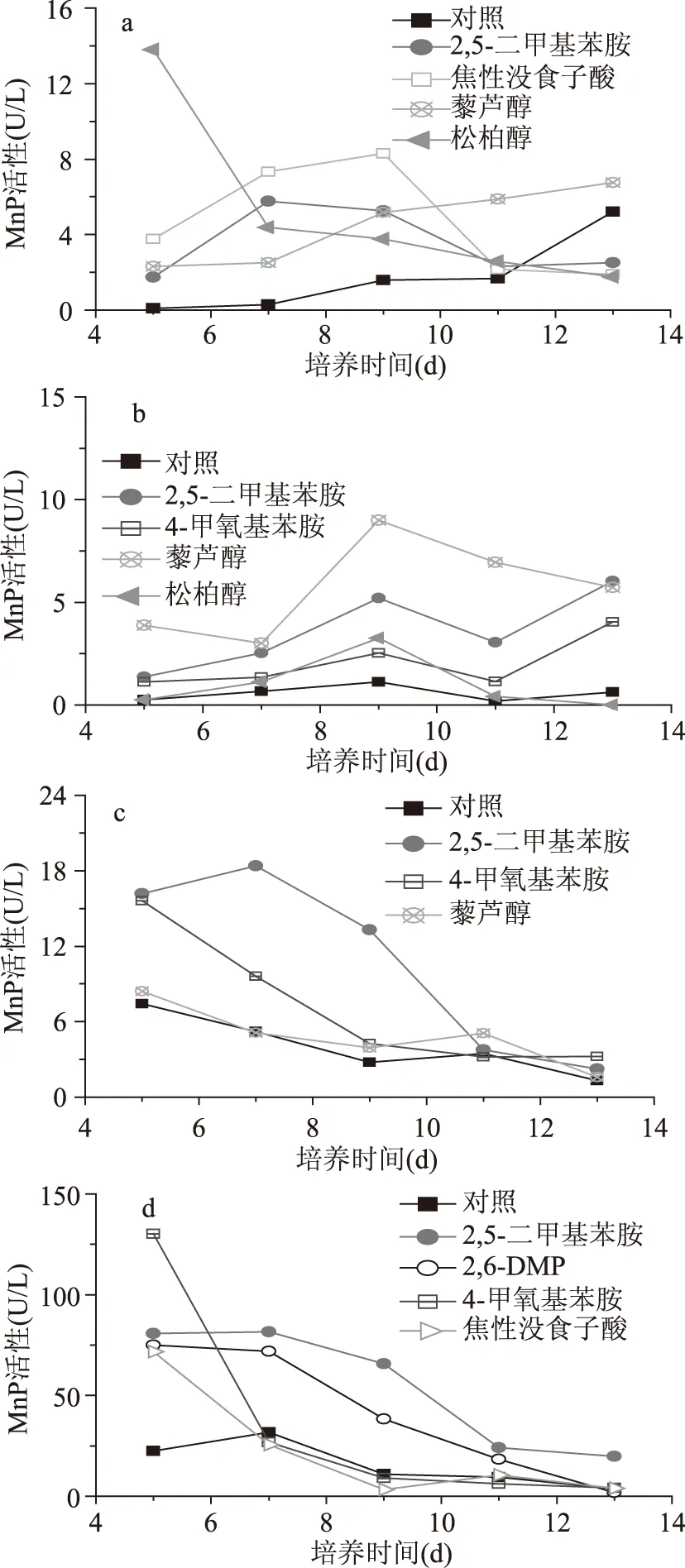
图1 不同芳香族化合物对四种白腐菌MnP活性的影响Fig.1 Effect of different aromatic compound on MnP activity of four white-rot fungus注:a:Trametes versicolor;b:Pleurotus ostreatus;c:Dichomitus squalens;d:Bjerkandera adusta。
结果表明,芳香族化合物对四种白腐菌产MnP的诱导效果较好。但随着取代基的种类、数目和位置的不同,对于白腐菌产MnP活性的影响是有差异的。另外,由于菌种不同,芳香类物质对MnP活性的影响也存在显著差异。
2.2 乙醇和异丙醇对MnP活性影响
醇类能增加白腐菌膜的渗透性,从而促进蛋白分泌。另外,醇类对白腐菌具有一定毒害作用,会刺激白腐菌分泌木质素降解酶来消除其毒害作用[16]。因此本实验考察了乙醇和异丙醇对T.versicolor、P.ostreatus、D.squalens和B.adusta四种菌产MnP活性的影响。
图2所示,在T.versicolor、P.ostreatus和D.squalens培养基中添加异丙醇后,MnP活性明显增加,说明异丙醇对这三种菌具有较好的诱导作用(图2a,b),其中对T.versicolor产MnP的诱导效果最好,在培养的第9d酶活达到峰值18.29 U/L,较对照组提高了9.97倍,均高于其它芳香族化合物对该菌的诱导酶活。相比之下,乙醇对T.versicolor、P.ostreatus和D.squalens三种菌产 MnP无明显诱导现象,只有在培养的第5d对B.adusta产MnP有较好诱导作用,能使其最高酶活达85.06 U/L,但随着培养天数增加,其酶活迅速下降,最终对该菌产MnP无诱导作用(图2d)。

图2 乙醇和异丙醇对四种白腐菌MnP活性的影响Fig.2 Effect of ethanol and isopropanol onMnP activity of four white-rot fungus注:a:Trametes versicolor;b:Pleurotus ostreatus;c:Dichomitus squalens;d:Bjerkandera adusta。
结果表明,相同浓度下,异丙醇对MnP的诱导效果优于乙醇,这或许是由于异丙醇的毒性大于乙醇,且在生物体内代谢慢,因此更易刺激白腐菌分泌MnP,从而导致MnP活性增加。但总体而言,醇类物质对MnP的诱导作用较芳香族化合物弱。
2.3 Cu2+和Mn2+对MnP活性影响
许多研究报道显示[5,17],除芳香族化合物外,微量金属离子能诱导MnP产量增加,尤其是 Mn2+和Cu2+。丁少军等人[18]在研究云芝产酶影响条件时,发现添加适量Mn2+和Cu2+均能提高MnP活性。这是由于Mn2+是 MnP活性基团的组成部分,同时又作为MnP还原底物即电子供体,对MnP有激活作用[14]。Cu2+也被认为与MnP活性位点相结合,从而对MnP有激活作用。虽然国内外对Mn2+和Cu2+诱导作用研究较多,但只局限于部分真菌,由于不同真菌分子调控机理不同,因此该实验考察了Mn2+和Cu2+对T.versicolor、P.ostreatus、D.squalens和B.adusta四种菌产MnP活性的影响。
图3所示,两种金属离子整体上能显著提高T.versicolor、D.squalens和B.adusta三种菌产MnP活性,但各自对不同菌产MnP的诱导能力不同。其中,Cu2+对T.versicolor和D.squalens两种真菌菌株产MnP诱导效果最好(图3a,c)。由图可知,在培养的第13d,Cu2+可诱导T.versicolor产MnP活性达263.98U/L,较对照组提高了49.68倍,且仍呈上升趋势;而Mn2+却对该菌产MnP无明显诱导现象(图3a)。另外,D.squalens培养基添加Cu2+后,在第11d酶活达到峰值225.79 U/L,较对照组提高了63.90倍,且比芳香族化合物最佳诱导酶活(18.39U/L)高出了11.28倍;此外Mn2+在该菌培养9d后开始刺激了MnP产量,并在第13d使其酶活达106.29U/L,较对照组提高78.73倍(图3c)。Mn2+对P.ostreatus和B.adusta产MnP的刺激效果也是不可忽视的,但其最佳诱导时间和诱导趋势因菌种而异。例如,添加Mn2+后,P.ostreatus在培养的第9d酶活达到峰值7.92U/L(图3b);B.adusta在第5d酶活达最高值140.21U/L,但之后呈下降趋势(图3d)。

图3 Cu2+和Mn2+对四种白腐菌MnP活性的影响Fig.3 Effect of Cu2+and Mn2+on MnP activity of four fungus注:a:Trametes versicolor;b:Pleurotus ostreatus;c:Dichomitus squalens;d:Bjerkandera adusta。
结果表明,Mn2+和Cu2+能诱导四种白腐菌大量产MnP,且总体上对MnP的诱导效果优于芳香族化合物,因此可对上述四种真菌中金属离子是如何跨膜与MnP活性位点结合以及结合的具体位置进行进一步深入研究。
2.4 不同真菌菌丝间相互作用对MnP活性的影响
不同真菌菌丝间诱导主要是通过共培养的方式实现。该实验将T.versicolorshi,P.ostreatus,D.squalens,B.adusta四株菌两两组合,分别进行共培养。
结果显示T.versicolorshi、P.ostreatus和D.squalens三种菌两两共培养时MnP活性较单一菌株培养时均有不同程度地提高(图4),表明这三种菌可能具有种间诱导能力。其中,T.versicolorshi和D.squalens共培养时MnP活性最高,达44.02U/L,较T.versicolorshi和D.squalens单一培养时的酶活0.77U/L和0.51U/L分别提高了56.17倍和85.31倍。而B.adusta分别与上述三种真菌两两共培养时MnP活性均没有提高(图中未显示),这或许因为B.adusta不具有种间诱导能力。

图4 不同真菌菌丝种间诱导对MnP酶活的影响Fig.4 Effect of different hyphal interspecific induction on MnP activity注:A:Trametes versicolor;B:Pleurotus ostreatus;C:Dichomitus squalens,D:Bjerkandera adusta。
早前一些研究者也尝试通过真菌共培养方法来增加真菌分泌的MnP产量。例如,Chi Y等人[19]发现Pleurotus.ostreatus与Ceriporiopsis.subvermispora以及Pleurotus.ostreatus与Physisporinus.rivulosus进行共培养时,其MnP活性比各自单一培养时高,并推测是由于不同真菌对于空间和营养的竞争会导致木质素的降解增强,同时也提高了木质素降解酶(包括MnP)的产量。目前关于真菌间相互作用研究较少,因此其MnP种间诱导的分子机理还需进一步研究。
3 结论
不同外源诱导物对不同白腐菌产MnP的诱导效果不同。对比T.versicolor、P.ostreatus、D.squalens和B.adusta四种菌MnP诱导后的活性,结果表明,T.versicolor、D.squalens、B.adusta三种菌的MnP更具外源诱导物诱导潜力,并且微量金属离子Mn2+和Cu2+对MnP的诱导作用大于芳香族化合物和醇类物质,能显著增加MnP产量。不同真菌相互作用时,T.versicolor,P.ostreatus和D.squalens三种菌两两组合共培养的MnP活性较单一培养时均有明显增加,因此推测这三种白腐菌可能具有种间诱导潜力。
[1]王敏,白腐菌降解木质素研究进展[J].衡水学院学报,2011,13(1):51-53.
[2]Hatakka A,Biodegradation of lignin. In:Hofrichter M,Steinbuchel A,editors. Biopolymers. Vol. 1-Lignin,humic substances and coal[J]. Weinheim,Germany:Wiley-VCH,2001,p:129-180.
[3]胡雪竹. 木质素降解酶的研究进展[J].安徽农业科学,2011,39(11):6326-6328.
[4]Maciel M J M,Silva A C,Ribeiro H C T. Industrial and biotechnological applications of ligninolytic enzymes of the basidiomycota:A review[J]. Electronic Journal of Biotechnology,2010,ISSN:0717-3458.
[5]Elisashvili V,Kachlishvili E. Physiological regulation of laccase and manganese peroxidase production by white-rot Basidiomycetes[J]. Journal of Biotechnology,2009,144:37-42.
[6]Yakovlev I A,Hietala A M,Courty P E,et al. Genes associated with lignin degradation in the polyphagous white-rot pathogen Heterobasidion irregulate show substrate-specific regulation[J]. Fungal Genetics and Biology,2013,56:17-24.
[7]Christian V V,Shrivastava R,Novotny C,et al. Decolorization of sulfonphthalein dyes by manganese peroxidase activity of the white rot fungus Phanerochaete chrysosporium[J]. Folia Microbiol(Praha),2003,48:771-774.
[8]Xu H,Scott G,Jiang F,et al. Recombinant manganese peroxidase(rMnP)from Pichia pastoris. Part 1:Kraft pulp delignification[J]. Holzforschung,2010a,64:137-143.
[9]Xu H,Scott G,Jiang F,et al. Recombinant manganese peroxidase(rMnP)from Pichia pastoris. Part 2:application in TCF and ECF bleaching[J]. Holzforschung,2010b,64:145-151.
[10]Grzegorz J,Katarzyna H K,Anna P,et al. Fungal laccase,manganese peroxidase and lignin peroxidase:Gene expression and regulation[J]. Enzyme and Microbial Technology,2013,52:1-12.
[11]Paszczynski A,Crawford R L,Huynh. V B. Manganese peroxidase of Phanerochaete chrysosporium:purification[J]. Methods Enzymol,1988,161:264-270.
[12]周金燕,张发群.愈创木酚法测定锰过氧化物酶活力[J].纤维素科学与技术,1993,1(1):34-37.
[13]Wariishi H,Akaleswaran L,Gold M H. Manganese peroxidase from the basidiomycete Phanerochaete chrysosporium:spectral characterization of oxidized states and the catalytic cycle[J]. Biochemistry,1988,27:5365-5370.
[14]池玉杰,伊洪伟.木材白腐菌分解木质素的酶系统-锰过氧化物酶、漆酶和木质素过氧化物酶催化分解木质素的机制[J].菌物学报,2007,26(1):153-160.
[15]肖亚中,张敏,吴涓,等.影响白腐真菌一菌株漆酶合成的因子和发酵条件[J]. 生物工程报,2001,2(2):137-140.
[16]李慧蓉.白腐真菌生物学和生物技术[M].北京:化学工业出版社,2005.
[17]徐春燕,王宏勋,周建兵,等.诱导物和金属离子对竹子白腐菌降解影响的研究[J].生物技术,2005,15(6):68-69.
[18]丁少军,王传槐.不同培养条件对云芝木质素降解酶产酶影响的研究[J]. 纤维素科学与技术,1994,2(2):36-46.
[19]Chi Y,Hatakka A,Maijala P. Can co-culturing of two white-rot fungus increase lignin degradation and the production of lignin-degrading enzymes? Int[J].Biodeterioration. Biodegradation,2007,59:32-39.
Induction on the Manganese Peroxidase of white-rot fungi by exogenous inducers and interspecific induction
ZHONG Zi-xuan,LIU Li,ZHANG Yong,LUO Feng*
(College of Resource and Environment,Southwest University,Chongqing Key Laboratory of bio-energy resource developement,Chongqing 400716,China)
The study investigated the MnP activity ofTrametesversicolor,Pleurotusostreatus,Dichomitussqualens,Bjerkanderaadustaby two kinds of induction,exogenous inducer and interspecific induction between different fungi,and discovered that in some induction condition,these white-rot fungi could produce large amounts of MnP. The results showed that in exogenous inducers,2,5-dimethylaniline was an effective MnP inducer,which could enhance MnP activity of four fungi to different extent. Isopropyl alcohol could enhance MnP activity ofT.versicolor,P.ostreatusandD.squalens,and it was better than that of ethanol. Cu2+could significantly enhance MnP activity ofT.versicolorandD.squalens. Mn2+could significantly enhance MnP activity ofP.ostreatusandB.adusta. When induced by interspecific induction between different fungi by co-cultivation,T.versicolor,P.ostreatusandD.squalensscould strongly enhance MnP activity each other. The study provided possibility for large production of MnP and being applied to industry.
white-rot fungi;Manganese Peroxidase;exogenous inducer;interspecific induction
2014-07-14
钟紫旋(1991-),女,研究生,研究方向:生物能源与环境修复。
*通讯作者:罗锋(1977-),男,博士,教授,研究方向:生物能源与环境修复。
国家外专干人计划活动专项(2012SWU112097);中央高校基本科研重点项目(XDJK2011B009)资助项目。
TS201.3
A
:1002-0306(2015)09-0166-05
10.13386/j.issn1002-0306.2015.09.028
