瑞舒伐他汀通过激活SGK1上调ALI小鼠ENaC表达的实验研究*
2015-02-09冯社军王慧娟李军涛武艳强朱涛
冯社军 王慧娟 李军涛 武艳强 朱涛
(1.邯郸市中心医院,河北 邯郸 056001;2.四川大学华西医院呼吸病学研究室/呼吸内科,四川 成都 610041)
非心源性肺水肿(non-cardiac pulmonary edema)是急性肺损伤(acute lung injury,ALI)和急性呼吸窘迫综合症(acute respiratory distress syndrome,ARDS)最重要的病理特点之一,也是ALI/ARDS 最特征性的病理生理学改变[1~4]。临床研究发现,在ARDS状态下非心源性肺水肿是导致肺顺应性下降和肺氧合功能障碍的主要原因之一,也是导致早期ARDS患者死亡的主要因素[1~4]。研究证实,改善肺水肿可以有效改善肺顺应性和肺换气功能,降低ALI模型动物的死亡率。大量研究表明,他汀类药物具有独立于降脂以外的包括抑制炎症反应、抗肿瘤和抗凋亡等多种生物学活性[5~8]。同时发现他汀可以有效促进血清和糖皮质激素诱导的蛋白激酶1(SGK1)的活化[7]。由于SGK1是调节肺上皮细胞ENaC的关键分子,实验表明,激活SGK1可有效上调ALI状态下肺上皮细胞ENaC 的表达而改善肺水肿[3]。本文探讨在LPS诱导的小鼠ALI状态下,瑞舒伐他汀能否通过上调肺组织ENaC 的表达改善肺水肿的严重程度及相关的分子机制。
1 材料和方法
1.1 主要材料 SPF 级雄性C57BL/6小鼠30只,6~10周龄,体重约18~22g,购于四川大学实验动物中心。电泳单元及电泳附件、电源、湿转式电转仪、凝胶成像系统由Bio-rad公司提供。瑞舒伐他汀购于瑞典阿斯利康制药有限公司;大肠埃稀杆菌内毒素(LPS)购自美国Sigma公司;聚合酶链反应(PCR)引物由上海生物工程技术服务有限公司合成;总RNA抽提试剂盒购自北京百泰克生物技术有限公司;第一链cDNA 合成试剂盒和PCR 试剂盒购自美国Mbi Fermentas公司;兔抗鼠α-ENaC 抗体、兔抗鼠β-肌动蛋白(β-actin)抗体、兔抗鼠phospho-SGK1抗体以及兔抗鼠SGK1 抗体均购自美国Santa Cruz Biotechnology公司。
1.2 方法
1.2.1 LPS诱导的小鼠ALI模型的建立 30 只雄性C57BL/6大鼠随机平均分为对照组(Control组)、干预组(LPS+ROS 组)和模型组(LPS 组),每组10只。腹腔注射戊巴比妥(30mg/kg)麻醉小鼠。干预组和模型组小鼠通过气道内注射LPS(10μg LPS溶于50μl生理盐水)诱导建立ALI模型[1]。注入LPS前2小时,干预组给予口服瑞舒伐他汀(30mg/kg),每日1次;对照组给予生理盐水代替LPS。于干预72 小时后下腔静脉放血处死小鼠。
1.2.2 HE染色观察病理变化并进行肺损伤评分取左下肺组织,常规制成5μm 的石蜡切片,HE 染色观察肺损伤程度,并进行肺损伤评分[1]。
1.2.3 肺组织湿/干比(wet to dry ratio,W/D)测定小鼠处死后取出肺组织。将小鼠右下肺置于80℃烤箱24 小时至恒重后,记录前后肺组织重量,计算W/D 比值。
1.2.4 RT-PCR 法检测α-ENaC mRNA 表达 取左上肺组织,按照试剂盒说明书提取总RNA。引物:α-ENaC 正 义:5′-TCACTTCAGCA CATCTTC CACAGCTGC-3′,反 义:5′-GTATCTGC CTAGCTGGTC CAAGTGGGA-3′;β-actin 引 物:正 义:5′-CGAGCGGGC TACAG CTTC-′,反 义:5′-GTCACGC ACGATTC CCTCT-3′,按照试剂盒说明书介绍进行反转录和扩增实验。应用凝胶成像系统(Bio-rad)摄影,Quantity One软件对目的条带进行扫描分析。用α-ENaC/β-actin PCR 产物条带灰度比值作为α-ENaC mRNA 的相对表达量。
1.2.5 Western blot检测肺组织α-ENaC 蛋白表达和SGK1活化水平 按照试剂盒操作要求,首先提取肺组织总蛋白,并进行聚丙烯酰胺凝胶电泳(SDSPAGE),然后转移至硝酸纤维素滤膜上,用脱脂奶粉封闭1小时,分别加入兔抗鼠α-ENaC抗体(1∶1000)、兔抗鼠β-actin抗体(1∶2000)、兔抗鼠phospho-SGK1抗体(1∶1100)以及兔抗鼠SGK1抗体(1∶1100),4 ℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1∶1000),用ECL 进行显色,用凝胶成像分析系统进行扫描。
2 结果
2.1 肺组织病理学变化和肺损伤评分 在干预72小时后,获取小鼠肺组织,HE 染色后光镜观察。对照组小鼠肺组织未见病理改变,肺组织结构清晰,肺泡间隔结构完整,无炎症细胞浸润,无红细胞进入肺泡腔,无透明膜形成;模型组小鼠肺组织出现严重的病理学改变,主要表现为肺泡间隔增厚,肺组织中大量炎症细胞浸润,肺泡和肺间质大量水肿液聚集,肺泡腔中出现大量红细胞,肺泡中透明膜形成;干预组小鼠肺组织病理改变相对较轻,主要表现为肺泡和肺泡间隔内轻度炎症细胞浸润,肺间质性肺水肿形成,仅部分肺泡内出现水肿液聚集和红细胞,并可见少量透明膜。进行肺损伤评分后发现,LPS组小鼠肺组织损伤评分高于干预组,差异有统计学意义(P<0.05),见图1、表1。
表1 小鼠肺组织损伤评分和W/D值()Table 1 Lung injury scores and W/D ratio in mice
注:与对照组比较,①P<0.05;与模型组比较,②P<0.05
2.2 肺组织湿干比(W/D 比值)在干预72小时后,LPS干预小鼠肺组织W/D 比值较对照组明显增加,差异有统计学意义(P<0.05)。但干预组小鼠肺组织的W/D 比值较模型组更低,差异有统计学意义(P<0.05),见表1。
2.3 肺组织α-ENaC 的表达水平 使用RT-PCR 和western blot对肺组织中α-ENaC mRNA 和蛋白表达分析后发现,在LPS干预72小时后小鼠肺组织中α-ENaC mRNA 和蛋白表达量较对照组明显降低,差异有统计学意义(均P<0.05)。但瑞舒伐他汀干预组小鼠肺组织α-ENaC表达量较模型组小鼠升高,差异亦有统计学意义(P<0.05),见图2、表2。
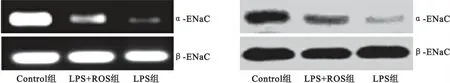
图2 肺组织α-ENaC表达RT-PCR和western blotting结果Figure 2 The RT-PCR and western blot results ofα-ENaC in each group
表2 肺组织α-ENaC mRNA 和蛋白的表达水平及SGK1的活化水平()Table 2 The mRNA and protein expression ofα-ENaC and the activity of SGK1in the lung tissues

表2 肺组织α-ENaC mRNA 和蛋白的表达水平及SGK1的活化水平()Table 2 The mRNA and protein expression ofα-ENaC and the activity of SGK1in the lung tissues
注:与对照组比较,①P<0.05;与模型组比较,②P<0.05
2.4 肺组织SGK1活化水平 使用western blot对肺组织中SGK1 活化水平(phospho-SGK1/total SGK1)分析后发现,在LPS干预72小时后小鼠肺组织中SGK1活化水平较对照组明显下降,差异有统计学意义(P<0.05)。但瑞舒伐他汀干预组小鼠肺组织SGK1活化水平较模型组升高,差异亦有统计学意义(P<0.05),见图3、表2。
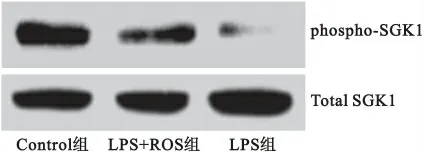
图3 肺组织SGK1活化水平结果Figure 3 The activity of SGK1results in lungs
3 讨论
急性肺损伤(ALI)是一种由多种严重的肺内或肺外疾病,如重症肺炎、肺脓肿、严重脓毒血症和休克等导致的失控和自我放大的、以肺组织为中心的炎症反应[1~4,9]。急性呼吸窘迫综合症(ARDS)是其更加严重的状态。目前流行病学调查和临床研究结果表明,ARDS的病死率高达35%~50%,寻求新的治疗方法和药物具有重要的价值和意义[4]。非心源性肺水肿(non-cardiac pulmonary edema)是ALI/ARDS 最重要的病理改变之一,也是ALI/ARDS 最特征性的病理生理改变[1~4,9]。临床研究发现,非心源性肺水肿是导致肺顺应性下降和肺氧合功能障碍的主要原因之一,也是导致早期ARDS 患者死亡的主要因素[1~4,9]。研究证实,改善肺水肿可以有效改善肺顺应性和肺换气功能,降低ALI 模型动物的死亡率[1~4,9]。
研究发现,他汀类(statin)药物包括瑞舒伐他汀(rosuvastatin)和辛伐他汀(simvastatin)等具有独立于降脂以外的包括抑制炎症反应、抗肿瘤和抗凋亡等多种生物学活性[5~8,10]。Zhu T 等研究证实,瑞舒伐他汀可以通过抑制炎症反应下调OVA 诱导的小鼠气道粘液的分泌[6]。Duivenvoorden R 等的研究发现,他汀对动脉粥样硬化相关的炎症反应有明显地抑制作用[10]。我们的实验表明,LPS诱导72小时后小鼠肺组织出现显著的病理学改变,主要表现为肺泡间隔增厚,肺组织中大量炎症细胞浸润,肺泡和肺间质大量水肿液聚集,肺泡腔中出现大量红细胞,肺泡中透明膜形成。而瑞舒伐他汀进行干预后,小鼠肺组织病理改变明显减轻,主要表现为肺泡和肺泡间隔内轻度炎症细胞浸润,肺间质性肺水肿形成,仅部分肺泡内出现水肿液聚集和红细胞,并可见少量透明膜。进一步肺损伤评分后发现,干预组小鼠肺组织损伤评分显著低于LPS组。对肺水肿严重程度进行分析后也发现,LPS干预后小鼠肺组织W/D 比值较对照组明显增加,但瑞舒伐他汀干预后小鼠肺组织的W/D 比值较模型组更低。以上结果表明,瑞舒伐他汀可以明显减轻LPS诱导的小鼠ALI模型肺组织炎症反应和肺水肿。
进一步的研究发现[3,9,11],肺水肿的形成和清除与肺上皮细胞表达的钠离子通道(ENaC)密切相关,ENaC是肺泡液体清除的关键和限速环节,其表达和功能的异常是导致ARDS非心源性肺水肿的重要原因。ENaC由α、β和γ3种亚基构成,ENaC 在肺泡I型和II型上皮细胞上广泛表达,而α亚基是ENaC 的功能亚基,β和γ 亚基对ENaC 活性具有调节作用。本研究发现,在LPS干预72小时后,小鼠肺组织中α-ENaC mRNA 和蛋白的表达量明显下降,但瑞舒伐他汀干预组小鼠肺组织α-ENaC表达量较模型组小鼠升高,提示在ALI状态下,瑞舒伐他汀能够通过促进ENaC的表达改善肺水肿。
另有研究证实,SGK1 是调节肺上皮细胞ENaC表达的关键分子,促进SGK1 磷酸化(即SGK1 的活化)对于调节ENaC 的表达具有重要作用[12]。Zhu T等的研究表明,LPS 诱导的ALI 大鼠模型中促进SGK1磷酸化可以通过上调肺组织中ENaC 以减轻肺水肿的严重程度[3]。Zhang L 等研究表明,他汀类药物也可诱导SGK1 磷酸化的发生[7]。本实验中我们使用western blot法对SGK1 的活化水平(phospho-SGK1/total SGK1)进行分析后发现,在LPS干预72小时后小鼠肺组织中SGK1活化水平较对照组明显下降,但给予瑞舒伐他汀干预的小鼠肺组织SGK1活化水平较模型组小鼠升高。提示在ALI状态下,瑞舒伐他汀可以诱导肺组织中SGK1的活化。
4 结论
本研究结果表明,在LPS 诱导的小鼠ALI状态下,瑞舒伐他汀可以通过增加肺组织ENaC 的表达有效地改善肺水肿严重程度,并发现该机制与促进SGK1的活化密切相关。这为他汀类药物应用于ARDS的临床治疗奠定了基础。
[1]Zhu T,Wang D,Zhang W,et al.Andrographolide protects against LPS-induced acute lung injury by inactivation of NF-κB[J].PloS one,2013,8(2):56407.
[2]朱涛,肖敏,文富强,等.脱氢穿心莲内酯琥珀酸半酯上调水通道蛋白5减轻LPS诱导的急性肺损伤肺水肿的实验研究[J].西部医学,2014,26(1):16-18.
[3]Zhu T,Zhang W,Wang DX.Insulin up-regulates epithelial sodium channel in LPS-induced acute lung injury model in rats by SGK1activation[J].Injury,2012,43(8):1277-1283.
[4]ARDS Definition Task Force,Ranieri VM,Rubenfeld GD,et al.Acute respiratory distress syndrome[J].Jama,2012,307(23):2526-2533.
[5]Uekawa K,Hasegawa Y,Ma M,et al.Rosuvastatin Ameliorates Early Brain Injury after Subarachnoid Hemorrhage via Suppression of Superoxide Formation and Nuclear Factor-Kappa B Activation in Rats[J].J Stroke Cerebrovasc Dis,2014,(13):1052-3057.
[6]Zhu T,Zhang W,Wang DX,et al.Rosuvastatin attenuates mucus secretion in a murine model of chronic asthma by inhibiting the gamma-aminobutyric acid type A receptor[J].Chin Med J(Engl),2012,125(8):1457-1464.
[7]Zhang L,Liu J,Liu Y,et al.Fluvastatin inhibits the expression of fibronectin in human peritoneal mesothelial cells induced by high-glucose peritoneal dialysis solution via SGK1pathway[J].Clin Exp Nephrol,2014,20:9124-9130.
[8]张维,朱涛,王导新,等.瑞舒伐他汀抑制小鼠哮喘模型慢性气道炎症反应的实验研究[J].西部医学,2014,26(02):150-153.
[9]王导新,邓旺.急性呼吸窘迫综合征肺水肿液清除与正压通气研究进展[J].西部医学,2014,26(2):133-135.
[10]Duivenvoorden R,Tang J,Cormode DP,et al.A statin-loaded reconstituted high-density lipoprotein nanoparticle inhibits atheroscle-rotic plaque inflammation[J].Nat Commun,2014,5:3065.
[11]刘佩英,徐道妙.辛伐他汀对脂多糖诱导的Ⅱ型肺泡上皮细胞钠通道α亚基的影响[J].中国危重病急救医学,2012,24(10):604-607.
[12]Mattes C,Laube M,Thome UH.Rapid elevation of sodium transport through insulin is mediated by AKT in alveolar cells[J].Physiol Rep,2014,2(3):00269.
