下调受精卵中Clock基因对早期小鼠胚胎DNA甲基化的影响*
2015-02-09成姝婷梁鑫王正荣李世平刘延友汪宇辉江舟肖静郭慧玲
成姝婷 梁鑫 王正荣 李世平 刘延友 汪宇辉 江舟 肖静 郭慧玲
(四川大学华西基础医学与法医学院生物医学工程学研究室,四川 成都 610041)
在哺乳动物中,至少有两种不同的方式来反映局部染色质结构的信息,一种是通过对那些在DNA 复制过程中起作用的某些组蛋白特定残基甲基化[1,2];另一种是通过对那些能够复制DNA 的特定胞嘧啶残基甲基化[3,4]。这两种方式的印记都能够很容易地复制给新合成的DNA 链,并且一代一代的传递下去,也就是所谓的表观遗传学修饰。表观遗传学修饰包括DNA 甲基化和组蛋白修饰,通过改变局部的染色质结构而调节基因表达,从而改变染色质和DNA 结合蛋白之间的相互作用,如转录激活子和抑制子与基因启动子和增强子之间的结合[5]。不同于遗传变异,表观遗传学修饰调节基因表达不会改变其核苷酸序列。值得注意的是,人们在对表观遗传学修饰的最初研究里并没有把其与时序调节联系在一起,因为通常都认为这些印记高度稳定,甚至传代也不会改变。一直以来,研究人员对近日节律分子机制的研究通常也都是针对以转录/转录后反馈环路为基础的这个复杂遗传网络[6,7]。然而,近期的研究证明,组蛋白和DNA 甲基化远比从前所想的要活跃得多。例如:超过100个DNA 甲基化位点为了与细胞周期同步而发生近日震荡[8],而细胞周期也常常受到近日生物钟的控制[9,10]。这些研究让研究者们开始认识到了表观遗传学调节与近日节律系统之间的联系。DNA 甲基化一般是在胞嘧啶的CpG 位点上加上一个甲基团。这是哺乳动物胚胎发育接受表观遗传调节的一个重要环节。研究表明,DNA 甲基化对于动物胚胎发育阶段的基因调节,特别是组织特异性基因,具有至关重要的作用[11]。值得注意的是,除了印记基因外,哺乳动物基因组的表观遗传学修饰在早期胚胎发育阶段会被消除,并在之后的整个胚胎发育阶段得到重建[12~14]。目前大多数对DNA 甲基化的研究,都是关于配子生成、发育、疾病和干细胞功能的,这些研究阐明了DNA 甲基化是如何调节基因表达和细胞分化的[15~18]。而关于节律基因在胚胎基因组DNA 甲基化中所起作用的研究则非常少。
本研究应用RNAi技术下调从二细胞期到囊胚期这段时间内小鼠受精卵中Clock 基因的表达,研究了7.5~11.5dpc之间的小鼠胚胎基因组DNA 甲基化水平的改变,以及在哺乳动物催化发育过程中去甲基化的CpG 位点重新甲基化的主要甲基转移酶Dnmt3a和Dnmt3b。本研究结果显示,Clock 基因干扰的小鼠胚胎基因组DNA 甲基化水平比阴性对照组显著升高,而甲基转移酶Dnmt3a和Dnmt3b的RNA 表达水平也显著增加了。因此,这些结果为我们提供了一个新的信息,那就是节律基因Clock 能够通过甲基转移酶Dnmt3a和Dnmt3b调节早期小鼠胚胎基因组DNA 的甲基化水平。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级ICR 雄性小鼠(6~8周)30只,雌鼠(4~6周)65只,由成都达硕实验动物有限公司提供。所有雄鼠单只每笼,雌鼠5 只每笼,均单独饲养于12L∶12D 光暗循环箱中,自由进食和饮水。
1.1.2 主要仪器 倒置生物显微镜TE 2000-U(日本,Nikon),CO2恒温细胞孵箱(日本,SANYO),高效液相色谱仪(美国,VARIAN Pro Star),PCR 仪(德国,Eppendorf),电泳仪及水平电泳槽(美国,BIORAD),超净细胞工作台、凝胶成像仪、恒温振荡培养箱、微量注射器及眼科剪、眼科镊等均为国产。
1.1.3 主要试剂 孕马血清促性腺激素PMSG、注射用绒促性腺激素HCG(宁波市激素制品有限公司),Clock干扰质粒和HK 阴性对照质粒(武汉市晶赛生物工程技术有限公司),DMEM 高糖培养液、Opti-MEMI培养液和胎牛血清(美国,HyClone),LipofectamineTM2000细胞转染试剂、Trizol(美国,Invitrogen),基因组DNA 提取试剂盒(美国,OMEGA),核酸酶P1、碱性磷酸酶、2′-脱氧胞苷dC 和5-甲基-2′-脱氧胞苷mdC(美国,Sigma),第一链cDNA 合成试剂盒、Taq酶(美国,Fermentas),其它试剂为国产分析纯。
1.2 方法
1.2.1 获得胚胎样本 本实验为了对小鼠受精卵中Clock基因的表达进行干扰,特采用人工授精(IVF)的方法先在体外得到受精卵,转染干扰质粒后,再将其移植回假孕雌鼠子宫中以得到所需胚龄(dpc)的小鼠胚胎。
1.2.1.1 人工授精 在进行IVF前64小时,对每只实验用雌鼠腹腔注射10IU 的PMSG,48小时后再对这些雌鼠腹腔注射10IU 的HCG。颈椎脱臼法处死40只雌鼠,取出输卵管,放进装有0.5ml T6 培养液(含20mg/ml BSA)的培养皿内,撕开膨大的壶腹部,释放出卵丘卵母细胞复合体,将其转移到mCZB 受精滴中,放入37℃的CO2孵箱中孵育得到成熟卵子。颈椎脱臼法处死20只雄鼠,摘取附睾,用眼科剪刀将每段附睾尾剪成4 段,轻轻挤压出精液,然后将其放置在37℃的CO2孵箱中孵育30 分钟,让精子充分游出,然后将表面皿中的精子悬液移至1.5ml的EP 管中,继续放置在37℃的CO2孵箱中孵育60分钟以获能。调整精子浓度到1×106/ml,每滴含有成熟卵子的受精滴加入10μl获能的小鼠精子悬液,继续放回37℃的CO2孵箱中孵育6小时,观察并分离出受精滴中的二细胞受精卵,以备后续实验。
1.2.1.2 质粒干扰 将分离出的受精卵随机分为Clock干扰组(Clock组)和阴性对照组(HK 组)两组,以LipofectamineTM2000细胞转染试剂分别将Clock干扰质粒和HK 阴性对照质粒转染到二细胞受精卵中。将两组转染后的受精卵放置在37℃的CO2孵箱中孵育到第5天得到囊胚期胚胎。
1.2.1.3 囊胚移植 在囊胚移植前20天,将10只雄鼠行输精管结扎术,14天后与25只促排卵雌鼠交配获得假孕雌鼠。将假孕5 天的受体雌鼠用水合氯醛麻醉后,剔除其后腹部的毛并用75%酒精消毒,作一个长约1cm 的切口,轻轻牵拉出两侧子宫角,用4号针头在子宫角壁上刺一小孔,分别把12 个胚胎注入两侧子宫角,将子宫角放回腹腔后缝合肌肉、皮肤。
1.2.1.4 获取胚胎 从7.5dpc开始,每天颈椎脱臼法处死Clock干扰组和HK 对照组的受孕雌鼠各2只,剥离其子宫内的小鼠胚胎,冷冻于-80℃低温冰箱,到11.5dpc结束。
1.2.2 胚胎基因组DNA 甲基化水平 本实验参照《分子克隆实验指南》中检测DNA 甲基化的标准方法,先将DNA 样品水解成碱基,水解产物通过液相色谱柱,所得结果与标准品相比较,并用紫外光测定其吸收峰值及出峰面积,计算mdC/(mdC+dC)的积分面积,从而得到基因组整体的甲基化水平。
1.2.2.1 提取DNA 使用OMEGA 基因组DNA 提取试剂盒(D3396-02E.Z.N.A.TM Tissue DNA Kit)提取7.5~11.5dpc胚胎的DNA。
1.2.2.2 水解DNA 将DNA 样本浓度调节到0.5μg/μl,每个样本吸取3μl开水浴2min 后快速冷却,加入0.75μl ZnSO4(10mM)和1.25μl核酸酶P1,混匀后在37℃孵 育16 小 时;再加入1.25μl Tris(0.5M,pH 8.3)和0.75μl碱性磷酸酶[50U/ml溶于2.5M 的(NH4)2SO4],37℃孵育2小时,离心后取上清。
1.2.2.3 高效液相色谱法检测 本实验采用25cm的C18反相色谱柱,柱温设定为35℃,泵A 缓冲液为甲醇,泵B缓冲液为0.05M KH2PO4(pH 4.0);流动相为8%甲醇+92%0.05M KH2PO4(pH 4.0),流速为1ml/min,UV 波长为280nm,运行时间为30min。标准品采用mdC 和dC,注入样品为水解DNA 所得单核苷。样本中甲基化的定量以总胞苷中mdC 的百分比来计算。
1.2.3 甲基转移酶水平 用酚:氯仿法提取7.5~11.5dpc胚胎的RNA,使用Fermentas的第一链cDNA 合成试剂盒将其逆转录为cDNA。引物序列如下:Dnmt3a:5′-TCACAAGGAAGTTTACACCGAC-3′和5′-GAGGCTCCCACATGAGATACA-3′;Dnmt3b:5′-CGCTCAAGGAGTTGGGTATT-3′和5′-TCTTTGCGGGCAGGATT-3′;Gapdh:5′-TCACTGCCACCCAGAAGA-3′和5′-AAG TCG CAG GAG ACA ACC-3′。电泳PCR 的扩增产物,用PCR 仪自带的分析软件读取条带灰度值,并以Gapdh为参照,比较这段时间内两种甲基转移酶的表达变化。
2 结果
2.1 小鼠胚胎获取结果 人工授精实验中观察并分离出的二细胞受精卵共528枚。分别转染Clock干扰质粒和HK 阴性对照质粒后,有37 枚没有发育到囊胚;另随机抽取10枚检测转染效果,剩余481枚受精卵移植到假孕雌鼠子宫内。25只造模的雌鼠仅得到20只假孕受体。Clock 组和HK 组所得到的7.5~11.5dpc胚龄的小鼠胚胎数量见表1。
2.2 受精卵中Clock 基因下调对早期胚胎基因组DNA 甲基化水平的影响 我们应用高效液相色谱法得到了Clock 组和HK 组胚胎基因组DNA 中mdC和dC碱基的出峰面积,并通过公式:计算得到基因组整体的甲基化水平。结果发现,除了7.5dpc之外,从8.5~11.5dpc 的DNA 甲基 化水平均是Clock组显著高于HK 组(P<0.05),见图1。
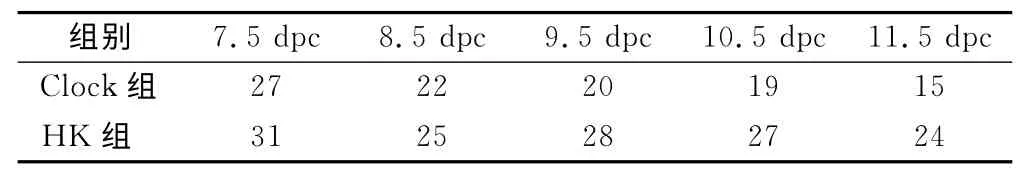
表1 两组小鼠取得各胚龄(dpc)胚胎数量(个)Table 1 Embryonic numbers in each dpc of the two groups

图1 小鼠胚胎基因组DNA甲基化水平变化Figure 1 Methylation level changes of genomic DNA in mice embryos
2.3 干扰受精卵Clock基因表达对早期胚胎中DNA甲基转移酶的影响 Clock组小鼠胚胎中甲基转移酶Dnmt3a的表达从8.5dpc开始到11.5dpc均显著高于HK 组(P<0.05),而其在7.5dpc时则无显著差异(P>0.05),见图2A。而甲基转移酶Dnmt3b则从7.5~11.5dpc均是Clock组显著高于HK 组(P<0.05),见图2B。
3 讨论
目前已有研究证明,近日节律系统与哺乳动物的生殖存在千丝万缕的联系。本实验室在前期研究中已经证实干扰雄性小鼠圆形精子中Clock基因的表达后,可以引起雄鼠的生殖能力降低,这种影响不仅表现在与雄鼠交配的雌鼠胎仔数的减少、体外受精实验中囊胚形成率的降低,还表现在其子代胚胎发育过程中早期吸收胎的增多[19]。早期胚胎发育的过程包含了许多重要细胞命运的决定,还有染色质状态的改变。在这段期间,多种表观遗传学机制的运行改变了染色质的结构,使得某些基因的表达激活,而另一些基因的表达沉默[20]。通常情况下,发育中的胚胎DNA 甲基化模式在个体的整个发育阶段以及之后的成年时期都会保持稳定[11]。然而个别位点DNA 甲基化的改变是存在的,并且这种改变能够影响某些在发育和病理过程中具有重要生物功能的基因表达[15,21],如全基因组范围或是特定基因位点5-甲基胞嘧啶水平的变化会增加疾病的易感性,DNA 甲基化的失调与心血管疾病、Ⅱ型糖尿病以及肿瘤有密切的关联[21~23]。
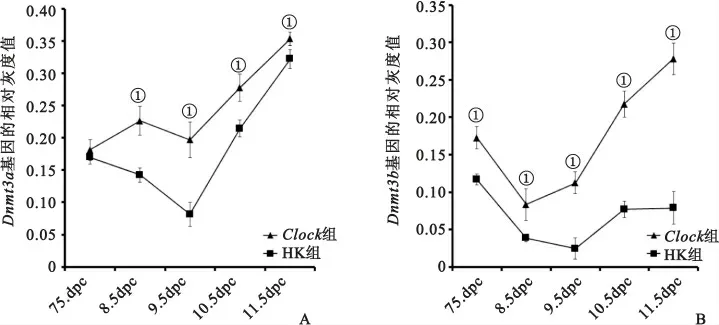
图2 甲基转移酶Dnmt3a和Dnmt3b在RNA水平的表达变化Figure 2 Expression changes of methyltransferase Dnmt3aand Dnmt3bat RNA level
本实验通过人工授精技术在动物体外得到了二细胞受精卵,以RNAi干扰技术下调其Clock 基因的表达,再将其培育到囊胚并移植到假孕受体雌鼠体内。我们对收获的7.5~11.5dpc的小鼠胚胎整体进行基因组DNA 甲基化水平的检测,结果发现Clock干扰组胚胎的甲基化水平显著高于对照组(P <0.05)。这就说明二细胞受精卵中的Clock 基因对于小鼠胚胎的早期甲基化是具有影响的。DNA 甲基化就是一个将甲基团共价结合到哺乳动物基因组CpG位点上的胞嘧啶残基上的过程。这个过程需要一组被称为DNA 甲基转移酶(Dnmts)的酶类参与[24]。由于哺乳动物催化发育过程中去甲基化的CpG 位点重新甲基化的主要甲基转移酶是Dnmt3a 和Dnmt3b[20],所以我们又用PCR 检测了这些胚胎中Dnmt3a和Dnmt3b的RNA 表达水平。结果发现,这两种酶的变化与其DNA 甲基化水平的变化具有相似性,且也是Clock 组显著高于对照组(P<0.05)。因此,我们认为二细胞受精卵中Clock 基因可以通过调节甲基转移酶Dnmt3a和Dnmt3b对小鼠早期胚胎基因组DNA 甲基化水平造成影响,它们之间具体的作用机制仍需要进一步研究。
4 结论
在本实验中,我们利用RNAi技术干扰了小鼠二细胞受精卵中Clock 基因的表达,并成功将这些处理后的受精卵移植到假孕雌鼠子宫内,从而得到了由这些受精卵发育而来的各胚龄(7.5~11.5dpc)小鼠胚胎。对这些胚胎基因组DNA 甲基化水平和甲基转移酶的检测结果显示,Clock干扰组无论是基因组DNA甲基化水平还是甲基转移酶Dnmt3a、Dnmt3b的表达量均较对照组高。由此我们认为,受精卵中Clock 基因表达的下调可以使得甲基转移酶Dnmt3a和Dnmt3b的表达量增加,进而导致其早期胚胎(7.5~11.5dpc)基因组DNA 甲基化水平上升。
[1]Fischle W,Wang Y,Allis C D.Histone and chromatin crosstalk[J].Current opinion in cell biology,2003,15(2):172-83.
[2]Kikuchi H,Barman H K,Nakayama M,et al.Participation of histones,histone modifying enzymes and histone chaperones in vertebrate cell functions[J].Sub-cellular biochemistry,2006,40:225-243.
[3]Klose R J,Bird AP.Genomic DNA methylation:the mark and its mediators[J].Trends in biochemical sciences,2006,31(2):89-97.
[4]Bird AP,Wolffe AP.Methylation-induced repression--belts,braces,and chromatin[J].Cell,1999,99(5):451-454.
[5]Goldberg AD,Allis CD,Bernstein E.Epigenetics:a landscape takes shape[J].Cell,2007,128(4):635-638.
[6]Ko CH,Takahashi JS.Molecular components of the mammalian circadian clock[J].Hum Mol Genet,2006,15(2):271-277.
[7]Young MW,Kay SA.Time zones:a comparative genetics of circadian clocks[J].Nature reviews Genetics,2001,2(9):702-715.
[8]Brown SE,Fraga MF,Weaver IC,et al.Variations in DNA methylation patterns during the cell cycle of HeLa cells[J].Epigenetics :official journal of the DNA Methylation Society,2007,2(1):54-65.
[9]Merrow M,Roenneberg T.Cellular clocks:coupled circadian and cell division cycles[J].Current biology:CB,2004,14(1):25-26.
[10]Nagoshi E,Saini C,Bauer C,et al.Circadian gene expression in individual fibroblasts:cell-autonomous and self-sustained oscillators pass time to daughter cells[J].Cell,2004,119(5):693-705.
[11]Reik W.Stability and flexibility of epigenetic gene regulation in mammalian development[J].Nature,2007,447(7143):425-432.
[12]Howlett SK,Reik W.Methylation levels of maternal and paternal genomes during preimplantation development[J].Development,1991,113(1):119-127.
[13]Olek A,Walter J.The pre-implantation ontogeny of the H19 methylation imprint[J].Nature genetics,1997,17(3):275-276.
[14]Okano M,Bell DW,Haber DA,et al.DNA methyltransferases Dnmt3aand Dnmt3bare essential for de novo methylation and mammalian development[J].Cell,1999,99(3):247-257.
[15]Movassagh M,Choy MK,Goddard M,et al.Differential DNA methylation correlates with differential expression of angiogenic factors in human heart failure [J].PloS one,2010,5(1):e8564.
[16]Takahashi K,Tanabe K,Ohnuki M,et al.Induction of pluri-potent stem cells from adult human fibroblasts by defined factors[J].Cell,2007,131(5):861-872.
[17]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[18]Ueda Y,Okano M,Williams C,et al.Roles for Dnmt3bin mammalian development:a mouse model for the ICF syndrome[J].Development,2006,133(6):1183-1192.
[19]Liang X,Cheng S,JIANG X,et al.The noncircadian function of the circadian Clock gene in the regulation of male fertility[J].J Biol Rhythms,2013,28(3):208-217.
[20]Geiman TM,Muegge K.DNA methylation in early development[J].Mol Reprod Dev,2010,77(2):105-113.
[21]Shahrzad S,Bertrand K,Minhas K,et al.Induction of DNA hypomethylation by tumor hypoxia [J].Epigenetics:official journal of the DNA Methylation Society,2007,2(2):119-125.
[22]Watson JA,Watson CJ,Mccrohan AM,et al.Generation of an epigenetic signature by chronic hypoxia in prostate cells[J].Human molecular genetics,2009,18(19):3594-3604.
[23]Waterland RA,Michels KB.Epigenetic epidemiology of the developmental origins hypothesis[J].Annual review of nutrition,2007,27:363-388.
[24]Gopalakrishnan S,Van Emburgh BO,Robertson KD.DNA methylation in development and human disease[J].Mutation research,2008,647(1-2):30-38.
