TLR4在慢性支气管炎大鼠气道粘液高分泌中的作用及多粘菌素B干预的影响*
2015-02-09万宁张建勇唐凤鸣李永春张健陈德
万宁 张建勇 唐凤鸣 李永春 张健 陈德
(1.宜宾市第一人民医院呼吸内科,四川 宜宾 644000;2.遵义医学院附属医院呼吸二科,贵州 遵义 563000)
气道粘液高分泌是慢性气道疾病的重要特征,气道粘液高分泌的确切发生机制及其调控目前尚不十分清楚。气道粘液高分泌的分子基础是气道主要粘蛋白(Muc)5AC的产生和分泌增加[1],而细菌感染是慢性气道疾病发生发展或反复加重的重要因素,其中G-菌是其最主要的致病菌之一,而脂多糖(LPS)则是G-菌感染的主要致病因子。本实验探讨Toll样受体4(TLR4)信号转导通路在细菌LPS诱导大鼠慢性支气管炎气道粘蛋白表达中的作用,将有助于阐明G-菌感染引起气道粘液高分泌发生的分子机制,对慢性气道疾病气道粘液高分泌的防治可能有重要意义,并可能为气道粘液高分泌的药物干预治疗提供新的思路。
1 材料与方法
1.1 慢性支气管炎模型建立与分组 SPF 级6~8周龄雄性Wistar大鼠40只(购自重庆第三军医大学大坪医院实验动物中心),体重220~240g,随机分为正常对照组(NS组)、慢性支气管炎组(LPS组)、多粘菌素B(PMB)干预组(LPS+PMB 组)和多粘菌素B自身对照组(PMB组)各10只。参考Nie YC 等[2]方法并作改进,建立大鼠慢性支气管炎模型:第1 天气管内注入脂多糖(LPS)200μg/200μl(E.coli 055:B5,美国Sigma 公司)后,每天在自制玻璃箱(50cm×50cm×40cm)内雾化吸入(德国百瑞压缩吸入器,型号:085G1005)LPS溶液(50μg/ml)1小时,连续3周。NS组用NS代替LPS;LPS+P MB 组除建立大鼠慢性支气管炎模型外,于每日雾化吸入前1小时给予腹腔注射PMB(美国Amresco)1mg/kg干预;PMB 组除同NS组外,于每日雾化吸入前1小时给予腹腔注射PMB 1mg/kg。
1.2 肺组织标本和支气管肺泡灌洗液制备 大鼠持续雾化吸入3 周后处死,取右上、中叶肺组织迅速放入-80℃冰箱保存,以备RNA 提取。取右下叶肺组织放入4%多聚甲醛中固定。左肺行支气管肺泡灌洗[3]获得支气管肺泡灌洗液(BALF)做细胞计数、白细胞分类和肿瘤坏死因子-α(TNF-α)测定。
1.3 ELISA 测 定BALF 细胞因子TNF-α 采 用ELISA 双抗体夹心法,按试剂盒(上海森雄科技实业有限公司)说明书检测BALF中TNF-α含量,酶标仪(ELX800,美国)在492nm 处测吸光度。所有光密度(OD)值都减除空白值后再行计算,以标准品之OD 值在半对数纸上作图,画出标准曲线,根据样品OD 值在该曲线上查出相应的含量。
1.4 AB-PAS染色 肺组织石蜡切片,常规脱蜡至水,做阿先蓝-过碘酸雪夫(AB-PAS)染色,进行图片采集和相对着色面积的定量分析。
1.5 免疫组化法检测气道Muc5AC 和肺组织TLR4的表达 均采用二步法,Muc5AC 一抗为小鼠抗Muc5AC单克隆抗体(SANTA 公司),鼠抗-Muc5AC抗体二步法试剂盒(北京中杉金桥生物公司)。TLR4一抗为羊抗大鼠TLR4多克隆抗体(美国Santa Crue公司),羊抗-TLR4抗体二步法试剂盒(北京中杉金桥生物公司)。均按试剂盒说明进行操作,以积分光密度(IOD)为指标进行定量分析。
1.6 荧光定量RT-PCR 检测肺组 织Muc5AC 和TLR4 mRNA 表达 采用RNAiso Reagent 试剂(TaKaRa公司)说明书提取各组大鼠肺组织总RNA,取0.5μg RNA 逆转录(逆转录试剂盒购自TaKaRa公司,DRR037S),按试剂盒说明书合成cDNA。Muc5AC、TLR4及内参照β-actin 的引物由TaKaRa公司设计合成,其序列见表1。按PCR 反应试剂盒(TaKaRa 公 司,DRR041S)说明书进 行PCR 反 应(ICycler iQ 荧光定量PCR 仪,美国BIO-RAD 公司),反应条件为:95℃10s,95℃5s,62℃20s,共40个循环。每一例样本反应结束后由计算机自动计算并读出定量结果Ct值(threshold cycle)。
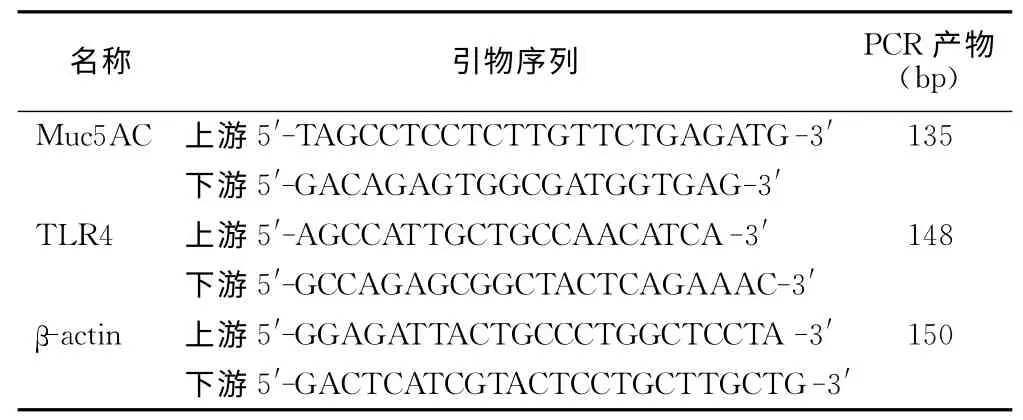
表1 Muc5AC、TLR4、β-actin引物序列Table 1 Primer sequence of Muc5AC,TLR4,β-actin
1.7 统计学分析 荧光定量RT-PCR 获取的Ct值采用2-△△Ct法进行相对定量,实验数据用表示,采用SPSS 13.0软件进行统计分析,组间均数比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 HE染色结果 NS组和PMB 组大鼠支气管管壁及其周围组织结构完整而清晰,未见或偶见很少量炎性细胞。LPS组见支气管上皮细胞损伤脱落,杯状细胞明显增多,支气管壁及其周围组织和肺泡以中性粒细胞和巨噬细胞为主的大量炎性细胞浸润,炎症细胞浸润明显处可见管壁平滑肌束断裂,排列紊乱,管腔狭窄。与LPS 组比较,LPS+PMB 组大鼠上述病变明显减轻。
2.2 BALF 细胞计数和白细胞分类 NS组和PMB组大鼠BALF中白细胞总数和细胞分类差异无显著性(P>0.05),主要以巨噬细胞为主;LPS组BALF中白细胞总数、中性粒细胞、巨噬细胞、淋巴细胞均较NS组明显增多,差异有显著性(均P<0.01);LPS+PMB组BALF中细胞总数、中性粒细胞、巨噬细胞、淋巴细胞与LPS组比较明显减少(均P<0.01),而较NS组有所增加。
2.3 BALF 细胞因子TNF-α 水平测定 NS 组 和PMB组BALF 中TNF-α 水平差异无显著性(P>0.05);LPS组、LPS+PMB 组BALF 中TNF-α水平较NS组明显增高,差异有显著性(P<0.01);LPS+PMB组增高值较LPS 组低,差异亦有显著性(P<0.01),见表2。
表2 各组大鼠BALF中TNF-α的变化()Table 2 The levels of TNF-αin BALF

表2 各组大鼠BALF中TNF-α的变化()Table 2 The levels of TNF-αin BALF
注:与NS组比较,①P<0.01;与LPS组比较,②P<0.01
2.4 气道AB-PAS染色 NS组和PMB组气道粘液物质染色差异无显著性(P>0.05);LPS 组、LPS+PMB组气道粘液物质相对着色面积较NS组明显增高,差异有显著性(P<0.01);LPS+PMB组增高值较LPS组低,差异亦有显著性(P<0.01)。
2.5 气道Muc5AC和肺组织TLR4表达水平测定Muc5AC表达于支气管管腔内,其余肺组织未见表达。NS组和PMB组Muc5AC表达低,且二者间差异无显著性(P>0.05);LPS 组可见大量Muc5AC 表达,其IOD 值明显高于NS 组,差异有显著性(P<0.01);LPS+PMB组Muc5AC表达量较LPS组明显减低,但仍高于NS 组,差异亦有显著性(均P <0.01),见表3、图1~4。TLR4主要表达于支气管上皮、肺泡、血管壁等,均为膜表达。TLR4在NS组和PMB组表达均低,差异无显著性(P>0.05);LPS组可见大量TLR4表达,其IOD 值明显高于NS组,组间差异有显著性(P<0.01);LPS+PMB 组表达量较LPS组明显减低(P<0.01),但仍高于NS 组(P<0.05),见表3、图5~8。
表3 各组大鼠气道Muc5AC和肺组织TLR4的表达()Table 3 The expressions of Muc5AC and TLR4in lung tissue of rats
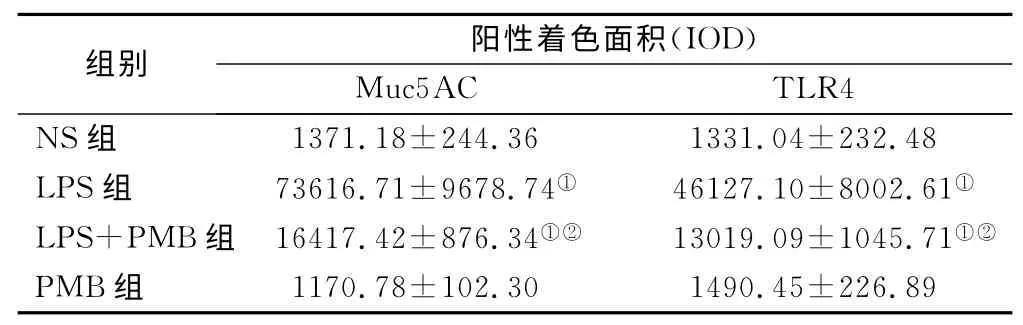
表3 各组大鼠气道Muc5AC和肺组织TLR4的表达()Table 3 The expressions of Muc5AC and TLR4in lung tissue of rats
注:与NS组比较,①P<0.01;与LPS组比较,②P<0.01
2.6 肺组织Muc5AC 和TLR4 mRNA 表达水平测定 NS 组和PMB 组大鼠气道粘蛋白Muc5AC mRNA表达量低,且二者间差异无显著性(P>0.05);LPS组较NS 组表达明显增高,差异有显著性(P<0.05),LPS+PMB 组表达量亦增高,但低于LPS 组(P<0.05)。TLR4mRNA 在NS 组 和PMB 组大鼠肺组织表达量低,但二者间差异无显著性(P>0.05);LPS组较NS组明显增高,差异有显著性(P<0.05);LPS+PMB 组表达量亦增高,但低于LPS 组(P<0.05),见表4。
表4 大鼠肺组织Muc5AC和TLR4mRNA表达()Table 4 The mRNA expressions of Muc5AC and TLR4in lung tissue of rats
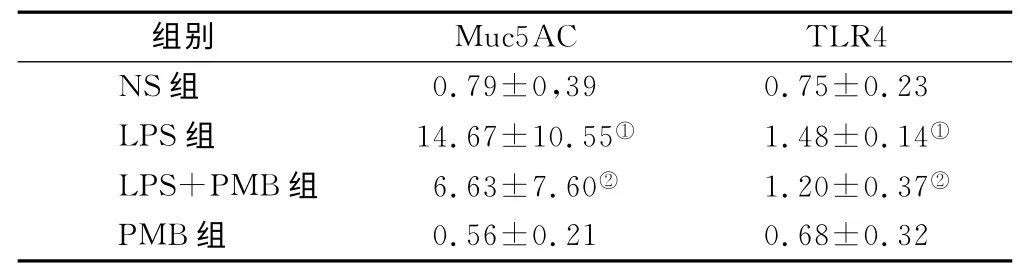
表4 大鼠肺组织Muc5AC和TLR4mRNA表达()Table 4 The mRNA expressions of Muc5AC and TLR4in lung tissue of rats
注:与NS组比较,①P<0.05;与LPS组比较,②P<0.05
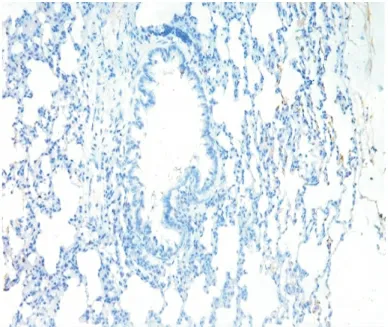
图1 NS组气道Muc5AC表达(IHC×200)Figure 1 The expression of Muc5AC in NS group
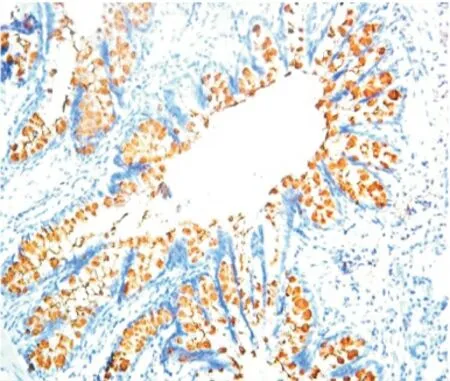
图2 LPS组气道Muc5AC表达(IHC×200)Figure 2 The expression of Muc5AC in LPS group
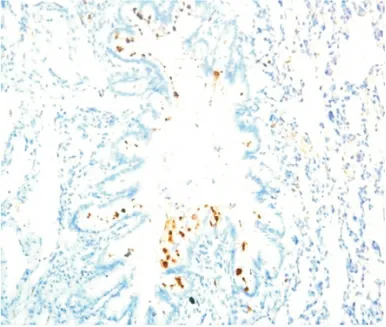
图3 LPS+PMB组气道Muc5AC表达(IHC×200)Figure 3 The expression of Muc5AC in LPS+PMB group
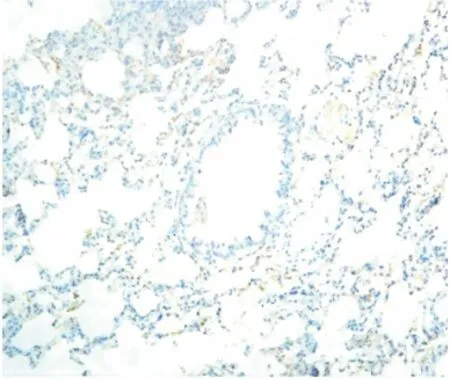
图4 PMB组气道Muc5AC表达(IHC×200)Figure 4 The expression of Muc5AC in PMB group
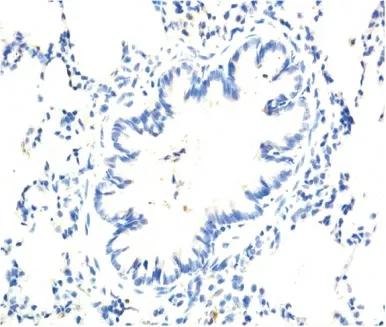
图5 NS组肺TLR4表达(IHC×400)Figure 5 The expression of TLR4in NS group
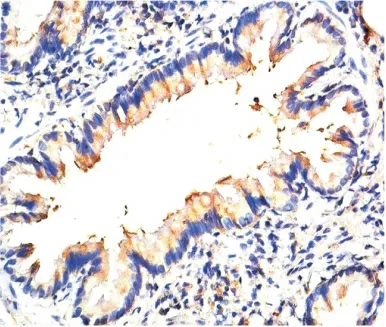
图6 LPS组肺TLR4表达(IHC×400)Figure 6 The expression of TLR4in LPS group
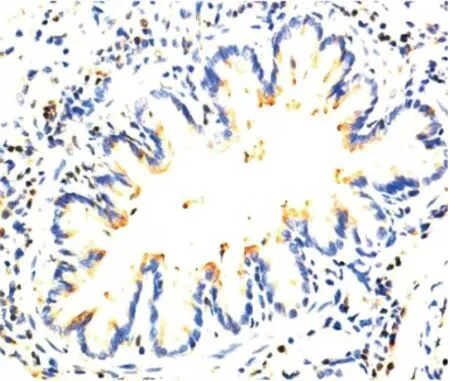
图7 LPS+PMB组肺TLR4表达(IHC×400)Figure 7 The expression of TLR4in LPS+PMB group
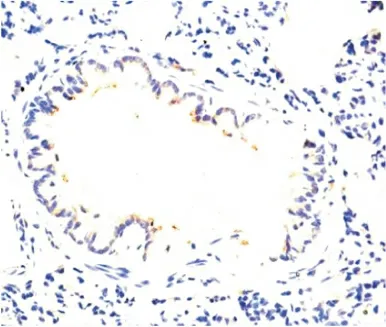
图8 PMB组肺TLR4表达(IHC×400)Figure 8 The expression of TLR4in PMB group
3 讨论
目前认为气道粘液高分泌已成为影响慢性气道疾病,如慢性阻塞性肺疾病、支气管哮喘及囊性纤维化等病情和预后的独立危险因素[4]。粘蛋白是气道粘液的最主要成分。以往的研究显示,病理情况下气道Muc以Muc5AC占优势,故气道上皮Muc5AC 的含量和Muc5AC的转录水平代表气道粘液产生分泌的强度[5]。
TLR 为一类被某些内源性分子和微生物保守性分子成分所激活的模式识别受体(pattern recognition receptors,PRRs),因其胞外段与果蝇蛋白Toll同源而得名,在免疫应答和炎性反应中发挥重要作用。目前已发现的TLR 家族蛋白有10 种,分别命名为TLR1~10,TLR4是G-菌LPS的主要受体[6]。研究表明,人类气道上皮细胞存在TLR,其中TLR4主要分布于细胞基底膜[7]。在LPS刺激下,可使TLR 激活并通过TLRs信号通路介导多种生物学效应[8]。
细菌感染是气道炎症反应和粘液高分泌发生发展的重要因素,G-菌是呼吸道感染最重要的致病菌,LPS是决定G-细菌致病力的关键毒素。在LPS刺激下,气道上皮细胞的TLR 水平升高,Xu Y 等[9]用RT-PCR 及免疫组化证实,主要是TLR4上调。Pera T 等[10]发现,LPS可诱使豚鼠气道上皮粘蛋白分泌增多和杯状细胞化生。本研究中我们使用大肠杆菌LPS,向SPF级大鼠气管内一次注入LPS和持续LPS雾化吸入3周,成功建立了LPS致大鼠慢性支气管炎和气道粘液高分泌模型。结果显示,LPS组病理学改变为支气管上皮细胞损伤脱落,杯状细胞明显增多,支气管壁及其周围组织和肺泡有以中性粒细胞和巨噬细胞为主的大量炎性细胞浸润,可见管壁平滑肌束断裂,排列紊乱,管腔狭窄。LPS组BALF 中白细胞总数、中性粒细胞、巨噬细胞、淋巴细胞、TNF-α水平均较NS组明显增多。LPS组在AB-PAS气道粘液物质相对着色面积和免疫组化检测肺组织Muc5AC、TLR4 的IOD 值均较NS 组明显增 高。LPS 组Muc5AC mRNA、TLR4mRNA 表达均较NS 组明显增高。
PMB是一种阳离子性环状10缩氨酸结构,是由多粘杆菌产生的一组化学上相关的脂酰基缩氨酸抗生素的总称。这种两性分子试剂含有疏脂和亲脂性集团,一个多肽尾(以脂肪酸终止),与LPS的脂质A部分具有高度的亲和力,能吸附除去介质中的LPS,并能破坏G-菌外层或细胞质膜的通透性,具有抗菌和灭活LPS的作用,使LPS介导的信号转导通路中断。本研究结果显示,LPS+PMB 组病理学改变较LPS组明显减轻,在BALF中白细胞总数及其细胞分类、TNF-α水平均较LPS组明显减少,但高于NS组。且其AB-PAS气道粘液物质相对着色面积和免疫组化检测肺组织Muc5AC、TLR4的IOD 值均较LPS组明显减低,但仍高于NS 组。同时LPS+PMB 组Muc5AC mRNA、TLR4mRNA 表达量增高,但均低于LPS组,与国外学者研究结果一致。
4 结论
通过本研究结果可以推测,TLR4信号通路介导的细菌LPS作用与气道粘蛋白Muc5AC 的产生及其高表达之间可能存在必然联系。PMB通过对抗LPS,可能抑制气道Muc5AC、TLR4蛋白及Muc5ACmRNA、TLR4mRNA 表达。
[1]Ryan A,Smith A,Moore P,et al.Expression and Characterization of a Novel Recombinant Version of the Secreted Human Mucin MUC5AC inAirway Cell Lines[J].Biochemistry,2015,54(4):1089-1099.
[2]Nie YC,Wu H,Li PB,et al.Characteristic comparison of three rat models induced by cigarette smoke or combined with LPS:to establish a suitable model for study of airway mucus hypersecretion in chronic obstructive pulmonary disease[J].Pulm Pharmacol Ther,2012,25(5):349-356.
[3]Mizuguchi Y,Myojo T,Oyabu T,et al.Comparison of doseresponse relations between 4-week inhalation and intratracheal instillation of NiO nanoparticles using polimorphonuclear neutrophils in bronchoalveolar lavage fluid as a biomarker of pulmonary nflammation[J].Inhal Toxicol,2013,5(1):29-36.
[4]Rubin BK.Secretion properties,clearance,and therapy in airway disease[J].Transl Respir Med,2014,10(3):2-6.
[5]Xu R,Li Q,Zhou X,et al.Annexin II mediates the neutrophil elastase-stimulated exocytosis of mucin 5ac[J].Mol Med Rep,2014,9(1):299-304.
[6]Płóciennikowska A,Hromada-Judycka A,Borzęcka K,et al.Cooperation of TLR4and raft proteins in LPS-induced pro-inflammatory signaling[J].Cell Mol Life Sci,2015,72(3):557-581.
[7]Yin Y,Hou G,LiER,et al.Regulation of cigarette smoke-induced toll-like receptor 4expression by peroxisome proliferatoractivated receptor-gamma agonists in bronchial epithelial cells[J].Respirology.2013,18(3):30-39.
[8]Guijarro-Muñoz I,Compte M,Álvarez-Cienfuegos A,et al.Lipopolysaccharide activates Toll-like receptor 4(TLR4)-mediated NF-κB signaling pathway and proinflammatoryresp onse in human pericytes[J].J Biol Chem,2014,289(4):2457-2468.
[9]Xu Y,Zhang Y,Cardell LO.Nicotine exaggerates LPS-induced airway hyperreactivity via JNK-mediated up-regulation of Toll-like receptor 4[J].Am J Respir Cell Mol Biol,2014,51(3):370-379.
[10]Pera T,Zuidhof AB,Smit M,et al.Arginase inhibition prevents inflammation and remodeling in a guinea pig model of chronic obstructive pulmonary disease[J].J Pharmacol Exp Ther,2014,349(2):229-238.
