卷烟烟气总粒相物诱导A549 细胞的氧化应激研究
2015-02-08张世敏谢复炜谢剑平
张世敏,李 翔,谢复炜,谢剑平
中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2 号 450001
卷烟烟气是一种复杂的混合物,已报道的化学成分超过8 000 种,并且部分化学成分显示出一定的氧化性[1-4]。当细胞或组织暴露在卷烟烟气中时,细胞体系的氧化/抗氧化平衡被打破,细胞产生氧化应激以及炎症反应,并最终导致机体产生病理性损伤[5-6]。流行病学研究表明,吸烟可能与呼吸系统相关疾病的发生有关,如COPD(慢性阻塞性肺病)、肺癌、动脉硬化等[7-8]。有研究表明,吸烟导致这些疾病的主要机理是氧化应激。当细胞发生氧化应激时,细胞内活性氧族(ROS)以及活性氮族(RON)增加,对脂质、蛋白质以及DNA 等会产生不同程度的氧化损伤[9-11],同时激活细胞内抗氧化物质如细胞外超氧化物歧化酶(EC-SOD)、还原态谷胱甘肽(GSH)、过氧化氢酶等[12]。在这些抗氧化物中,GSH 和EC-SOD 分别在细胞内和细胞外发挥重要的抗氧化作用[13-14]。GSH 是细胞内含量丰富的硫醇式缩氨酸,对维持细胞氧化还原平衡发挥重要作用,被广泛作为细胞氧化应激标志物[12,14];EC-SOD 作为细胞抗氧化反应的第一道防线,主要在细胞外基质中对ROS和RON 进行首次催化分解,进而发挥重要的抗氧化作用[13,15-16]。在以往研究中,卷烟烟气的体外毒理学评价研究主要集中在细胞毒性和遗传毒性等方面[17-20]。有关烟气氧化损伤的生物效应研究也有部分报道。Tollefson 等[21]发现EC-SOD 对卷烟烟气萃取物诱导的肺泡巨噬细胞的氧化应激反应具有明显保护作用;米娜等[22]在研究卷烟烟气萃取物对线粒体的氧化损伤时,检测到卷烟烟气萃取物染毒后的支气管上皮细胞内GSH 显著降低;Kaushik 等[23]发现卷烟烟气萃取物通过干扰细胞氧化还原平衡来调节细胞增殖,该过程与细胞内还原态谷胱甘肽与氧化态谷胱甘肽比值(GSH/GSSG)的水平紧密相关。有研究表明,EC-SOD等氧化应激指标的表达在不同暴露时间下会表现出一定程度的差异[1,24]。在本研究中,拟选取GSH和EC-SOD 作为卷烟烟气诱导细胞发生氧化应激反应的生物标志物,通过检测卷烟烟气总粒相物(TPM)在不同染毒时间下GSH/GSSG 和EC-SOD水平的变化,分别从胞内和胞外水平研究TPM 诱导的细胞氧化损伤,旨在为卷烟烟气诱导的氧化应激研究提供科学依据和参考。
1 材料与方法
1.1 材料、试剂与仪器
3R4F 参比卷烟(美国肯塔基大学);人肺腺癌细胞A549(中国上海生科院细胞资源中心)。
RPMI-1640 基础培养基、L-谷氨酰胺(纯度99.9%)(北京Solarbio 公司);中性红染料(纯度99.0%,美国Sigma公司);胎牛血清(生化级,美国Gibco公司);胰酶(500 U/mg,美国Amresco 公司);氯化钾、磷酸二氢钾、氯化钠、七水合磷酸氢二钠、无水乙醇、冰醋酸(AR,天津凯通化学试剂有限公司);二甲基亚砜(DMSO,生化级,美国Amresco 公司);GSH/GSSG ELISA 试剂盒(美国ScienCell 公司);Cu/Zn-SOD ELISA 试剂盒(美国eBioscience 公司)。
HERA Cell 240 CO2细胞培养箱、HFU486 超低温冰箱(德国Thermo 公司);Sigma 1-14 微型高速离心机、Sigma 3-18K 低温高速离心机(德国Sigma 公司);SW-CJ-2FD 超净工作台(苏州安泰空气技术有限公司);SPECTRA MAX 190 酶标仪(日本Bio-Rad 公司);6 孔板、96 孔板(美国Corning Costar 公司);TH 4-200 荧光倒置显微镜(日本Olympus 公司);1 和5 mL 微量移液器(德国Eppendorf 公司);RM20H 转盘型吸烟机(德国Borgwaldt KC 公司);Milli-Q 超纯水纯化系统(美国Millipore 公司);TS-2 脱色摇床(北京中仪所);DQHZ-2001A 大容量全温度摇床(江苏太仓华美生化仪器厂)。
1.2 方法
1.2.1 TPM 制备
将3R4F 参比卷烟于(22±1)℃,相对湿度(60±3)%条件下平衡48 h;按照标准(ISO 4387:2000)抽吸模式,在RM20H 转盘型吸烟机上抽吸20 支卷烟,用92 mm 的剑桥滤片捕集TPM;将剑桥滤片置于50 mL 锥形瓶中,根据捕集的TPM 质量,加入适量DMSO,使TPM 终浓度为10 mg/mL(母液),然后放置在摇床上于室温下振荡萃取20 min,过滤,分装冻存,备用。
1.2.2 细胞培养
将A549 细胞于含10%(体积分数)胎牛血清的RPMI-1640 培养基中培养,待细胞生长汇合度达到80%后,用0.25%(体积分数)胰酶消化,离心,弃去上清液;加入新鲜的培养基制成细胞悬液,以1.5×104个/孔的细胞密度接种于96 孔板,于37 ℃,5%CO2培养箱内孵育24 h;移去培养基,实验组分别加入10、25、50、75、100、120、140、160 和200 μg/mL TPM 溶液,阴性对照组加入20 μL/mL DMSO溶液,于37 ℃,5%CO2培养箱内孵育24 h,之后进行中性红细胞毒性试验。
将A549 细胞以4.5×105个/孔的细胞密度接种于6 孔板,置于37 ℃,5%CO2培养箱内孵育24 h;移去培养基,实验组分别加入75 和100 μg/mL TPM 溶 液,阴性对照组加入10 μL/mL DMSO 溶液,置于37 ℃,5% CO2的培养箱内分别孵育4 和24 h,之后进行氧化应激指标GSH/GSSG 和EC-SOD 的检测。
1.2.3 中性红细胞毒性试验
移去96 孔板内培养基,用PBS 洗涤;加入中性红染液(质量浓度50 μg/mL),于37 ℃,5%CO2的培养箱内孵育3 h;移去孔内染液,用PBS 洗涤;加入中性红萃取液(50%乙醇,49%去离子水,1%冰醋酸),振荡萃取20~30 min,于酶标仪540 nm 下检测吸光度。
1.2.4 氧化应激指标检测
(1)GSH/GSSG 检测。6 孔板内的细胞经75 μg/mL 或100 μg/mL TPM 染毒4 或24 h 后,收集孔内培养基,离心后,取上清液,分装并于-80 ℃冻存备用。孔内细胞用0.25%胰酶消化,收获细胞。参照ScienCellTMGSH/GSSG ELISA 试剂盒说明书进行操作,即:细胞经细胞裂解液重悬,冰上放置5 min 后,于4 ℃、10 000 g 条件下离心10 min,收集上清液;将上清液分为两份,并以50 μL/孔加入到96 孔板内,其中一份样品孔加入1 μL 清除剂静置1 min,用于检测GSSG,另一份没有添加清除剂的样品孔用于检测全部的GSH;所有检测样均加入150 μL 工作液,静置2 min,并以50 μL/孔加入辅酶NADPH 稀释溶液。用酶标仪在412 nm 下检测吸光度。
(2)EC-SOD 检测。收集的培养基上清液样品,参照Cu/Zn-SOD ELISA 试剂盒说明书进行检测,即:将抗体包被板先用洗涤液清洗2 次,然后每孔加入100 μL 样品,并以50 μL/孔用量加入现配的辣根过氧化酶同源物稀释剂,密封后室温下振荡1 h;洗涤液清洗3 次,以100 μL/孔用量加入基质溶液,室温下避光振荡10 min;立即以100 μL/孔用量加入终止液,并放入酶标仪中检测450 nm 下的吸光度。
1.2.5 数据统计分析
用Origin 8.1 和SPSS 软件对实验数据进行处理。数据用±SD 表示,P<0.05 为显著性差异,P<0.01 为极显著性差异。
2 结果与分析
2.1 TPM 与细胞存活率的剂量-效应关系
采用中性红摄取试验检测3R4F 参比卷烟主流烟气TPM 对A549 细胞的细胞毒性效应,共进行4 次独立实验,每次独立实验设置6 个重复。结果(图1)显示,随着TPM 浓度的增加,TPM 与A549细胞存活率之间存在良好的剂量-效应关系。
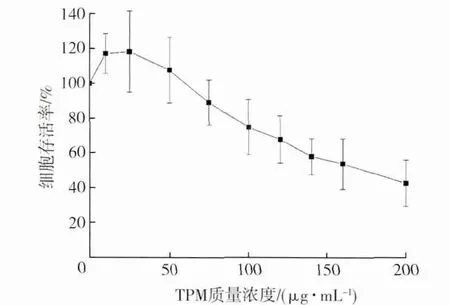
图1 3R4F 参比卷烟TPM 与细胞存活率的剂量-效应关系
2.2 TPM 诱导的细胞氧化应激
为进一步研究由卷烟烟气TPM 诱导的细胞氧化应激,选择细胞存活率70%以上的TPM 剂量进行染毒,即染毒剂量为75 和100 μg/mL,对应的细胞存活率分别为(89.1±13.0)%和(74.7±15.9)%。
2.2.1 TPM 对细胞内GSH 代谢的影响
分别进行了3 次独立实验,结果(图2)显示,在选定的TPM 染毒剂量(75 和100 μg/mL)下,采用相同的染毒时间,实验组的GSH/GSSG 明显低于阴性对照组(P<0.01)。同时,在相同的染毒剂量下,GSH/GSSG 在染毒4 与24 h 的实验组之间不存在显著性差异。表明在TPM 短时间染毒(4 h)和长时间染毒(24 h)下,细胞均发生了氧化应激,与文献研究结果相一致[1]。原因可能是细胞内氧化性物质的过量表达增加了GSH 氧化生成GSSG的速率,使GSH 浓度急剧降低,GSSG 不断积累,最终导致GSH/GSSG 相对阴性对照组有明显降低[14]。但Colombo 等[25]在研究烟气对人牙龈纤维母细胞的氧化损伤时,根据质谱分析结果认为,烟气暴露后GSH 的明显减少和GSSG 的微量增加归因于GSH 的烷基化。此外,也有文献报道,GSH/GSSG的降低也可能与GSH 合成过程中的限速酶(γ-谷氨酰半胱氨酸合成酶)被氧化并导致GSH 合成受限制有关[26-27]。
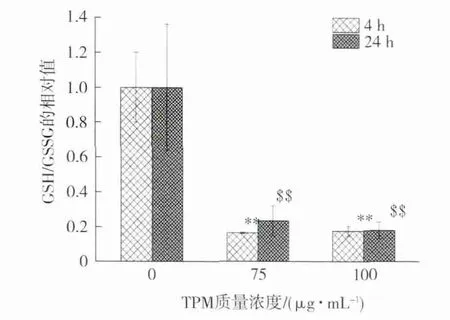
图2 TPM 诱导的A549 细胞GSH/GSSG 变化
2.2.2 TPM 对EC-SOD 表达的影响
EC-SOD 是超氧化物歧化酶(SOD)在细胞外的主要存在形式,也是细胞首要的自由基清除剂。通过3 次独立实验对TPM 染毒A549 细胞后的EC-SOD 进行了测定,结果(图3)显示,在用TPM 短时间染毒(4 h)条件下,实验组EC-SOD相对于阴性对照组没有明显增加。但随着染毒时间的延长(24 h),实验组EC-SOD 极显著地高于阴性对照组(P<0.01),并且低剂量组(75 μg/mL)与高剂量组(100 μg/mL)也呈现极显著性差异(P<0.01);此外,用相同剂量的TPM 染毒时,24 h 染毒组的EC-SOD 水平也极显著地高于4 h染毒组(P<0.01)。原因可能是卷烟烟气诱导细胞SOD 表达之前,细胞本身需要产生大量的活性氧以及超氧阴离子,而该过程需要一定的反应时间才能实现,因此进行较短时间的染毒并不能明显地观察到EC-SOD 表达量的增加[24]。据文献报道,卷烟烟气首先使细胞内神经酰胺积累,达到一定浓度后会诱导SOD 的表达[12,28]。可见,外源性物质在诱导EC-SOD 表达时需要一定的反应时间。
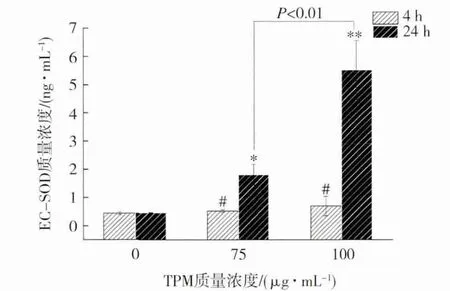
图3 TPM 诱导的A549 细 胞EC-SOD 变化
3 结论
①在TPM 分别染毒4 h 和24 h 后,A549 细 胞内GSH/GSSG 相对阴性对照组显著降低,且在TPM 染毒24 h 后GSH/GSSG 相对于4 h 染毒组无明显增加,表明在本实验条件下增加TPM 染毒时间对GSH/GSSG 无显著性影响。②在TPM 染毒时间从4 h 增加到24 h 时,EC-SOD 显著增加,并且随TPM 染毒剂量的增加而增加,表明TPM 染毒时间对细胞外EC-SOD 的表达有一定的影响。
[1]Kode A,Yang S R,Rahman I.Differential effects of cigarette smoke on oxidative stress and proinflammatory cytokine release in primary human airway epithelial cells and in a variety of transformed alveolar epithelial cells[J].Respiratory Research,2006,7:132.
[2]Bishop E,Theophilus E H,Fearon I M.In vitro and clinical studies examining the expression of osteopontin in cigarette smoke-exposed endothelial cells and cigarette smokers[J].BMC Cardiovasc Disorders,2012,12(1):75.
[3]Pryor W A,Stone K.Oxidants in cigarette smoke radicals,hydrogen peroxide,peroxynitrate,and peroxynitrite[J].Annals of the New York Academy of Sciences,1993,686(1):12-27.
[4]Putnam K P,Bombick D W,Doolittle D J.Evaluation of eight in vitro assays for assessing the cytotoxicity of cigarette smoke condensate[J].Toxicology In Vitro,2002,16(5):599-607.
[5]Lannan S,Donaldson K,Brown D,et al.Effect of cigarette smoke and its condensates on alveolar epithelial cell injury in vitro A549[J].The American Journal of Physiology,1994,266(1):L92-L100.
[6]Rovina N,Koutsoukou A,Koulouris N G.Inflammation and immune response in COPD:Where do we stand?[J].Mediators of Inflammation,2013,413735:1-9.
[7]Arja C,Surapaneni K M,Raya P,et al.Oxidative stress and antioxidant enzyme activity in South Indian male smokers with chronic obstructive pulmonary disease[J].Respirology,2013,18(7):1069-1075.
[8]Howard G,Wagenknecht L E,Burke G L,et al.Cigarette smoking and progression of atherosclerosis:The atherosclerosis risk in communities(ARIC)study[J].Journal of the American Medical Association,1998,279(2):119-124.
[9]Faux S P,Tai T,Thorne D,et al.The role of oxidative stress in the biological responses of lung epithelial cells to cigarette smoke[J].Biomarkers,2009,14(S1):90-96.
[10]Rahman I,Van Schadewijk A A,Crowther A J,et al.4-Hydroxy-2-nonenal,a specific lipid peroxidation product,is elevated in lungs of patients with chronic obstructive pulmonary disease[J].American Journal Respiratory and Critical Care Medicine,2002,166(4):490-495.
[11]Leanderson P,Tagesson C.Cigarette smoke-induced DNA-damage:Role of hydroquinone and catechol in the formation of the oxidative DNA-adduct,8-hydroxydeoxyguanosine[J].Chemico-Biological Interactions,1990,75(1):71-81.
[12]Cantin A M.Cellular response to cigarette smoke and oxidants:Adapting to survive[J].Proceedings of the American Thoracic Society,2010,7(6):368-375.
[13]Regan E A,Mazur W,Meoni E,et al.Smoking and COPD increase sputum levels of extracellular superoxide dismutase[J].Free Radical Biology and Medicine,2011,51(3):726-732.
[14]Rahman I,Macnee W.Lung glutathione and oxidative stress:Implications in cigarette smoke-induced airway disease[J].The American Journal of Physiology,1999,277(6):L1067-L1088.
[15]Bowler R P,Crapo J D.Oxidative stress in allergic respiratory diseases[J].Journal of Allergy and Clinical Immunology,2002,110(3):349-356.
[16]Bowler R P,Hokanson J,Taylor M,et al.Extracellular superoxide dismutase(EC-SOD)as a protective factor for risk of chronic obstructive pulmonary disease[J].European Respiratory Review,2006,15(101):200-201.
[17]CHEN Huan,CUI Lin,JIANG Xingyi,et al.Evaluation of the cytotoxicity of cigarette smoke condensate by a cellular impedance biosensor[J].Food and Chemical Toxicology,2012,50(3/4):612-618.
[18]LIN Chunyan,CHEN Li,HUANG Zhihong,et al.Effect of cigarette smoke extraction on the expression of found in inflammatory zone 1 in rat lung epithelial L2 cells[J].Chinese Medical Journal,2014,127(12):2363-2367.
[19]黄波,龙颖,李东阳.卷烟烟气抽提物对细胞遗传毒性及茶多酚干预作用[J].中国公共卫生,2013,29(6):823-825.
[20]卢斌斌,Meng R,Wisse L,等.3 种不同焦油卷烟烟气的细胞毒性比较[J].烟草科技,2007(12):38-41.
[21]Tollefson A K,Oberley-Deegan R E,Butterfield K T,et al.Endogenous enzymes(NOX and ECSOD)regulate smoke-induced oxidative stress[J].Free Radical Biology and Medicine,2010,49(12):1937-1946.
[22]米娜,杨陟华,潘秀颉,等.卷烟烟气对细胞线粒体氧化损伤的研究[J].第三军医大学学报,2008,30(3):257-259.
[23]Kaushik G,Kaushik T,Khanduja S,et al.Cigarette smoke condensate promotes cell proliferation through disturbance in cellular redox homeostasis of transformed lung epithelial type-II cells[J].Cancer Letters,2008,270(1):120-131.
[24]An K W,Shin H S,Choi C Y.Physiological responses and expression of metallothionein(MT)and superoxide dismutase(SOD)mRNAs in olive flounder,Paralichthys olivaceus exposed to benzo[a]pyrene[J].Comparative Biochemistry and Physiology.Part B,2008,149(3):534-539.
[25]Colombo G,Dalle-Donne I,Orioli M,et al.Oxidative damage in human gingival fibroblasts exposed to cigarette smoke[J].Free Radical Biology and Medicine,2012,52(9):1584-1596.
[26]ZOU Xuan,FENG Zhihui,LI Yuan,et al.Stimulation of GSH synthesis to prevent oxidative stress-induced apoptosis by hydroxytyrosol in human retinal pigment epithelial cells:Activation of Nrf2 and JNK-p62/SQSTM1 pathways[J].Journal of Nutritional Biochemisty,2012,23(8):994-1006.
[27]Rahman I,Smith C A D,Lawson M F,et al.Induction of γ-glutamylcysteine synthetase by cigarette smoke is associated with AP-1 in human alveolar epithelial cells[J].FEBS Letters,1996,396(1):21-25.
[28]Natarajan V,Zhen L,Medler T R,et al.Ceramide upregulation causes pulmonary cell apoptosis and emphysema-like disease in mice[J].Nature Medicine,2005,11(5):491-498.
