烟草牻牛儿基牻牛儿基焦磷酸合成酶基因家族的全基因组鉴定
2015-02-08李泽锋夏玉珍武明珠罗朝鹏金立锋林福呈
李泽锋,魏 攀,夏玉珍,王 中,武明珠,王 燃,罗朝鹏,金立锋,杨 军,林福呈,李 锋*
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2 号 450001
2.红塔烟草(集团)有限责任公司技术中心,云南省玉溪市红塔大道118 号 653100
牻牛儿基牻牛儿基焦磷酸合成酶(Geranylgeranyl pyrophosphate synthase,GGPPS)催化异戊烯基二磷酸(Isopentenyl diphosphate,IPP)和法尼基焦磷酸(Farnesyl pyrophosphate,FPP)的缩合反应,形成牻牛儿基牻牛儿基焦磷酸(GGPP)。GGPP 是在植物生长发育过程中具有重要功能的多种萜类化合物的共同前体物,能起到调节“碳流”的作用,还能催化蛋白的异戊二烯化,是植物萜类化合物代谢途径中的一个关键酶[1]。植物中的GGPPS 是由大亚基和小亚基构成的异源二聚体,大亚基具有合成GGPP 的活性,而小亚基没有,但两个亚基结合后活性则明显提高[2]。GGPPS 基因最早是从辣椒中克隆得到[3],之后在其他多种植物中亦被克隆出。近年来,GGPPS 基因在功能研究上取得了一些进展。但在啤酒酵母中GGPPS 基因过表达,会导致β-胡萝卜素含量(质量分数)显著增加[4]。在法夫酵母和卷枝毛霉中,GGPPS 过表达也能显著提高类胡萝卜素产量[5-6]。有研究发现,在渐窄叶烟草中对GGPPS 沉默后,二萜类物质含量(质量分数)显著下降,更易受到象鼻虫幼虫的侵害[7]。甲基茉莉酮酸可以诱导GGPPS 表达量大大提高,同时二萜含量(质量分数)也大幅度增加[8]。目前,普通烟草GGPPS 基因家族有4 个成员(3 个大亚基和1 个小亚基)被克隆出来,研究发现其参与了烟草萜类化合物的合成。烟草萜类化合物与烟草香气密切相关,因此GGPPS 基因对烟草生长发育和品质性状起着重要作用[9-11]。目前人们对于烟草萜类化合物的合成代谢调控还了解较少[12]。烟草全基因组测序的完成正在改变烟草分子生物学研究相对滞后的局面,为从全基因组水平认识基因的功能和调控网络提供了可能性[13-14]。为此,在全基因组水平上对烟草GGPPS 基因家族进行了系统地注释、序列分析、分子进化分析,以期为进一步研究和利用其功能提供依据。
1 材料与方法
1.1 GGPPS 基因查找与鉴定
利用拟南芥中确定的12个GGPPS基因编码的蛋白质序列[15](TAIR Release 10,http://www.arabidopsis.org/)和普通烟草中已克隆的4 个GGPPS 基因编码的蛋白质序列(NCBI 登录号:ADD49734.1,ADD49735.1,AFB35651.1,AFC 88470.2),与美国Phillip Morris 公司公布的普通烟草TN90[14]、林烟草、绒毛状烟草[13]基因组序列进行TBLASTN比对。基于比对结果,利用AUGUSTUS软件[16]进行开放阅读框(ORF)的预测。对于预测得到的基因,利用Pfam 数据库(http://pfam.xfam.org/)对其进行结构域注释。然后,对每个基因进行手工检查,具有完整ORF 并且序列包含DD(XX)1-2D 和CXXXC 等保守基序的基因作为最终确定的GGPPS 基因。番茄、土豆、辣椒中GGPPS 基因的查找是利用拟南芥中GGPPS 基因编码的蛋白质序列,分别对番茄[17](ITAG Release 2.3,http://solgenomics.net/)、土豆[18](PGSC DM Version 3.4,http://potatogenome.net/)、辣 椒[19](Pepper Version 1.55,http://peppergenome.snu.ac.kr/)基因集进 行BLASTP 比对,之后的鉴定方法与烟草相同。
1.2 GGPPS 基因注释
利 用Compute pI/Mw software[20](http://www.expasy.ch/tools/pi_tool.html)预 测GGPPS 基 因编码的蛋白质分子量和等电点;信号肽的预测用TargetP[21]软 件(http://www.cbs.dtu.dk/services/TargetP)。
1.3 多序列联配和系统进化分析
使用MUSCLE[22](v3.8.31)进行多序列联配;采用MEGA 5.2[23]进行系统进化分析,其方法为邻近法(NJ),BOOTSTRAP 值为1 000。
1.4 基因复制类型确定
串联重复基因定义为基因组上位置相邻的基因;对于片断重复基因,基于中国烟草基因组数据库数据,利用MCScanX[24]对基因共线性区间进行查找鉴定,共线性区间内的基因对视为片断重复基因。
1.5 Ka 和Ks 分析
首先利用MUSCLE(v3.8.31)将GGPPS 基因的蛋白质序列进行多序列联配,然后编写PERL 脚本将蛋白质联配结果转换为CDS 序列联配,基于CDS联配结果利用KaKs_Calculator 软件进行非同义替换率(Ka)和同义替换率(Ks)计算[25]。按文献[26]的方法计算基因进化速率。
2 结果与分析
2.1 GGPPS 基因查找与注释
通过TBLASTN比对(期望值e≤100),基于ORF和结构域信息,最终在普通烟草中鉴定出9 个成员(大亚基7个、小亚基2个),林烟草5个成员(大亚基4个、小亚基1个),绒毛状烟草5个成员(大亚基4个、小亚基1 个),见表1。针对烟草中鉴定出的GGPPS基因,首先将林烟草和绒毛状烟草的GGPPS 基因按照大小亚基分类依次进行了编号命名,其中1~4 号为大亚基基因,5 号为小亚基基因。随后,鉴于普通烟草为异源四倍体,其中的大多数基因包含两个拷贝,为了方便与二倍体中的基因进行比对,利用同源关系对普通烟草中每个GGPPS 基因及其拷贝进行了编号命名。另外,通过对烟草近缘物种(番茄、土豆和辣椒)基因集进行BLASTP 比对(e≤100)及筛选过滤,在番茄中鉴定出6个GGPPS基因,在土豆和辣椒中分别鉴定出8 个和4 个GGPPS 基因(表2)。因此,在数量方面,二倍体烟草与其近缘物种相差不大,较番茄、土豆分别少1 个和3 个,比辣椒多1个。与拟南芥相比,烟草及其近缘物种数量偏少。

表1 烟草GGPPS 基因编码区所在基因组位置信息

表2 其他物种的GGPPS 基因登录号
对烟草GGPPS 基因编码的蛋白质序列进行预测,结果(表3)显示,普通烟草、林烟草、绒毛状烟草GGPPS 基因ORF 长度在999~1 119 bp 之间,编码332~372 个氨基酸,蛋白质分子量为36.2~40.7 kD,等电点在5.41~8.32 之间。表明普通烟草、林烟草和绒毛状烟草GGPPS 基因分子信息数值范围基本没有差异。在3 种烟草中,大亚基基因之间基本保持一致,小亚基基因各项数值均基本小于大亚基基因。

表3 烟草GGPPS 基因编码的蛋白质信息
2.2 GGPPS 基因结构及结构域分析
对普通烟草、林烟草、绒毛状烟草GGPPS 进行聚类及基因结构、蛋白质结构域分析,结果表明:烟草GGPPS 基因家族分为小亚基[9]和大亚基[10]两组,见图1。在基因结构方面(图1),小亚基中的基因由两个外显子组成,大亚基的基因只包含一个外显子,表明小亚基与大亚基在基因结构方面有明显差异。另外,在结构域方面(图2),GGPPS 家族包含之前报道的5 个保守区域,氨基酸序列中包含两个DD(XX)1-2D(X 指任意氨基酸)天冬氨酸富集基序,此位点被认为是异戊二烯基与底物相互结合的重要位点,小亚基在第二个天冬氨酸富集基序上发生了改变,由D 变为了E,即DDXXE。另外,氨基酸序列中也包含了CXXXC(X 指任意疏水性氨基酸)基序,该位点对亚基之间的互作非常重要,小亚基中有两个,大亚基缺失了第二个。
2.3 GGPPS 基因组分布和基因复制分析
对GGPPS 家族成员在烟草基因组上的分布进行了分析,结果(图3)显示,普通烟草中NtabGGPPS3-1 与NtabGGPPS4-1、NtabGGPPS3-2与NtabGGPPS4-2,绒毛状烟草中NtomGGPPS3 与NtomGGPPS4,林烟草中NsylGGPPS3 与NsylGGPPS4分别位于相同的Scaffold 上,并且其位置紧密相连。因此,这些基因可能发生了串联重复。另外,利用MCScanX 对烟草基因共线性进行了查找鉴定,由于目前已公布的烟草基因组组装效果不好,不能满足基因共线性分析的要求,因而利用中国烟草基因组数据库中数据进行了烟草共线性分析。结果(图3)发现,普通烟草中NtabGGPPS1-1与NtabGGPPS3-1(或NtabGGPPS4-1)、NtabGGPPS1-2与NtabGGPPS3-2(或NtabGGPPS4-2),绒毛状烟草中NtomGGPPS1 与NtomGGPPS3(或NtomGGPPS4),林烟草中NsylGGPPS1 与NsylGGPPS3(或NsylGGPPS4)互为共线性基因对,说明烟草GGPPS 家族可能发生了区段复制。

图1 普通烟草、林烟草、绒毛状烟草GGPPS 聚类及基因结构示意图

图2 普通烟草GGPPS 基因编码的氨基酸序列比对
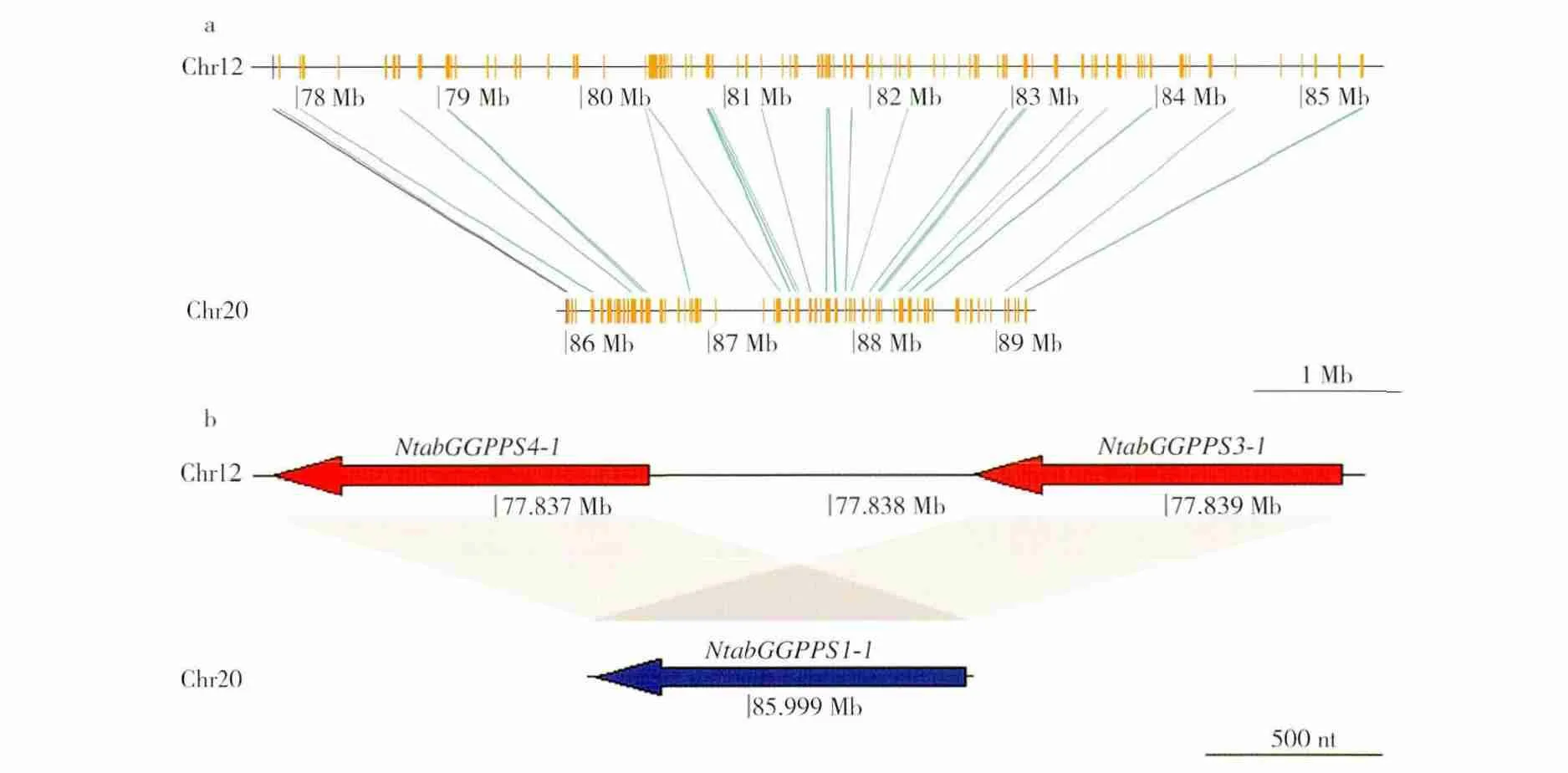
图3 普通烟草NtabGGPPS1-1,NtabGGPPS3-1 和NtabGGPPS4-1 基因组分布示意图
2.4 GGPPS 基因家族与其他物种系统进化关系
系统进化分析结果(图4)显示,烟草及近缘物种(番茄、土豆、辣椒)聚为两大组,分别为大亚基和小亚基,其中大亚基组又分为4 个簇,小亚基组1 个簇。烟草、番茄、土豆、辣椒各物种内的GGPPS基因并未按照物种聚集在一起,相反,各物种间GGPPS 直系同源基因独立聚集成簇,这表明茄科GGPPS 家族历史久远,其中相当一部分成员在茄科各物种分化之前就已形成,并且在随后的进化过程中非常保守。另外,进化树显示,林烟草、绒毛状烟草的GGPPS 基因与番茄、土豆、辣椒中的同源基因保持了良好的对应关系,基于简约性(Parsimony)原则,推测番茄和土豆GGPPS 家族发生了扩增,分别增加了1 个和3 个拷贝,辣椒中发生了丢失,缺少了1 个拷贝,而林烟草、绒毛状烟草中没有发现明显的基因获得和基因丢失。另外,明确了普通烟草中各个GGPPS 基因的亲本来源(表4)。由表4 可知,NtabGGPPS2 缺少1 个拷贝,该拷贝与绒毛状烟草NtomGGPPS2 互为直系同源,可能发生了基因丢失。

图4 普通烟草、林烟草、绒毛状烟草与其他物种GGPPS 基因家族系统发育树

表4 普通烟草与林烟草、绒毛状烟草GGPPS 基因直系同源对应关系
2.5 普通烟草GGPPS 基因选择压分析
Ks 值计算结果(表5)显示,其分布于0.003~0.020 之间。其中,NtabGGPPS1-1 与NsylGGPPS1、NtabGGPPS1-2 与NtomGGPPS1 两个基因对的Ks 值在0.020 左 右,NtabGGPPS3-2 与NtomGGPPS3、NtabGGPPS4-2 与NtomGGPPS4、NtabGGPPS5-2 与NtomGGPPS5 的Ks 值在0.003 左右。按照普通烟草形 成时间为20万年计算[27],NtabGGPPS1-1 和NtabGGPPS1-2 进化速率为每个位点每年5×10-8替换,NtabGGPPS3-2、NtabGGPPS4-2和NtabGGPPS5-2进化速率为每个位点每年8×10-9替换。可见,NtabGGPPS1-1 和NtabGGPPS1-2 两个基因进化速率较快。为了进一步检测普通烟草GGPPS 基因在进化过程中受到的选择压,对直系同源基因对之间 的ω 值(ω=Ka/Ks)进行了计算,结果显示NtabGGPPS1-1 与NsylGGPPS1,NtabGGPPS1-2 与NtomGGPPS1 两个基因对均显著小于1(P<0.05),表明NtabGGPPS1-1 和NtabGGPPS1-2 基因可能受到了净化选择。

表5 普通烟草与林烟草、绒毛状烟草GGPPS直系同源基因对Ks 和ω值信息①
3 结论与讨论
对烟草全基因组查找发现普通烟草TN90 有9个GGPPS 基因(大亚基7 个、小亚基2 个),林烟草、绒毛状烟草各有5 个成员(大亚基4 个、小亚基1个)。基于同样的方法对普通烟草K326 和Basma Xanthi 基因组[15]也进行了查找,并未发现新的GGPPS 基因,这表明在本研究中所鉴定出的GGPPS 基因家族是完整的。在基因数量方面,二倍体烟草与近缘物种番茄(6 个)、土豆(8 个)、辣椒(4 个)差异不大,这可能是由于近缘物种中发生了基因扩增或基因丢失造成的;而与拟南芥(12 个)相比,烟草及近缘物种数量均偏少,这可能是远缘物种间的进化差异导致。烟草GGPPS 家族成员之间ORF、分子量和等电点很相似,小亚基基因数值总体小于大亚基基因。烟草GGPPS 基因大小亚基的基因结构有明显差异,大亚基基因由单个外显子组成,小亚基基因则有两个外显子和一个内含子。烟草GGPPS 基因编码的氨基酸序列中包含了之前报道的5 个保守区域,具有天冬氨酸富集基序DD(XX)1-2D 和CXXXC 基序等重要保守区间;小亚基具有两个CXXXC 基序,而大亚基只有一个,特别是大亚基区域存在的富含天冬氨酸的基序“DDXXD”在小亚基中变为“DDXXE”,这种差异可能导致了大亚基与小亚基之间的功能差异。
GGPPS3 与GGPPS4 属于串联重复,暗示GGPPS3 与GGPPS4 之间可能发生了串联重复复制。GGPPS1 与GGPPS3 或GGPPS4为共线性基因对,暗示GGPPS1 与GGPPS3 或GGPPS4 之间可能发生了片断复制。这表明串联重复复制和片断复制是烟草GGPPS 家族形成的重要机制。
系统进化分析表明,茄科GGPPS 家族形成在茄科物种分化之前,而且随后在各物种中进化也比较保守。林烟草、绒毛状烟草GGPPS 家族没有发生明显的基因获得或基因丢失,但普通烟草中缺失了一个拷贝,该拷贝与绒毛状烟草中NtomGGPPS2 相对应;该拷贝在普通烟草K326 和Basma Xanthi 基因组中同样是缺失的,这表明该基因在普通烟草进化过程中可能发生了丢失。两个基因对(NtabGGPPS1-1 与 NsylGGPPS1、NtabGGPPS1-2 与NtomGGPPS1)的Ks值明显高于其他基因对,说明NtabGGPPS1-1 和NtabGGPPS1-2较其他普通烟草的GGPPS 基因进化速率更快。两个基因对(NtabGGPPS1-1 与 NsylGGPPS1、NtabGGPPS1-2 与NtomGGPPS1)的ω值显著小于1(P<0.05),说明NtabGGPPS1-1 和NtabGGPPS1-2 在进化过程中可能受到了净化选择。
[1]Laskaris G,De Jong C F,Jaziri M,et al.Geranylgeranyl diphosphate synthase activity and taxane production in Taxus baccata cells[J].Phytochemistry,1999,50(6):939-946.
[2]Wang G,Dixon R A.Heterodimeric geranyl(geranyl)diphosphate synthase from hop(Humulus lupulus)and the evolution of monoterpene biosynthesis[J].Proc Natl Acad Sci USA,2009,106(24):9914-9919.
[3]Kuntz M,Romer S,Suire C,et al.Identification of a cDNA for the plastid-located geranylgeranyl pyrophosphate synthase from Capsicum annuum:correlative increase in enzyme activity and transcript level during fruit ripening[J].Plant J,1992,2(1):25-34.
[4]Ukibe K,Hashida K,Yoshida N,et al.Metabolic engineering of Saccharomyces cerevisiae for astaxanthin production and oxidative stress tolerance[J].Appl Environ Microbiol,2009,75(22):7205-7211.
[5]Breitenbach J,Visser H,Verdoes J C,et al.Engineering of geranylgeranyl pyrophosphate synthase levels and physiological conditions for enhanced carotenoid and astaxanthin synthesis in Xanthophyllomyces dendrorhous[J].Biotechnol Lett,2011,33(4):755-761.
[6]Csernetics A,Nagy G,Iturriaga E A,et al.Expression of three isoprenoid biosynthesis genes and their effects on the carotenoid production of the zygomycete Mucor circinelloides[J].Fungal Genet Biol,2011,48(7):696-703.
[7]Diezel C,Kessler D,Baldwin I T.Pithy protection:Nicotiana attenuata's jasmonic acid-mediated defenses are required to resist stem-boring weevil larvae[J].Plant Physiol,2011,155(4):1936-1946.
[8]Schmidt A,Nagel R,Krekling T,et al.Induction of isoprenyl diphosphate synthases,plant hormones and defense signalling genes correlates with traumatic resin duct formation in Norway spruce(Picea abies)[J].Plant Mol Biol,2011,77(6):577-590.
[9]林世锋,王仁刚,张孝廉,等.烟草牻牛儿基牻牛儿基焦磷酸合成酶小亚基基因的克隆及组织表达谱[J].烟草科技,2014(2):70-75.
[10]李锋,李明,金立锋,等.烟草牻牛儿基牻牛儿基焦磷酸合成酶基因的克隆及分析[J].烟草科技,2012(5):60-64.
[11]Orlova I,Nagegowda D A,Kish C M,et al.The small subunit of snapdragon geranyl diphosphate synthase modifies the chain length specificity of tobacco geranylgeranyl diphosphate synthase in planta[J].Plant Cell,2009,21(12):4002-4017.
[12]杨铁钊,李钦奎,李伟.植物次生代谢与烟草香味物质[J].中国烟草科学,2005,26(4):23-26.
[13]Sierro N,Battey J N,Ouadi S,et al.Reference genomes and transcriptomes of Nicotiana sylvestris and Nicotiana tomentosiformis[J].Genome Biol,2013,14(6):R60.
[14]Sierro N,Battey J N,Ouadi S,et al.The tobacco genome sequence and its comparison with those of tomato and potato[J].Nat Commun,2014,5:3833.
[15]Beck G,Coman D,Herren E,et al.Characterization of the GGPP synthase gene family in Arabidopsisthaliana[J].Plant Mol Biol,2013,82(4-5):393-416.
[16]Stanke M,Steinkamp R,Waack S,et al.AUGUSTUS:a web server for gene finding in eukaryotes[J].Nucleic Acids Res,2004,32(Suppl 2):309-312.
[17]Consortium T G.The tomato genome sequence provides insights into fleshy fruit evolution[J].Nature,2012,485(7400):635-641.
[18]Xu X,Pan S,Cheng S,et al.Genome sequence and analysis of the tuber crop potato[J].Nature,2011,475(7355):189-195.
[19]Kim S,Park M,Yeom S I,et al.Genome sequence of the hot pepper provides insights into the evolution of pungency in Capsicum species[J].Nat Genet,2014,46(3):270-278.
[20]Bjellqvist B,Hughes G J,Pasquali C,et al.The focusing positions of polypeptides in immobilized pH gradients can be predicted from their amino acid sequences[J].Electrophoresis,1993,14(10):1023-1031.
[21]Nielsen H,Engelbrecht J,Brunak S,et al.Identification of prokaryotic and eukaryotic signal peptides and prediction of their cleavage sites[J].Protein Eng,1997,10(1):1-6.
[22]Edgar R C.MUSCLE:multiple sequence alignment with high accuracy and high throughput[J].Nucleic Acids Res,2004,32(5):1792-1797.
[23]Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Mol Biol Evol,2011,28(10):2731-2739.
[24]Wang Y,Tang H,Debarry J D,et al.MCScanX:a toolkit for detection and evolutionary analysis of gene synteny and collinearity[J].Nucleic Acids Res,2012,40(7):e49.
[25]Zhang Z,Li J,Zhao X Q,et al.KaKs_Calculator:calculating Ka and Ks through model selection and model averaging[J].Genomics Proteomics Bioinformatics,2006,4(4):259-263.
[26]Yu C,Li Y,Li B,et al.Molecular analysis of phosphomannomutase(PMM)genes reveals a unique PMM duplication event in diverse Triticeae species and the main PMM isozymes in bread wheat tissues[J].BMC Plant Biol,2010,10(1):214.
[27]Leitch I J,Hanson L,Lim K Y,et al.The ups and downs of genome size evolution in polyploid species of Nicotiana(Solanaceae)[J].Annals of Botany,2008,101(6):805-814.
