阳极阻滞电刺激骶神经根对兔脊髓损伤性神经源性膀胱功能恢复作用研究
2015-02-07王成秀王俊华杨凤翔程宇核
王成秀,王俊华,杨凤翔,程宇核,戢 珂,柯 娟
(湖北省十堰市太和医院(湖北医药学院附属医院),湖北 十堰 442000)
阳极阻滞电刺激骶神经根对兔脊髓损伤性神经源性膀胱功能恢复作用研究
王成秀,王俊华,杨凤翔,程宇核,戢 珂,柯 娟
(湖北省十堰市太和医院(湖北医药学院附属医院),湖北 十堰 442000)

目的 探讨阳极阻滞电刺激术刺激骶神经根对恢复脊髓损伤性神经源性膀胱功能的价值及机制。方法 选取新西兰清洁级白兔54只,均经尿流动力学检查证实无异常。随机选择18只作为对照组(假手术),其余36只采用脊髓完全夹闭法造成脊髓损伤模型。造模后白兔按是否植入电极分成电刺激组18只与神经源性膀胱组18只。电刺激组予以长期电刺激,刺激时间为30 min/次,6次/d,刺激4周。检查3组尿动力学情况,评估膀胱功能。结果 对照组术前术后未见逼尿肌收缩现象,尿动力参数各项指标比较差异均无统计学意义,且膀胱充盈期压力曲线较为平滑,无排尿期反射;神经源性膀胱组术后膀胱逼尿肌漏尿点压、静息压升高,逼尿肌活动亢进且收缩多为无效,在排尿过程中出现逼尿肌-括约肌失调,残余尿量增多且排尿量减少,膀胱体积明显减少,排尿效率与膀胱顺应性均下降;电刺激组膀胱静息压有所上升,膀胱充盈中逼尿肌收缩较佳,漏尿点压有所降低,且括约肌在排尿中肌电图十分稳定,排尿量有所增加,残余尿量相应减少,排尿效率以及膀胱顺应性均增高。结论 阳极阻滞电刺激法可以明显减少残余尿量,增大膀胱体积,有助于排尿率的提升,可降低逼尿肌压、漏尿点压以及膀胱静息压,对恢复膀胱功能及重建有重要意义。
神经源性膀胱;尿流动力学;脊髓损伤;阳极阻滞电刺激
脊髓损伤(SCI)神经源性膀胱可造成尿路感染,导致膀胱功能障碍并引发慢性肾衰竭等,是截瘫患者的主要死亡原因之一,因此恢复损伤后膀胱功能是提高患者生存率及生存质量的重要环节,对于延长患者生存时间有重要价值[1-3]。目前主要治疗方法包括药物、膀胱扩大术、间歇导尿等,但因治疗周期长、多并发症等缺点,导致效果不佳,也不易于被患者接受。大量研究证实,电刺激骶神经前根有助于尿液的排出,这是因为电刺激时,括约肌与逼尿肌会出现同时收缩现象,二者的反应时间有差异,逼尿肌收缩状态下,括约肌则处于舒张状态,正是因为二者的压力差促使尿液排出,这也是生理排尿模式[4-6]。在各项研究中,最先应用在临床神经假体的是骶神经根刺激器,但其会造成膀胱输尿管的反流并引发膀胱内压上升,对肾功能有所损伤。此外,骶神经根被刺激的同时会影响下肢的神经纤维造成下肢抖动。而阳极阻断技术通过电流提高神经纤维膜外的电位,使神经纤维处于超极化状态,此时传导的动作电位无法使处于超极化神经纤维产生去极化,神经纤维无法兴奋,在该区域,动作电位被阻断,故称之为阳极阻断[7]。本研究探讨了阳极阻滞电刺激骶神经根对兔脊髓损伤性神经源性膀胱功能恢复的作用,现报道如下。
1 实验资料
1.1动物 选取新西兰清洁级成年雌性白兔54只,体质量2.2~2.5 kg,动物合格证号:SYXK(京)2011-0039 。
1.2 造模及分组 白兔饲养1周后实验,依据《关于善待实验动物的指导性意见》,随机选择18只作为对照组(假手术组):禁食禁水12 h,通过肌注速眠新进行麻醉后,将白兔俯卧位固定于手术台上,将建好静脉通道,以100 mL/h速度输入生理盐水,常规备皮、术野内消毒以及铺无菌单等,选择T8—10棘突为入路点,行一长约5 cm的竖切口,顺利暴露出皮下组织、深筋膜以及椎板,将椎板切除并暴露出脊髓。其余36只采用脊髓完全夹闭法建造脊髓损伤模型:实验步骤同对照组,仅在暴露出脊髓后使用血管钳完全性夹闭脊髓处理约1 min,至实验兔双下肢不再抖动为止。模型建立后将实验兔分成电刺激组18只与神经源性膀胱组18只,电刺激组给予植入电极,神经源性膀胱组不植入电极。
1.3 电刺激方法 测定S1—4神经根的前根直径,以此为依据来设计刺激电极。以电刺激组白兔的S1—4棘突为中心,将皮肤及皮下组织切开直至椎板,再将椎板切除后暴露出神经根,神经根暴露后注意马尾后半部应为骶神经后根,前半部为骶神经前根,再将双侧的S1—4骶神经后根切断,随后变换实验白兔的体位为侧卧位,从而减少电刺激时膀胱内压受到腹压的影响,用设计好的刺激电极对骶神经前根进行电刺激,最后缝合固定好刺激电极。电刺激脉宽设置为50 μs,初始刺激电流为0.01 mA,刺激频率为20 Hz,随着刺激进行,可以逐渐增加刺激电流以及脉宽,在整个电刺激过程中,发现尿道压为0时,可记录下电刺激参数。然后向膀胱内注入温盐水50 mL,再按照此参数继续行电刺激,测定电刺激下的膀胱内压以及排尿体积,测定后留置引流管并缝合硬膜与切口,注意电极的导线应该通过切口留置于皮肤的外部。电刺激6次/d,15~30 min/次,电刺激4周后再复查尿流动力学。
1.4 检测指标
1.4.1 尿流动力学测定 测定指标包括膀胱容量、排尿体积、残余尿体积、排尿效率、腹内压、逼尿肌最大压、膀胱顺应性等。术前对实验兔在催眠下行尿流动力学检测,损伤实验兔在损伤后的2周再次行尿流动力学检测,若发现逼尿肌亢进或者与括约肌协同力失调,则被认为神经源性膀胱。在正式进入实验前,为了了解骶神经根基本的解剖学情况以及尿流动力学,先进行预实验,分析麻醉药物的使用剂量,待有一定基础再进入正式实验。正式实验方法:检查前排尽尿液与粪便,将白兔仰卧放置于V型槽中,保持头部略低,轻轻抚摸白兔前额直至被催眠,一般家兔的催眠可诱导维持在40 min左右,催眠后特征:四季肌肉紧张度下降,可见瞳孔缩小,呼吸频率轻度降低,在行尿流动力学检测时,不会打断催眠状态,并具有耐受性,不会出现反抗。检测步骤:电脑与多通道电生理仪连接,对与膀胱处于同一水平的导尿管(充满生理盐水)进行校准,调整压力传感器,保持基线的准确,将压力传感器中的气泡排空,保证压力传感器以及导尿管中充满生理盐水,将导尿管作为灌注管使用,向膀胱注入生理盐水;应用6FR测压管通过肛门插入测量腹内压,再将4FR输尿管导管以及6FR双腔尿管经尿道进入膀胱内,随后向膀胱内以15 mL/min的速度匀速灌注生理盐水,并注意测压管要与压力换能器连接;选择22G针状电极通过会阴缓慢插入尿道外括约肌,再选取2枚电极,均插入双下肢腓肠肌内,测量尿道外括约肌肌电,并在整个膀胱灌注中详细记录尿流动力学的变化,还要注意尿道外括约肌的肌电及肛门内压的变化。若发现尿道外口溢出了尿液,需要及时停止灌注。此时可记录膀胱漏尿点压,并测量此时排出的尿液,以此作为排尿体积,将残余尿引出,测量其体积,并应用叩诊法测定膀胱是否排空,记录膀胱总体积=(排尿体积+残余尿体积)、排尿效率=(排尿体积/膀胱总体积)。并依据以上相关数据计算最大逼尿肌压。
1.4.2 尿道压与膀胱内压的测定 测压管可选择2根4FR输尿管导管,将导管放置于电刺激组白兔的膀胱内,测压管导管的另一端则需要与换能器连接,注意压力换能器与尿道外括约肌水平,这时读取两测压管数据,读数相等为膀胱静息压,缓慢地向外拖动测压导管,直至膀胱测压管读数不变而尿道测压管读数最大,此状态下,两测压管已经处于尿道与膀胱内,随后可缝合固定测压管。
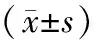
2 结 果
2.1实验完成情况 实验过程中对照组死亡2只;电刺激组损伤神经根2只,且1只反应较弱而排除;神经源性膀胱组死亡3只。最后电刺激组16只、对照组16只、神经源性膀胱组15只完成实验。
2.2 电刺激组损伤前及电刺激中膀胱功能情况比较 在行电刺激时,选择初始的脉宽为50μs,初始刺激电流为0.01mA,刺激频率为20Hz,当刺激电流逐渐增加至0.03mA时,可发现尿道压有一定升高;当刺激电流平均上升至1mA时,发现膀胱内压有上升趋势,而脉宽逐渐上升至300μs;当平均刺激电流至1.05mA时,尿道内压归零,此时的膀胱内压维持在40cmH2O(1cmH2O=0.098kPa),有少量尿液流出。与损伤前比较,行阳极阻滞电刺激后,膀胱内压明显较低,但经过一段周期的电刺激后,膀胱内压逐渐升高,并与损伤前的膀胱最大内压比较差异无统计学意义;在电刺激中,排尿体积低于损伤前(P<0.01),残余尿体积高于损伤前,但排尿效率与损伤前比较差异无统计学意义,可见在此电刺激参数的情况下,阳极阻滞电刺激能够有效恢复实验兔的排尿功能。见表1。
2.3 对照组手术前后尿流动力学参数比较 对照组术前术后尿流动力学无显著变化。见表2。
2.4 神经源性膀胱组损伤前后尿流动力学参数比较 神经源性膀胱组除腹内压、排尿体积损伤前后比较差异无统计学意义外,其余指标损伤前后比较差异均有统计学意义(P均<0.01)。见表3。
2.5 电刺激组损伤后及刺激4周后尿流动力学参数比较 刺激4周后,除腹内压无明显变化外,其余指标均明显改善(P均<0.01)。见表4。
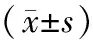
表1 电刺激组损伤前与电刺激中膀胱功能情况比较
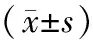
表2 对照组手术前后尿流动力学参数比较
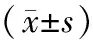
表3 神经源性膀胱组损伤前后尿流动力学参数比较
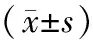
表4 电刺激组损伤后与刺激4周后尿流动力学参数比较
3 讨 论
临床研究表明,在当前的医疗条件下,脊髓损伤神经源性膀胱的有效治疗方法目前尚缺,治疗目标主要集中在低压充分排尿以及储尿方面,并由此来有效地控制逼尿肌的反射亢进[8]。应用尿流动力学检测,可以在早期了解膀胱功能的变化情况,并依据检测结果来制定合理的治疗方案,最大限度减少并发症及保护患者的肾功能,这对提高生存质量有着十分重要的价值与意义[9]。目前认为逼尿肌亢进以及膀胱顺应性下降是脊髓损伤后尿液反流的主要影响因素,因此提高膀胱容量及膀胱顺应性,并选择最为接近生理排尿的方式成为了当前学者研究的重点。
为了排除因手术对泌尿系统的影响,笔者在本研究中对实验兔实施了2次假手术,并在脊髓损伤后的2周开始对实验兔行尿流动力学检查,检查中发现部分实验兔处于脊髓休克状态,多数出现了逼尿肌亢进情况,膀胱在静息或者是充盈情况下出现不规律性收缩,且收缩为无效,无法排出尿液,通过生理盐水充盈膀胱诱其排尿时,膀胱内压明显升高。但发现括约肌肌电活动能力无变化,由此可见,逼尿肌与括约肌的协同能力失调,尿道外括约肌呈现病理状态,故将处于这种情况下的实验兔作为神经源性膀胱动物模型。
脊髓损伤后膀胱功能重建已经成为目前学者专家研究的热点[10],如损伤早期的阴部神经电刺激、低频电刺激法等,方法较多,但也因此有各自不同的优缺点。低频电刺激法对于脊髓休克有较好的作用,利于膀胱功能的恢复,通过电刺激阴部,可以调节治疗逼尿肌亢进,有效抑制膀胱的活动并能控制膀胱,可以更好地增加脊髓损伤后膀胱的最大容量,且在膀胱收缩时,通过阴部电刺激能够降低脊髓反射;此外,对膀胱收缩时的反射亢进,可以使用肛门外括约肌肌电图来监测,同时通过特定的电刺激可以减少持续刺激的时间,从而增加膀胱的容量,可见这种方法能够有效实现排尿功能的控制。但缺点是会诱发尿道外括约肌的收缩,且尿动力参数无法得到明显恢复改善,其机制到目前尚不明确[11]。本研究所应用的骶神经根电刺激能够结合背根切除术,可以较好地降低逼尿肌压,并能刺激排尿且抑制自主性的异常反射。通过诸多的临床中心试验,证实该方法效果确切,有着较好的应用前景[12-13]。但骶神经根电刺激改善下尿路功能的机制还不够明确。且普通的电刺激模式也有着不可忽略的缺点,易造成逼尿肌与括约肌的同步收缩,从而增加了膀胱内压,并容易损伤上尿路[14]。在本研究中,笔者采用了阳极阻滞电刺激,保持了尿路的完整,且最接近正常的生理排尿,同时经长期的电刺激后,膀胱容量有明显增加,膀胱充盈过程中以及在静息情况下均未出现明显的抑制性收缩或者是减少;膀胱顺应性明显改善,同时尿动力学参数也有所恢复,对脊髓损伤后的逼尿肌过度收缩也有一定程度的调节改善,并恢复了膀胱的储尿与排尿功能,且能够减少因为刺激造成的下肢肌肉收缩。由此可见,阳极阻滞电刺激对恢复膀胱功能及重建有重要意义,但具体作用机制尚不明确,可能与电刺激后膀胱神经的敏感与神经递质及受体变化有关联。
在本研究中,因未对脊髓休克期的实验兔进行电刺激研究,因此脊髓休克期使用阳极阻滞电刺激能否恢复膀胱功能仍需要进一步研究证实;且在本次实验中发现,当电刺激脉宽为300μs时,刺激电流同时达到1.05mA时,可选择性地收缩逼尿肌,同时尿道内压会降为0,单次性的电刺激还无法增加膀胱内压,但多次电刺激可以使得膀胱内压累积性升高,且与正常排尿的膀胱内压及排尿效率差异无统计学意义,双下肢抖动也有所减少,可见阳极阻滞电刺激效果好,对于重建膀胱功能有着重要的意义,有应用推广价值。
[1] 佘亚峰.脊髓损伤后膀胱功能重建研究及治疗进展[J].交通医学,2014,28(1):45-48
[2] 李长思,马跃文.生物刺激反馈仪治疗脊髓损伤所致神经源性膀胱的治疗效果[J].中国医科大学学报,2013,42(5):469-471
[3] 冯江学.脊髓损伤后膀胱功能障碍的研究进展[J].广西医学,2012,34(10):1407-1409
[4] 杨伟东,双卫兵.神经源性膀胱的病因学研究进展[J].中西医结合心脑血管病杂志,2013,11(12):1507-1509
[5] 施海燕,郝又国,陆伟伟.脊髓损伤的康复治疗进展[J].中国康复,2012,27(1):44-46
[6] 蒋东生,车兴旺,范连彬,等.生物反馈技术结合膀胱功能训练治疗脊髓损伤患者排尿障碍[J].临床医学,2012,32(8):54-56
[7]BadlaniGH.Theincidenceandetiologyofoverreactivebladderinpatientsaftercerebrovascularaccident[J].CurrentUrologyReports,2012,13(5):402-406
[8] 焦守镔,双卫兵,王东文,等. 脊髓背侧损伤大鼠排尿上行传导通路的改变[J].中国现代医学杂志,2012,22(21):9-12
[9]RotarM,BlagusR.Strokepatientswhoregainurinarycontinenceinthefirstweekafteracutefirst-everstrokehavebetterprognosisthanpatientswithpersistentlowerurinarytractdysfunction[J].NeurourolUrodyn,2011,30(7):1315-1318
[10]LinsenmeyerTA.Post-CVAvoidingdysfunctions:clinicalinsightsandliteraturereview[J].NeuroRehabilitatation,2012,30(1):1-7
[11]WingeK,NielsenKK.BladderdysfunctioninadvancedParkinson’sdisease[J].NeurourolUrodyn,2012,31(8):1279-1283
[12]WehrbergerC,MadersbacherS.Lowerurinarytractsymptomsandurinaryincontinenceinageriatriccohort-apopulation-basedanalysis[J].BJUInt,2012,110(10):1516-1521
[13]JostWH.UrologicalproblemsinParkinson’sdisease:clinicalaspects[J].JNeuralTransm,2013,120(4):587-591
[14]ChungSD,ChenYK.Hyperthyroidismandfemaleurinaryincontinence:Apopulation-basedcohortstudy[J].ClinEndocrinol,2011,75(5):704-708
Study on the effect of anodal block electrical stimulation at sacral nerve roots in the rabbits with spinal cord injury neurogenic bladder
WANG Chengxiu,WANG Junhua,YANG Fengxiang,CHENG Yuhe,JI Ke,KE Juan
(Shiyan Taihe Hospital Affiliated to Hubei Medical College,Shiyan 442000,Hubei,China)
Objective It is to explore the value and mechanism of anodal block electrical stimulation at sacral nerve root on the recovery of spinal cord injury neurogenic bladder function.Methods 54 New Zealand rabbits of clean grade were selected and confirmed to be normal by urodynamics,in which 18 ones were randomly selected as control group (sham operation),the rest 36 ones were established as spinal cord injury models by completely spinal occlusion,and the injury animal models were divided into electrical stimulation group (n=18) and neurogenic bladder group (n=18) according to whether implanted electrodes.Electrical stimulation group was treated with long-term electrical stimulation for 4 weeks,the stimulation time was 30min per once and 6 times per day.Urine dynamics of the rabbits in the three groups were checked after 4 weeks to evaluate the function of bladder.Results No detrusor contraction phenomenon was found in the control group before and after surgery,and there was no difference in urodynamic parameters,and the bladder filling period of pressure curve was more smooth,without voiding reflex.In neurogenic bladder group,urinary bladder detrusor leak point pressure and resting pressure increased after operation,detrusor overactivity and shrink much as invalid,urination disorders of detrusor sphincter appeared,residual urine volume increased and urine output decreased,bladder volume significantly reduced,and voiding efficiency and bladder compliance decreased.In electrical stimulation group,the bladder resting pressure increased,the filling of bladder detrusor contraction was better,leak point pressure decreased,the sphincter electromyography in micturition was very stable,urine output increased,a corresponding reduction in residual urine volume,voiding efficiency and bladder compliance were higher.Conclusion Anode block electrical stimulation can significantly reduce residual urine volume and increase bladder volume,which is helpful for the increase of urination rate,it can reduce detrusor pressure,leak point pressure and bladder resting pressure,and has an important significance for the recovery and reconstruction of bladder function.
neurogenic bladder; urodynamics; spinal cord injury; anode block electrical stimulation
王成秀,女,副主任护师,本科,主要从事神经康复护理和教学工作。
柯娟,E-mail:497242655@qq.com
湖北省教育厅重点科研立项课题(D20092104)
10.3969/j.issn.1008-8849.2015.16.003
R-332
A
1008-8849(2015)16-1717-04
2014-11-30
