首发偏执型精神分裂症患者脑垂体体积的研究
2015-02-07陈金卫伍秋林张汉锡林文霞肖壮伟1
陈金卫,冀 宾,梅 维,伍秋林,张汉锡,林文霞,肖壮伟1,
(1. 汕头大学医学院,广东 汕头 515041;2. 广东省汕头市第二人民医院,广东 汕头 515041;3. 汕头大学医学院第一附属医院,广东 汕头 515041;4. 广东省医学分子影像重点实验室,广东 汕头 515041)
首发偏执型精神分裂症患者脑垂体体积的研究
陈金卫1,2,冀 宾2,梅 维3,伍秋林4,张汉锡1,2,林文霞1,2,肖壮伟1,4
(1. 汕头大学医学院,广东 汕头 515041;2. 广东省汕头市第二人民医院,广东 汕头 515041;3. 汕头大学医学院第一附属医院,广东 汕头 515041;4. 广东省医学分子影像重点实验室,广东 汕头 515041)

目的 探讨首发未用药偏执型精神分裂症患者脑垂体体积的改变。方法 选择25例首发偏执型精神分裂症患者作为患者组,25例年龄、性别、受教育年限等与患者组相匹配的健康对照者作为对照组。应用1.5T磁共振成像仪对所有受试者进行头颅结构磁共振扫描获得3D脑结构图像,采用MRIcro和MATLAB软件分别进行垂体体积和大脑体积测量。以阳性和阴性症状量表(PANSS)评估患者精神症状。分析患者的垂体体积与年龄、教育年限、发病年龄、病程、PANSS总分和各项因子分的相关性。结果 患者组垂体体积大于对照组(P<0.05);对照组女性的垂体体积大于男性。偏相关分析显示,垂体体积与PANSS总分存在正相关关系(r=0.454,P=0.029),其余指标与垂体体积均无明显相关性(P均>0.05)。结论 首发未用药偏执型精神分裂症患者垂体体积有异常增大的改变,并与临床症状严重程度有关联,提示患者在发病早期阶段下丘脑-垂体-肾上腺轴腺体存在应激反应的易感性,这些异常改变可能与精神分裂症的神经内分泌机制有关。垂体体积可能存在性别效应。
首发精神分裂症;HPA轴;垂体体积;磁共振成像
精神分裂症发病常与应激有关,而垂体作为下丘脑-垂体-肾上腺(HPA)轴一重要组成部分参与机体调节各种生理性、心理性应激。研究报道,精神分裂症存在HPA轴功能的异常[1],而且精神分裂症无论是发病还是临床症状加重均与应激引起的HPA轴腺体功能的异常活跃相关[2]。有研究发现首发精神分裂症患者存在异常高水平HPA轴激素[3]。目前研究还认为垂体形态学的变化反映了垂体激素分泌水平的变化[4]。此外,首发精神分裂症患者垂体体积明显增大,且在早期阶段,HPA轴释放的应激激素水平与垂体腺体积增大有关联[5-7],但也有研究未发现精神分裂症患者和对照组间的垂体体积有显著性差异[8-9]。可见,目前针对首发精神分裂症患者脑垂体体积的研究结果并不一致。结果的不一致性可能与样本量、样本中男女的比例、测量方法、数据分析方法和混杂因素的控制等多种因素有关。目前国外对首发精神分裂症患者垂体的研究报道较多,而国内对精神分裂症患者HPA轴所释放的激素有研究,但对精神分裂症患者垂体体积的测量,尤其首发精神分裂症患者未见报道。本研究采用1.5T MR成像系统和借助体积测量软件,分析了首发未用药偏执型精神分裂症患者和正常对照者垂体腺体积的差异,旨在探讨垂体腺异常改变情况及其与临床症状、性别的相关性,从而为揭示精神分裂症发病的神经内分泌机制提供影像学依据。
1 临床资料
1.1一般资料 本研究通过汕头大学医学院医学伦理委员会审批,并于入组前得到所有受试对象或其法定监护人的同意并签署知情同意书。选择汕头大学医学院精神卫生中心门诊诊治首发未用药偏执型精神分裂症患者25例作为患者组。入组标准:①符合《美国精神障碍诊断与统计手册》第4版和《中国精神障碍分类与诊断标准》第3版精神分裂症诊断标准;②首次发病及就诊,病程 ≤1.5年,未曾服用过任何抗精神病药物、抗抑郁药等精神科药物;③年龄16~45岁;④汉族,小学以上文化;⑤临床诊断为阳性亚型,即阳性和阴性症状量表(PANSS)的阳性量表评分中度及以上的项目≥3项,阴性量表评分为中度项目不足3项,均为偏执型;⑥能够配合检查,依从性好。排除患有脑器质性疾病、神经系统疾病及严重的内分泌、代谢性疾病者,患焦虑障碍、精神发育迟滞等其他精神疾病者,安有固定金属义齿、心脏起搏器、金属义肢等磁共振扫描禁忌证者,有酒精或药物滥用等依赖史者,怀孕和哺乳期妇女,近期遭遇重大精神创伤事件者。其中男11例,女14例;皆为右利手;年龄16~41 (26.16±7.75)岁;发病年龄(25.92±7.75)岁;教育年限6~16 (9.64±2.84)年;病程1~16 (3.82±3.46)个月。另选择学校、社区及体检中心招募的健康志愿者25例作为对照组,男11例,女14例;年龄18~40(26.00±6.36)岁;教育年限6~16(9.84±2.81)年;未患任何精神疾病,且精神疾病家族史阴性。2组间年龄、性别及教育程度比较差异均无统计学意义(P均>0.05)。
1.2 方法
1.2.1 临床评定 在研究对象入组后1 d内进行磁共振扫描之前,由受过专业培训的精神科医师对所有受试者进行一般情况调查,采用Annett等[10]的利手问卷进行利手评定。通过DSM-Ⅳ定式临床检查工具患者版(Structured Clinical Interview for DSM-Ⅳ Axis I Disorders, Patient Edition, SCID-P)对所有患者进行临床评估、诊断以及通过定式临床接谈工具(非患者版,SCID- NP)对所有健康志愿者进行筛查和对照入组。同时采用PANSS量表评估患者症状的严重程度[11],计算PANSS总分、阳性症状得分、阴性症状得分以及一般精神病理得分。
1.2.2 MRI数据采集 所有受试者通过配有标准头线圈的1.5T(Siemens)磁共振扫描仪采集图像,采用3D连续无间隔薄层MRI扫描方式(3D容积扫描具有分辨力高、对比度强及信噪比高等优点,在MRI体积测量中占有明显的优势,其结果也更加可靠)。受试者的3D T1WI图像通过矢状面及冠状面小角度激发快速梯度回波序列(gradient-echo sequence fast low-angle shots, FLASH )获得。扫描参数:脉冲重复时间/回波时间(TR/TE)30 ms/3 ms,偏转角(flip angle)30°,层厚(slice thickness)1.0 mm,间距0 mm,矩阵256×256,视野(field of view,FOV)240 mm×240 mm,体素大小0.898 4 mm×0.898 4 mm×1.300 0 mm。由2名放射科主治医师对所有受试者扫描图形进行肉眼评定,剔除不合格图像。
1.2.3 垂体体积测量及图像预处理 MRI数据以DICOM格式传输到MRI Convert Application 软件进行图像转换后,在MRIcron工作站对重建的连续冠状位图像(结合矢状位)沿垂体边界逐层进行手动测量,边界不包括垂体柄,但包括其后方的神经垂体(垂体后部的高信号部分)。为了减少手动测量的误差,由2位有经验的医生随机盲目测量,取其平均值,即为该例平均ROI的体素。2位测量者被随机分配的10例垂体体积的施测者间信度为0.97(通过组内相关系数评估)。大脑体积(不包括脑脊液、脑膜及其他的非脑组织)通过MATLAB7.7软件平台,并采用SPM12 (Statistical parametric mapping)将脑组织分割为脑灰质、脑白质等(含大脑、小脑、脑干)后经软件运算获得。大脑体积用来校正头围的差异。
1.3 统计学方法 采用SPSS 20.0对临床资料进行统计分析,其中垂体体积统计学差异性及相关性通过相对性体积(绝对体积/大脑体积)进行分析。计数资料采用2检验,计量资料采用t检验。组间垂体体积的差异用独立样本t检验。垂体体积与年龄、教育年限、发病年龄及病程间的相关性通过Spearman 秩相关分析。控制年龄及性别,对垂体体积与PANSS总分和各项因子分进行偏相关分析。检验水准α为0.05(双侧)。
2 结 果
2.1患者组PANSS评分 PANSS总分(87.60±11.62)分,阳性症状分(28.44±4.71)分,阴性症状分(17.48±4.55)分,一般精神病理分(41.68±6.03)分。
2.2 2组垂体体积及大脑体积比较 2组大脑体积比较差异无统计学意义;患者组垂体体积大于对照组 (P<0.05);进一步校正性别后分析发现,2组间垂体体积差异有统计学意义(F=4.208,P<0.05)。对照组女性垂体体积大于男性(P<0.05),但患者组男、女垂体体积比较差异无统计学意义(t=1.414,P>0.05)。见表1及表2。
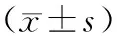
表1 2组大脑体积及垂体体积比较
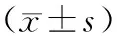
表2 2组不同性别大脑体积及垂体体积比较
2.3 垂体体积的相关性分析 Spearman 秩相关分析示患者垂体体积与其年龄(r=0.088,P=0.677)、教育年限(r=0.377,P=0.063)、发病年龄(r=0.024,P=0.908)、病程(r=0.010,P=0.963)无相关性;偏相关分析示患者垂体体积与PANSS总分存在呈正相关(r=0.454,P=0.029),而与阴性症状分(r=0.423,P=0.054)、阳性症状分(r=0.312,P=0.147)、一般精神病性症状分(r=0.260,P=0.231)各项因子分无明显相关性。
3 讨 论
垂体腺是全身内分泌腺中最复杂、最重要的一个,但它的体积最小,位于颅内底部,在蝶骨体的垂体窝中,由垂体柄将垂体腺与下丘脑相连。蝶鞍上方为视交叉及第三脑室底部,两侧与海绵窦毗邻,前下方为蝶窦所在。下丘脑是神经内分泌的高级中枢,分泌的释放因子或抑制因子作用于腺垂体,后者分泌的激素再作用于周围靶器官,三者连成具有重要调节功能的神经内分泌轴即HPA轴。中枢神经系统对神经内分泌的影响不仅从解剖学上证实,而且临床实践发现,某些精神疾病常伴发神经内分泌功能的紊乱,有内分泌异常的患者也会表现出精神活动的异常,而针对精神障碍的治疗药物同样也会导致机体内分泌状态的改变。垂体腺作为HPA轴的一部分,是人体神经内分泌系统的重要组成部分,具有维持人体内外环境相对稳定性的重要功能。但精神分裂症患者垂体腺大小及其HPA轴的活性程度与其临床症状严重程度的相关性尚不清楚。
MRI可以多方位、多参数成像,并且软组织分辨率高,能够良好显示垂体腺的形态特点,为观察研究垂体腺正常结构的最佳影像学检查方法。近年来,多项研究发现精神分裂症患者脑垂体体积增大,而且高危人群也存在垂体体积增大改变[5-7,12]。Garner等[13]还发现部分高危人群患者在患精神分裂症后垂体体积较前进一步增大。这提示垂体体积的改变可能预示着机体的应激反应,且反映了HPA轴腺体的活性。本研究发现,患者组较对照组垂体体积增大,与上述研究结果较一致。故基于目前研究发现,推测垂体体积增大的机制为:应激使HPA轴的活性增高,其增量释放应激激素(如皮质醇)反馈调节机体生理和心理性应激,维持机体处于相对稳态;当精神分裂症本身的应激障碍使HPA轴过度激活,会刺激释放促皮质激素的腺垂体细胞体积增大及细胞数量增多,从而导致促皮质激素分泌异常增多,而高水平皮质激素反过来可进一步导致精神分裂症患者垂体结构形态发生一定的相应变化。此外,临床研究发现精神分裂症患者在发病后常伴发HPA轴激素的改变,而且患者应激激素的基础分泌情况即便在缺乏阳性症状以阴性症状为主的患者中也均增高[14]。蒋昕等[15]在新入院的精神分裂症患者血清中也发现皮质激素增高。而且还有研究发现垂体的纵向体积变化与应激激素水平有关[16]。上述研究表明精神分裂症患者发作时应激激素分泌异常增多,HPA轴活性增高,进一步反映了HPA轴腺体的异常。但也有研究未发现垂体体积的组间差异,其结果的不一致性可能与精神分裂症本身的异质性、样本量及样本中年龄、性别、区域、种族以及数据分析方法和混杂因素的控制等多种因素有关。
本研究结果还发现,对照组女性垂体体积较男性大,但未发现患者组的垂体体积有性别差异,与文献[5,8,12,17]报道不一致。可能有2方面原因:一种可能是此性别差异源于患者组和对照组间本身的差异;另一种可能是垂体腺确实存在一定的性别效应。至于本研究中在各组内未发现性别差异,这可能与样本量或样本的异质性等有关;如果样本量增大可能会有统计学差异。对于精神分裂症的性别差异研究,笔者认为上述第二种可能性应该更大些,推测其可能的机制为:一方面可能是当遭遇应激情况时,女性对外界压力的反应更敏感,其腺垂体细胞对机体释放的应激反应激素也较男性更敏感,HPA轴活性较高,进而较易引起患者的垂体腺形态改变。另一方面则可能是性别差异在人类大脑发育成熟过程中的影响也是不同的。这提示激素可能是引起不同性别精神分裂症患者或正常人垂体体积差异的重要原因之一。据文献报道,性激素对大脑的发育起着至关重要的作用,尤其是形态学和神经化学[18]。而且脑垂体本身作为性腺轴的一部分,共同构成一个完整而协调的神经内分泌系统,它们有各自独特的内分泌功能,并且可能存在互相调节、互相影响的某种机制。
本研究未发现患者组垂体体积与年龄、教育年限、发病年龄、病程、阳性症状分、阴性症状分、一般精神病理分有明显相关性,与文献[5,12,17]报道基本一致。但本研究发现垂体体积与 PANSS总分呈正相关,即垂体体积越大,临床症状越严重。此外,还有研究发现应激激素水平与患者的PANSS总分、阳性症状分、 一般精神病理分呈正相关,而与阴性症状分无显著性相关[15],此研究进一步从激素水平揭示HPA轴腺体活性的异常增高与临床具体症状及其严重程度相关。
综上所述,首发未用药偏执型精神分裂症患者垂体体积有异常增大的改变,且垂体体积与患者临床精神症状及其严重程度也相关。提示患者在发病早期阶段HPA轴腺体活性增加,这可能和精神分裂症的发病机制密切相关。另外垂体体积存在一定的性别效应。但本研究也存在一定的局限性,还有待今后扩大样本量深入研究,如在测量垂体体积同时加入检测激素这一指标,并随访观察药物治疗前后垂体体积变化及其与临床症状的相关性等。
[1] Walker E,Mittal V,Tessner K. Stress and the hypothalamic pituitary adrenal axis in the developmental course of schizophrenia[J]. Annu Rev Clin Psychol,2008,4:189-216
[2] Ryan MC,Sharifi N,Condren R,et al. Evidence of basal pituitary-adrenal over activity in first episode,drug naïve patients with schizophrenia[J]. Psychoneuroendocrinology,2004,29(8):1065-1070
[3] Walsh P,Spelman L,Sharifi N,et al. Male patients with paranoid schizophrenia have greater ACTH and cortisol secretion in response to metoclopramide-induced AVP release[J]. Psychoneuroendocrinology,2005,30(5):431-437
[4] Kato K,Saeki N,Yamaura A. Morphological changes on MR imaging of the normal pituitary gland related to age and sex:main emphasis on pubescent females[J]. J Clin Neurosci,2002,9(1):53-56
[5] Takahashi T,Nakamura K,Nishiyama S,et al. Increased pituitary volume in subjects at risk for psychosis and patients with first-episode schizophrenia[J]. Psychiatry Clin Neurosci,2013,67(7):540-548
[6] Takahashi T,Zhou SY,Nakamura K,et al. Longitudinal volume changes of the pituitary gland in patients with schizotypal disorder and first-episode schizophrenia[J]. Prog Neuropsychopharmacol Biol Psychiatry,2011,35(1):177-183
[7] Buschlen J,Berger GE,Borgwardt SJ,et al. Pituitary volume increase during emerging psychosis[J]. Schizophr Res,2011,125(1):41-48
[8] Gruner P,Christian C,Robinson DG,et al. Pituitary volume in first-episode schizophrenia[J]. Psychiatry Res,2012,203(1):100-102
[9] Nicolo J,Berger G,Garner BA,et al. The effect of atypical antipsychotics on pituitary gland volume in patients with first-episode psychosis:a longitudinal MRI study[J]. Schizophr Res,2010,116(1):49-54
[10] Annett M. A classification of hand preference by association analysis[J]. Br J Psychol,1970,61(3):303-321
[11] Kay SR,Flszbein A,Opfer LA. The positive and negative syndrome scale (PANSS) for schizophrenia[J]. Schizophr Bull,1987,13(2):261-276
[12] Takahashi T,Suzuki M,Velakoulis D,et al. Increased pituitary volume in schizophrenia spectrum disorders[J]. Schizophr Res,2009,108(1/3):114-121
[13] Garner B,Pariante CM,Wood SJ,et al. Pituitary volume predicts future transition to psychosis in individuals atultra-high risk of developing psychosis[J]. Biol Psychiatry,2005,58(5):417-423
[14] Bradley AJ,Dinan TG. A systematic review of hypothalamic-pituitary-adrenal axis function in schizophrenia:implications for mortality[J]. J Psychopharmacol,2010,24(4 Suppl):91-118
[15] 蒋昕,纪家武,陈红岩,等. 精神分裂症下丘脑-垂体-肾上腺素功能研究[J]. 临床精神医学杂志,2008,18(5):292-294
[16] Walker EF,Brennan PA,Esterberg M,et al. Longitudinal changes in cortisol secretion and conversion to psychosis in at-risk youth[J]. J Abnorm Psychol,2010,119(2):401-408
[17] Romo-Nava F,Hoogenboom WS,Pelavin PE,et al. Pituitary volume in schizophrenia spectrum disorders[J]. Schizophr Res,2013,14(1/3):301-307
[18] Mc-Ewen BS. Invited review:Estrogens effects on the brain: Multiple sites and molecular mechanisms[J]. J Appl Physiol,2001,91(6):2785-2801
Study of pituitary volume in first-episode and paranoid schizophrenia
CHEN Jinwei1,2, JI Bin2, MEI Wei3, WU Qiulin4, ZHANG Hanxi1,2, LIN Wenxia1,2, XIAO Zhuangwei1,4
(1.Medical College of Shantou University, Shantou 515041, Guangdong, China; 2.The Second People’ Hospital of Shantou, Shantou 515041, Guangdong, China; 3.The first Affiliated Hospital of Medical College of Shantou University, Shantou 515041, Guangdong, China; 4.Guangdong Province Key Laboratory of Medical Molecular Imaging, Shantou 515041, Guangdong, China)
Objective It is to approach the changes of pituitary volume in first-episode and paranoid schizophrenia patients (FEPS) not treated with antipsychotic drugs. Methods A sample of 25 FEPS and 25 cases with age-years of received education and sex-matched healthy controls were scanned by 1.5T Three-dimensional Magnetic Resonance Imaging. The pituitary volume and intracranial volume were measured respectively by applying MRIcro and MATLAB software. Symptoms were assessed using the Positive and Negative Syndrome Scale (PANSS). The differences between two groups were compared and the correlation of pituitary volume with age, age of education, age of onset, duration of disease, and score of PANSS was also analyzed.Results Compared with healthy controls, FEPS showed a larger pituitary volume (P<0.05), and the pituitary tumor volume of the female was significantly higher than that of the male in control group. Partial correlation analysis showed, pituitary volume was significantly correlated with PANSS scores (r=0.454,P=0.029),and no association with other clinical variables (P>0.05). Conclusion The pituitary volume in FEPS not treated with antipsychotic drugs has change of abnormal increase, and it related to the clinical symptom severity. It suggesting that the gland of hypothalamus pituitary adrenal axis in patients has stress response susceptibility in the early stage, these abnormal changes may be related to the mechanism of the spirit of schizophrenia. Pituitary volume may have sex effect.
first-episode schizophrenia; hypothalamic-pituitary-adrenal axis; pituitary volume; magnetic resonance imaging
陈金卫,男,在读硕士研究生,医师,研究方向为MR脑功能成像。
肖壮伟,E-mail:xiaozw@vip.163.com
国家自然科学基金面上项目(30670598)
10.3969/j.issn.1008-8849.2015.24.002
R749.3
A
1008-8849(2015)24-2626-04
2015-03-20
