无创呼吸机对AECOPD呼吸衰竭患者血气指标及炎性指标的影响
2015-02-07李锋
李 锋
(广西容县人民医院,广西 容县 537500)
无创呼吸机对AECOPD呼吸衰竭患者血气指标及炎性指标的影响
李 锋
(广西容县人民医院,广西 容县 537500)
[摘要]目的 探讨无创呼吸机对慢性阻塞性肺疾病急性发作伴呼吸衰竭患者血气指标及炎性指标的影响。方法 将160例慢性阻塞性肺疾病急性发作伴呼吸衰竭患者随机分为对照组和观察组,每组80例。对照组给予常规治疗,观察组在常规治疗基础上辅以无创呼吸机治疗。观察2组治疗前后血气指标及炎性指标白细胞介素-8(IL-8)的变化情况。结果 治疗后2组患者心率、呼吸频率、p(CO2)均明显下降(P均<0.05),p(O2)和Sa(O2)均明显上升(P均<0.05),且观察组比对照组下降或上升更显著(P均<0.05)。治疗后,2组患者血清和痰液中IL-8水平明显降低,且观察组比对照组下降显著(P<0.05)。观察组并发症发生率明显低于对照组(P<0.05)。结论 无创呼吸机在降低心率、呼吸频率及IL-8水平,提高氧分压和血氧饱和度,改善高碳酸血症、酸中毒症状方面效果显著,可作为AECOPD呼吸衰竭一线治疗方法加以推广。
无创呼吸机;AECOPD;呼吸衰竭;血气指标
慢性阻塞性肺疾病(chronicobstructivepulmonarydisease,COPD)是因气道受限导致气流异常的慢性疾病,是一种常见的呼吸系统疾病,患病率和病死率均很高[1]。COPD常因感染引起急性发作(AECOPD),使气流阻塞进一步加重,加之患者呼吸肌疲劳,极易引发Ⅱ型呼吸衰竭,因此呼吸衰竭是AECOPD常见的并发症,不仅严重降低了患者生活质量,甚至危及生命。临床上治疗的首要任务是给予控制性氧疗和机械通气[2]。机械通气分为无创通气和有创通气,有创通气疗效显著,但是存在恢复慢、并发症发生率高、费用高、顺应性低等缺点[3]。与之相比,无创通气具有显著优势,因此笔者就无创呼吸机对AECOPD呼吸衰竭患者血气指标及炎性指标的影响进行了研究,现将结果报道如下。
1 临床资料
1.1一般资料 选择2013年4月—2014年8月我院收治的AECOPD伴呼吸衰竭患者共160例,患者均需符合AECOPD合并Ⅱ型呼吸衰竭的诊断标准[4],均有完整和详细的诊治资料;患者出现中重度呼吸困难症状,同时伴有辅助呼吸肌参与呼吸的症状,出现胸腹矛盾呼吸运动;患者神志清醒,无精神疾病史;所有患者均签署知情同意书。排除患有免疫功能缺陷疾病、恶性肿瘤、肝肾功能不全者,血流动力学不稳定者,上气道阻塞或有创伤者,气道保护能力较差者。随机分为2组:对照组80例,男46例,女34例;年龄47~81(58.9±6.1)岁;患病时间3~29(10.3±2.3)年。观察组80例,男45例,女35例;年龄45~82(60.1±7.2)岁;患病时间3~31(12.1±5.9)年。2组患者的性别比例、年龄、患病时间比较差异均无统计学意义(P均>0.05),具有可比性。
1.2治疗方法
1.2.1对照组 给予常规心电监护、吸氧、抗感染治疗,出现突发性喘症时予解痉平喘治疗,排痰不畅者给予化痰治疗。
1.2.2观察组 在常规治疗基础上,采用双相气道正压通气(BiPAP)无创呼吸机通气治疗,均使用平台型呼气阀,口鼻面罩,S/T模式。氧流量1.5~2.5L/min,初始吸气压力(IPAP)8~10cmH2O(1cmH2O=0.098kPa),呼气压力(EPAP)4~6cmH2O。根据患者呼吸状况和血气指标进行调整,IPAP逐渐增至14~24cmH2O,EPAP逐渐增至8~10cmH2O。持续使用至病情好转,氧饱和度>90%,气道峰压控制在30cmH2O以下。每次辅助通气时间3h,每天通气时间6~20h。面罩及鼻罩保持良好气密性和舒适度。
1.3观察指标 治疗前及治疗1d后,检测并记录患者心率(HR)和呼吸频率(RR)。采用M78162血气分析仪对所有患者进行血气分析,详细记录患者血液pH、p(O2)、p(CO2)、Sa(O2)。治疗前及治疗1周后,静脉取血2mL,静置后离心,取血清使用ELISA法检测IL-8含量。同时收集患者痰液于洁净培养皿中,取1mL痰液于离心试管中,加入4mL1%DTT,涡旋震荡5min,4 ℃下3 000r/min离心20min,取上清检测IL-8含量。观察并统计2组患者治疗后并发症发生情况。

2 结 果
2.12组治疗前后心率、呼吸频率及血气指标比较 2组治疗前心率和呼吸频率比较差异无统计学意义(P均>0.05)。治疗后2组患者心率和呼吸频率均明显下降(P均<0.05),且观察组比对照组下降更显著(P均<0.05)。2组治疗前p(O2)、p(CO2)、血液pH、Sa(O2)比较差异均无统计学意义(P均>0.05),治疗后2组患者血氧指标均有明显改善(P均<0.05),且观察组改善更明显(P均<0.05)。见表1。
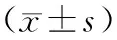
表1 2组治疗前后心率、呼吸频率及血气指标比较
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05;1 mmHg=0.133 kPa。
2.22组治疗前后血清和痰液中IL-8水平比较 治疗前2组血清和痰液中IL-8水平比较差异无统计学意义(P均>0.05)。治疗后2组血清和痰液中IL-8水平均明显下降(P均<0.05),且观察组比对照组下降更显著(P<0.05)。见表2。

表2 2组治疗前后血清和痰液中IL-8水平比较
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
2.3并发症 对照组出现嗜睡3例,血CO2潴留3例,气胸2例,胃溃疡2例,心律失常2例,并发症发生率为18%;观察组出现气胸2例,胃溃疡1例,低氧血症1例,并发症发生率为5%。2组比较差异有统计学意义(2=6.260,P<0.05)。
3 讨 论
持续性气流受限是COPD患者最主要的病理特征,病情加重会逐渐出现营养不良、肌力减退、肺动脉高压等系统性损伤。由于营养不良、缺氧、长期使用激素药物外加感染常会引起急性发作[5]。AECOPD患者肺部结构出现病理改变,气道闭塞、阻力增大,因而易引发呼吸衰竭,这是AECOPD患者死亡的一个主要原因[6]。该病目前无法彻底根治,常规药物治疗起效慢、不良反应较大,且部分患者效果不明显。在药物治疗基础上使用机械通气,可迅速缓解呼吸肌疲劳,增加肺泡通气,有效降低p(CO2),从而迅速解除患者呼吸中枢抑制状态,减轻缺氧对身体器官的损伤。英国胸科协会 BTS(2002)建议AECOPD患者首选BiPAP无创呼吸机治疗[7]。无创呼吸机机械通气治疗的成功与否主要根据血气指标判断,理想的治疗效果是患者的心率下降、血氧上升、CO2潴留消失[8]。
AECOPD患者一般存在比较严重的高碳酸血症,即血气指标中p(CO2)大于90 mmHg,由于CO2浓度较高,同时会伴有酸中毒症状,即血液pH小于7.1[9]。对于AECOPD患者,尤其是合并呼吸衰竭者,单纯给予鼻导管吸氧不能有效改善患者呼吸状况,甚至有部分患者经鼻导管吸氧后反而使p(CO2)进行性升高。无创呼吸机在减轻呼吸肌疲劳、改善肺通气方面具有很好的效果[10]。本研究结果显示,2组治疗后p(CO2)均明显降低,p(O2)和Sa(O2)显著上升,且观察组各指标改善情况均低于对照组。血pH值检测结果也验证了这个结论。
AECOPD的发生多与气道的异常炎症反应相关,涉及多种炎症递质。IL-8主要是由气道上皮细胞、肺泡巨噬细胞、淋巴细胞、中性粒细胞等分泌的一种环氧酶趋化因子,其表达水平可能与COPD患者肺部功能改变相关。本研究发现,AECOPD患者治疗前血清和痰液中IL-8水平非常高,治疗后,2组患者血清和痰液中IL-8水平都显著下降,且治疗后观察组显著低于对照组。说明IL-8在AECOPD发病过程中起到重要作用。
综上,无创呼吸机在降低心率、呼吸频率及IL-8水平,提高p(O2)和Sa(O2),改善高碳酸血症、酸中毒症状方面效果显著,可作为AECOPD呼吸衰竭一线治疗方法加以推广。
[1] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2007 年修订版)[J]. 中华结核和呼吸杂志,2007,30(1):8-17
[2] 曾勉,刘凌云,张式鸿,等. 各期慢性阻塞性肺疾病患者诱导痰细胞成分与肺功能的关系[J]. 中山大学学报:医学科学版,2007,28(4):422-425
[3] 刘东丽,余健民. 慢性阻塞性肺疾病( COPD) 管理软件的应用研究[J]. 江西医药,2010,45(1):5-7
[4] 聂涛. 无创持续气道正压通气治疗COPD患者的护理问题与措施[J]. 护理学杂志,2009,24(19):35-36
[5] 钱利华. BIPAP无创呼吸机治疗慢性阻塞性肺疾病合并Ⅱ型呼吸衰竭疗效观察[J]. 临床肺科杂志,2013,18(12):2243-2244
[6] 廖建章,连炯城,林永平. BIPAP呼吸机治疗Ⅱ型呼衰疗效观察[J]. 临床肺科杂志,2006,11(3):314
[7] 刘峰,乔岩,黄光湖,等. 无创机械通气在老年慢性阻塞性肺病中的实施效果分析[J]. 实用临床医药杂志,2012,16(13):93-94;97
[8] Ambrosino N. Noninvasive mechanical ventilation in acute respiratory failure[J]. Eur Res Pir J,2006,9(4):795-807
[9] Casamova C,Barto lome R,Celu L T,et al. Long-term controlled trail of nocturnal nasal positive pressure ventilation in patients with severe COPD[J]. Chest,2000,118:1582-1590
[10] Louis Anthony (Tony) Cox. A causal model of chronic obstructive pulmonary disease (COPD) risk[J]. Risk Analysis,2011,31(1):38-62
10.3969/j.issn.1008-8849.2015.26.034
R563.3
B
1008-8849(2015)26-2941-02
2015-03-10
