健脾补肾方对辐射损伤小鼠β-catenin、TCF及PPARγ蛋白表达的影响
2015-02-07何东初肖静静丁晓娟
何东初,肖静静,张 勇,林 慧,丁晓娟,涂 颖
(广州军区武汉总医院,湖北 武汉430070)
论 著
健脾补肾方对辐射损伤小鼠β-catenin、TCF及PPARγ蛋白表达的影响
何东初,肖静静,张 勇,林 慧,丁晓娟,涂 颖
(广州军区武汉总医院,湖北 武汉430070)

[摘要]目的 研究健脾补肾方对辐射损伤模型小鼠β-链蛋白(β-catenin)、T细胞因子(TCF)及过氧化酶体增殖物激活受体γ(PPARγ)蛋白表达的影响,探讨其对造血功能的调控机制。方法 采用6.0 Gy X射线照射建立辐射损伤模型小鼠,然后将造模成功小鼠随机分为模型组、健脾补肾方小剂量组(100%浓度)、健脾补肾方大剂量组(200%浓度)、阿胶浆组,每组12只。另随机选取12只正常小鼠作为正常组。正常组、模型组给予生理盐水0.2 mL/10 g灌胃,2次/d,其余3组分别用健脾补肾方小剂量、大剂量和阿胶浆混悬液0.2 mL/10 g灌胃,2次/d。9 d后处死小鼠,取血检测外周血白细胞计数,收集骨髓检测β-catenin、TCF及PPARγ蛋白表达情况,制作骨髓病理切片观察骨髓病理改变情况,测定脂肪空泡面积。结果 模型组外周血白细胞计数及β-catenin、TCF蛋白表达量明显低于正常组(P均<0.05),PPARγ蛋白表达量及骨髓脂肪空泡面积均明显高于正常组(P均<0.05);健脾补肾方小剂量组、健脾补肾方大剂量组、阿胶浆组外周血白细胞计数及β-catenin、TCF蛋白表达量均明显高于模型组(P均<0.05),PPARγ蛋白表达量及骨髓脂肪空泡面积均明显低于模型组(P均<0.05),尤以小剂量组明显。结论 健脾补肾方可通过增强β-catenin/TCF通路的转导,抑制下游靶基因PPARγ的表达,从而抑制骨髓脂肪化,促进骨髓造血功能的重建。
健脾补肾方;辐射损伤;β-catenin;TCF;PPARγ;动物模型
随着高科技和现代化工业的发展,辐射损伤已成为危害人们健康的重要因素,辐射引起的骨髓抑制严重影响患者的生存质量[1]。目前治疗辐射损伤多以直接刺激造血细胞增殖为靶点,而对改善辐射引起的骨髓微环境损伤研究较少。骨髓脂肪化是辐射损伤后造血微环境的主要病理变化,骨髓中脂肪组织影响造血微环境的正常造血支持功能,直接抑制原始造血细胞的增殖,从而抑制骨髓造血[2]。而抑制骨髓脂肪细胞形成,改善辐射后造血微环境可促进造血重建。健脾补肾方(既往称地甘口服液)是我院治疗辐射损伤的经验方,前期临床试验表明该方能提高外周血象,增强机体免疫功能;前期动物实验从造血细胞的增殖、骨髓及脾脏相关凋亡基因表达等方面阐述了健脾补肾方对小鼠辐射损伤的保护作用机制[3-7]。本研究观察了健脾补肾方对辐射损伤小鼠骨髓脂肪化及造血功能的影响,旨在探讨其可能的分子机制,为恢复辐射损伤后造血功能提供新的治疗途径。
1 实验资料
1.1实验动物 选取清洁级昆明种小鼠60只,体质量(18±22)g,雌雄兼用,由湖北省实验动物研究中心提供,动物合格证号:42000600004104。
1.2药物制备 健脾补肾方由熟地黄30 g、炙甘草15 g、当归30 g、黄芪30 g、泽泻9 g、陈皮10 g组成,由医院制剂室制备,经水煎、过滤、浓缩后,制成100%(每毫升含生药1 g)和200%(每毫升含生药2 g)的药液,分装备用。阿胶浆由东阿阿胶提供,批号:20101008。
1.3主要试剂 β-链蛋白(β-catenin)、T细胞因子(TCF)及过氧化酶体增殖物激活受体γ(PPARγ)抗体购自Santacuz公司;羊抗小鼠二抗、羊抗兔二抗、β-actin抗体购自武汉博士德生物工程有限公司;ECL底物液购自Thermo公司;RIPA裂解液购自碧云天公司;PVDF膜购自Millipore公司。DYCZ-40型电转仪购自北京六一公司。
1.4造模及分组 60只小鼠适应性喂养1周,随机选择12只作为正常组,其余小鼠采用一次性给予直线加速器6.0 Gy X射线全身照射,剂量率为450仑,照射9 d。造模成功标准为小鼠食欲下降、活动减少、白细胞计数明显下降。按随机数字表法将造模成功小鼠分为模型组、健脾补肾方小剂量组(小剂量组,100%浓度)、健脾补肾方大剂量组(大剂量组,200%浓度)、阿胶浆组。正常组、模型组给予生理盐水0.2 mL/10 g灌胃,其余3组分别用健脾补肾方小剂量、大剂量和阿胶浆混悬液0.2 mL/10 g灌胃,均2次/d。于灌胃第9天处死小鼠,收集外周血、双侧股骨、胫骨骨髓进行相关检测。
1.5骨髓病理切片制作及HE染色 将小鼠双侧股骨置于4%的盐酸甲醛脱钙固定液中,常规脱水,石蜡包埋,切片,HE染色,然后在显微镜下观察骨髓造血组织情况并摄像。骨髓腔内脂肪空泡面积比例计算方法:骨髓切片置于100倍高倍镜下,每组选取20个骨髓腔视野,采用PAS-8000病理图像分析系统计算各组脂肪空泡面积比例。
1.6β-catenin、TCF及PPARγ蛋白表达检测 采用Western蛋白电泳法检测。胫骨骨髓组织块称质量,加入RIPA裂解液匀浆组织,移入离心管4 ℃ 10 000 r/min离心5 min,取上清,分装于-20 ℃保存;采用Bradford比色法测定蛋白质浓度;取相同质量的细胞裂解液(体积×蛋白质浓度),并加等体积的2×电泳加样缓冲液,沸水浴中3 min,上样,电泳(浓缩胶20 mA,分离胶35 mA),电转膜仪转膜,用含5%脱脂奶粉的TBST(封闭液)室温封闭2 h,用稀释好的一抗4 ℃孵育过夜,用稀释好的HRP标记二抗室温孵育2 h。使用 HRP 标记的抗小鼠GAPDH特异性抗体作为内参对照检测。ECL底物液显现荧光条带,X射线胶片曝光显影。
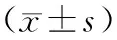
2 结 果
2.1各组小鼠外周血白细胞计数比较 正常组、模型组、小剂量组、大剂量组和阿胶浆组外周血白细胞计数分别为(8.05±0.619)109L-1、(1.70±0.400)109L-1、(6.18±0.692)109L-1、(3.34±0.354)109L-1、(3.29±0.442)109L-1。模型组白细胞计数明显低于正常组(P<0.05),小剂量组、大剂量组、阿胶浆组白细胞计数明显高于模型组(P均<0.05),且小剂量组明显高于大剂量组和阿胶浆组(P均<0.05)。
2.2各组β-catenin、TCF及PPARγ蛋白表达情况 模型组β-catenin、TCF蛋白表达量明显低于正常组(P均<0.05),PPARγ蛋白表达量明显高于正常组(P<0.05)。小剂量组、大剂量组、阿胶浆组β-catenin、TCF蛋白表达量明显高于模型组(P均<0.05),PPARγ蛋白表达量明显低于模型组(P<0.05);小剂量组β-catenin、TCF蛋白表达量明显高于大剂量组和阿胶浆组(P均<0.05),PPARγ蛋白表达量明显低于大剂量组和阿胶浆组(P均<0.05)。见表1及图1。
2.3各组小鼠骨髓脂肪面积比较 正常组、模型组、小剂量组、大剂量组和阿胶浆组骨髓脂肪面积分别为(1.99±0.01)%,(17.72±0.05)%,(10.76±0.05)%,(13.21±0.04)%,(14.19±0.06)%。模型组骨髓脂肪空泡面积明显多于正常组(P<0.05)。小剂量组、大剂量组、阿胶浆组骨髓脂肪空泡面积明显少于模型组(P均<0.05),且小剂量组明显少于大剂量组和阿胶浆组(P均<0.05)。各组小鼠骨髓病理变化见图2~6。
3 讨 论
机体正常造血的维持由造血细胞和骨髓微环境相互调控、相互作用。造血微环境对造血细胞功能的发挥起支持作用[8-9]。而脂肪细胞是骨髓微环境中负性调控造血的主要因子,抑制骨髓脂肪形成能够促进造血功能的重建[10]。
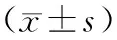
表1 各组β-catenin、TCF及PPARγ蛋白表达情况
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05;③与小剂量组比较,P<0.05。

图1 Wertern blot检测各组小鼠蛋白表达情况

图2 正常组小鼠骨髓病理变化(HE染色×100)
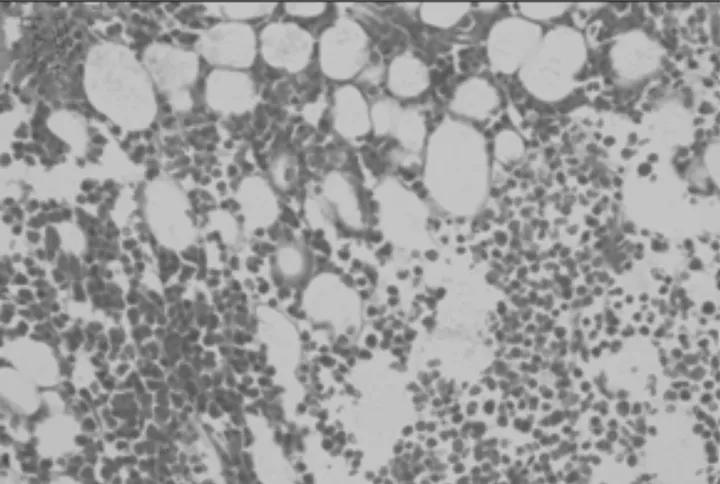
图3 模型组小鼠骨髓病理变化(HE染色×100)
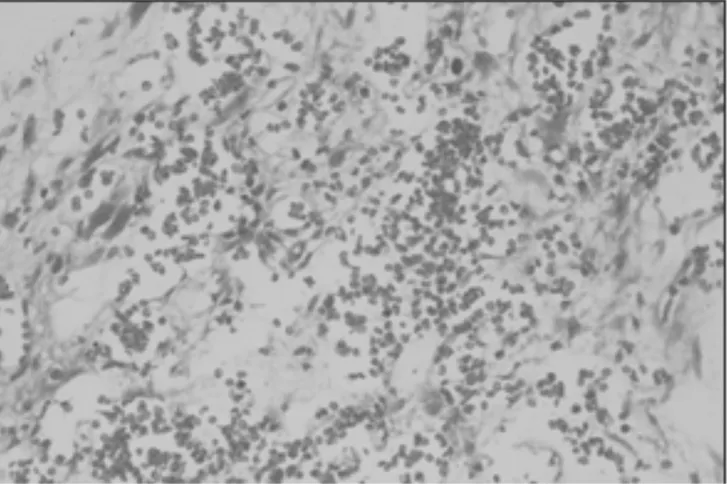
图4 小剂量组小鼠骨髓病理变化(HE染色×100)
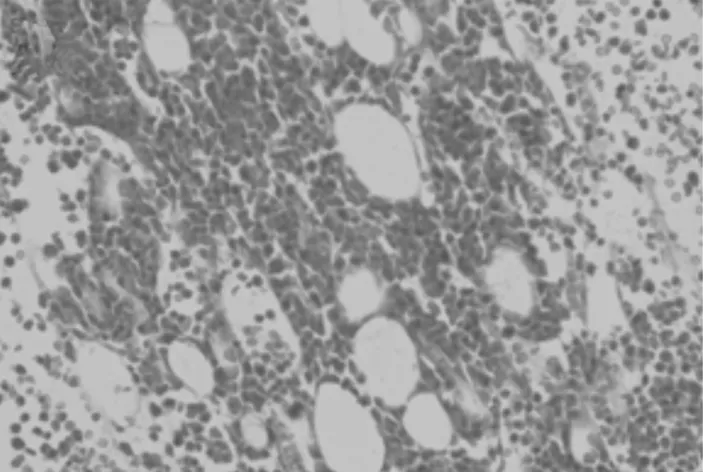
图5 大剂量组小鼠骨髓病理变化(HE染色×100)

图6 阿胶浆组小鼠骨髓病理变化(HE染色×100)
β-catenin是经典Wnt/β-catenin通路的核心成员,参与调解骨髓的成脂分化。当没有Wnt信号时,胞内的β-catenin被细胞质中的糖原合成酶激酶3β(GSK3β)磷酸化,进而被多功能复合物降解。有Wnt信号时,胞浆内的β-catenin聚积,并转入核内,通过影响核内TCF/LEF转录因子而发挥作用[11]。PPARγ是激素核受体超家族成员之一,主要在脂肪细胞表达,是诱导脂肪细胞特异性基因表达和调节脂肪分化的重要转录因子[12]。研究表明,PPARγ是Wnt/β-catenin信号通路的调控成脂分化的主要因子,受TCF/LEF家族调控。PPARγ的表达水平可作为脂肪化进程的特异性指标[13]。
辐射损伤属中医的“虚劳”“血虚证”等范畴,其治疗当以“虚则补之”为原则。健脾补肾方采用熟地滋肾养阴,填精益髓;甘草补益脾气,益气复脉;当归补血活血,益气和营,使气血各有所归;黄芪补脾肺之气,以益生血之源;泽泻宣泄肾浊,引药归经;陈皮理气健脾,行气导滞,可防止补益药之滋腻。诸药配伍,共奏益气健脾补肾、滋阴养血、补肾益髓之功。现代药理学研究表明,熟地黄对药物及辐射所致骨髓抑制的小鼠造血功能恢复有重要作用,能明显促进造血干细胞的增殖[14-15]。当归多糖对小鼠造血干细胞、小鼠与人髓系造血祖细胞的增殖分化有显著促进作用,特别是外周血细胞减少和骨髓受到抑制时尤为明显[16-17]。当归多糖还可调节造血微环境,从而促进造血细胞增殖。黄芪能明显提高外周血水平,促进造血细胞因子的分泌,刺激造血系统的功能,改善化疗和放疗引起的骨髓抑制状态[18-19]。综上所述,健脾补肾方具有促进造血细胞增殖和调节免疫功能的双重作用。
本研究通过6.0 Gy X射线辐射建立小鼠骨髓损伤模型,经辐射后小鼠出现外周血白细胞计数减低、骨髓脂肪化改变,说明6.0 Gy X射线辐射后可以成功造模。用健脾补肾方灌胃干预后,小鼠外周血白细胞计数增高,表明健脾补肾方对辐射损伤小鼠的造血组织具有一定的保护作用;骨髓切片发现健脾补肾方能够抑制辐射后小鼠骨髓脂肪化,改善造血微环境;Western-blot检测结果显示,健脾补肾方通过促进β-catenin、TCF蛋白的表达,增强β-catenin/TCF的转导,活化Wnt信号通路,抑制下游转录因子PPARγ的表达,抑制骨髓脂肪化,促进骨髓造血功能的重建,且健脾补肾方小剂量组各指标改善情况优于大剂量组,可能与健脾补肾方中大剂量熟地黄、甘草滋腻之性阻碍胃肠道吸收有关,其具体机制有待进一步研究。
[1] Kim K,McBride WH. Modifying radiation damage[J]. Current Drug Targets,2010,11(11):1352
[2] Naveiras O,Nardi V,Wenzel PL,et al. Bone-marrow adipocytes as negative regulators of the haematopoietic microenvironment[J]. Nature,2009,460(7252):259-263
[3] He D,Xiao J,Zhang Y,et al. Effect of the Jianpi Bushen Prescription on the expression of SHP-1, Wnt3a, and AP-1 proteins in chemically damaged mice[J]. Genet Mol Res,2013,13(2):3201-3208
[4] He D,Xiao J,Zhang Y,et al. Effect of the Jianpi Bushen Prescription on expressions of the Wnt3a and Cyclin D1 genes in radiation-damaged mice[J]. Genet Mol Res,2013,12(4):4137
[5] 何东初,吴江平,陈如泉. 血虚证患者凋亡相关基因的表达及中药的影响[J]. 中医杂志,2005,46(9):692-694
[6] 何东初,王晓红,吴江平,等. 地甘口服液对环磷酰胺所致小鼠脾组织凋亡及相关基因mRNA表达的影响[J]. 中国中医药信息杂志,2004,11(5):395-396
[7] 何东初,王晓红,何辉,等. 地甘口服液对辐射损伤小鼠细胞周期及凋亡相关基因的影响[J]. 中华放射医学与防护杂志,2004,23(6):432-434
[8] Sugiyama T,Nagasawa T. Bone marrow niches for hematopoietic s-tem cells and immune cells[J]. Inflamm Allergy Drug Targets,2012,11(3):201
[9] Chitteti BR,Cheng YH,Poteat B,et al. Impact of interactions of cellular components of the bone marrow microenvironment on hematopoietic stem and progenitor cell function[J]. Blood,2010,115(16):3239-3248
[10] Poncin G,Beaulieu A,Humblet C,et al. Characterization of spontaneous bone marrow recovery after sublethal total body irradiation:importance of the osteoblastic/adipocytic balance[J]. PLoS One,2012,7(2):e30818
[11] Oh I. Microenvironmental targeting of Wnt/beta-catenin signals for hematopoietic stem cell regulation[J]. Expert Opin Biol Ther, 2010,10(9):1315-1329
[12] Lee JE,Ge K. Transcriptional and epigenetic regulation of PPARγ expression during adipogenesis[J]. Cell Biosci,2014,4:29
[13] Okamura H,Yoshida K,Teramachi J,et al. Reduction of PP2A Cα stimulates adipogenesis by regulating the Wnt/GSK-3β/β-catenin pathway and PPARγ expression[J]. Biochim Biophys Acta,2014,1843(11):2376-2384
[14] 朱敏,段金廒,唐于平,等. 采用化学药物联合致小鼠血虚模型评价四物汤及其配伍组成的作用特点[J]. 中国中药杂志,2011,36(18):2543-2547
[15] 朱妍,徐畅. 熟地黄活性成分药理作用研究进展[J]. 亚太传统医药,2011,7(11):173-175
[16] Chen XP,Xiao XF,Zhang LL,et al. Phytochemical and pharmacological studies on Radix Angelica sinensis[J]. Chin J Nat Med,2013,11(6):577-587
[17] 何晓莉,张雁,吴宏,等. 当归多糖对辐射损伤小鼠造血系统保护作用的研究[J]. 重庆医学,2013,41(35):3734-3736
[18] Jiang Q,Xiao B,Liu C,et al.Astragalus Polysaccharide has hematopoietic and thrombopoietic activities in an irradiation mouse model[J]. Blood,2013,122(21):4216
[19] 左军,张文钊,胡晓阳,等. 黄芪现代药理及临床研究进展[J]. 中医药信息,2014(1):111-112
Effect of Jianpi Bushen Prescription on expressions of β-catenin, TCF and PPARγ proteins in radiation-damaged mice
HE Dongchu, XIAO Jingjing,ZHANG Yong, LIN Hui, DING Xiaojuan, TU Ying
(Wuhan General Hospital of Guangzhou Military Region, Wuhan 430070, Hubei, China)
Objective It is to investigated the effect of Jianpi Bushen Prescription (JBP) on the expression of β-catenin, TCF and PPARγ proteins in radiation-damaged mice and explore the regulating mechanism on hematopoietic function. Methods The mouse models of radiation damage were established by 6.0 Gy X-rays radiation exposure for 9 days. Then the successful models of mice were randomly divided into model group, low-dose (100%) JBP group, high-dose (200%) JBP group, compound e-jiao slurry (EJS) group, each group had 12 mice. Another 12 normal mice were selected as normal group. The normal group, model group was given normal saline 0.2 mL/10 g by gavage twice per day, the other three groups were respectively given low-dose JBP, high-dose JBP, EJS 0.2 mL/10 g by gavage twice per day. After 9 days, the mice were killed to get their blood to determine peripheral white blood cells, the expressions of β-catenin, TCF and PPARγ proteins were detected in bone marrow, pathological section of bone narrow was made to observe the changes of pathology, and the proportion of adipocyte area were measured. Results After irradiation, the number of white blood cells decreased obviously, the protein expression of β-catenin, TCF proteins were significantly downregulated, the protein expression of PPARγ protein was significantly upregulated and the percentage of adipocyte area was increased,in the model group compared to the control group (P<0.05). The low dose JBP, high dose JBP, and e-jiao slurry treatments significantly upregulated the protein expression of β-catenin, TCF proteins and downregulated the protein expression of PPARγ protein, the percentage of adipocyte area was reduced compared to the model group (P<0.05), with the low dose JBP producing the best results. Conclusion JBP plays a protective role on bone narrow hematopoietic function through the activation of the β-catenin/TCF signaling pathway, and inhibited adipogenesis by redcucing the expression of PPARγ.
Jianpi Bushen Prescription; radiation-damage; β-catenin;TCF;PPARγ; mice model
何东初,男,主任医师,硕士生导师,从事风湿病研究工作。
肖静静,E-mail:xjj5220@sina.com
国家自然科学基金资助项目(81273905)
10.3969/j.issn.1008-8849.2015.26.001
R-332
A
1008-8849(2015)26-2851-04
2015-01-05
