贝伐单抗联合顺铂治疗非小细胞肺癌恶性胸腔积液的临床研究
2015-02-07曲博姜威周志明
曲博,姜威,周志明
(沈阳医学院附属中心医院胸外科,沈阳 110024)
·论著·
贝伐单抗联合顺铂治疗非小细胞肺癌恶性胸腔积液的临床研究
曲博,姜威,周志明
(沈阳医学院附属中心医院胸外科,沈阳 110024)
目的观察贝伐单抗联合顺铂胸腔内灌注治疗非小细胞肺癌恶性胸腔积液的疗效和安全性。方法63例伴有恶性胸腔积液的非鳞性非小细胞肺癌患者,随机分为贝伐单抗联合顺铂组(A组,n=32)和顺铂组(B组,n=31),A组胸腔内注入贝伐单抗(5 mg/kg)+顺铂(40 mg/m2),1次/周,共3周期;B组单用顺铂注入,剂量及次数同A组。收集2组治疗前和治疗后各周期胸腔积液,胸水中VEGF水平用ELISA法测定。观察其疗效及不良反应,并进行随访。结果在可评价的63例患者中,A组、B组有效率分别为84.3%、61.3%,差异有统计学意义(P<0.05),但2组总生存期(OS)差异无统计学意义(13.0月vs 12.0月,P>0.05)。经胸腔内给药后,2组胸腔积液VEGF水平均明显下降,A组VEGF下降更为显著(P<0.05),2组无效患者胸水VEGF水平差异无统计学意义(P=0.079)。2组患者Ⅲ级和Ⅳ级不良反应无明显差异,治疗过程中患者耐受良好。结论贝伐单抗联合顺铂胸腔内灌注治疗非小细胞肺癌恶性胸腔积液有效且安全,患者耐受性良好,胸水VEGF表达水平对于预测贝伐单抗局部治疗疗效仍需进一步研究。
非小细胞肺癌;恶性胸腔积液;血管内皮生长因子;贝伐单抗
恶性胸腔积液(malignant pleural effusion,MPE)的病因以肺癌最多见[1],占37%,出现恶性胸水时病变多已进入晚期,常提示预后不良,大量胸水会严重影响患者的呼吸、循环功能以致影响生存质量。临床上恶性胸水患者多是高龄、营养状态差者,因此无法耐受全身化疗及放射治疗。因胸腔内局部给药较全身化疗不良反应小、疗效较确切,所以是目前治疗恶性胸腔积液的常见手段。以往顺铂为胸腔内化疗的常用药物,其疗效在大量的临床实践中得到了证实[2],但是胸腔内化疗只能穿透肿瘤几毫米[3],效果令人失望。近来研究发现血管内皮生长因子(vascular endothelial growth factor,VEGF)与肿瘤生长、浸润、转移密切相关,并且在恶性胸水中高度表达,通过重组人源化VEGF抗体贝伐单抗联合化疗药物已证明能抑制恶性胸腔积液的产生[4],本研究比较贝伐单抗联合顺铂与单用顺铂胸腔内灌注治疗非小细胞肺癌MPE的疗效和安全性。
1 材料与方法
1.1 病例资料
选取2010年6月至2013年4月我院收治非小细胞肺癌合并MPE 63例患者,男36例,女27例;年龄65~78岁,平均73.4岁;所有患者KPS评分>70分,预计生存期>3个月,均无化疗禁忌证,胸腔积液中等~大量,其中54例经胸水查脱落细胞证实细胞类型为腺癌的MPE,其余9例胸水细胞未能明确病理类型,但胸腔积液中CEA及VEGF显著增高,高度考虑腺细胞癌,所有患者治疗前胸腔内未注射过其他抗肿瘤药物或生物制剂,本试验经医院伦理委员会审批同意,所有患者均签署知情同意书。将63例患者随机分为2组,贝伐单抗联合顺铂(A组)32例,顺铂组(B组)31例,其中A组11例、B组8例既往接受过静脉化疗,2组的一般资料具有可比性,见表1。本实验按随机对照临床研究设计,研究终点为总生存期。

表1 患者的一般资料比较Tab.1 General data of patients
1.2 方法
1.2.1 治疗方案:所有患者经胸腔积液B超定位后于胸腔置入中心静脉导管引流,2~3 d内尽可能引流胸腔积液。A组使用贝伐单抗(5 mg/kg)[17,18,23]+生理盐水(20 mL),顺铂(40 mg/m2)+生理盐水(50 mL)经中心静脉导管胸腔内注射,B组单用顺铂,剂量同A组,2组化疗前均胸腔内注射地塞米松(10 mg)+利多卡因(200 mg)抑制炎性反应及麻醉胸膜止痛,注射药物后2 h内每15 min变换1次体位,48 h后开放引流管,每周1次,连续3周,治疗期间每日经引流管注入少量生理盐水保持引流管通畅。
1.2.2 测定方法:化疗前及每周期化疗后第3天取当日引流胸腔积液行VEGF检测,标本采集后3 000 r/min离心15 min取上清,所有标本均采用深圳晶美生物公司提供的VEGFELISA试剂盒进行检测。
1.2.3 疗效判定标准:按WHO统一标准:(1)完全缓解(complete remission,CR):积液完全消失,症状完全缓解并持续4周;(2)部分缓解(partial remission,PR):胸腔积液显著减少≥50%(以双肺CT计算积液面积百分比),症状明显改善并持续4周;(3)稳定(stable disease,SD),积液减少<50%,无增加趋势,症状部分缓解;(4)进展(progressive disease, PD),胸腔积液无减少或增加,需要再次抽液。以CR+PR计算总有效率(response rate,RR)。不良反应按美国国立癌症研究所制定的通用药物毒性标准(NCI CTC 3.0版)进行评价[5],分为0~4级,总生存时间(overall survival,OS)为从开始胸腔内化疗至患者任何原因死亡的时间。
1.3 统计学方法
采用SPSS17.0进行数据统计分析。计数资料采用χ2检验,计量资料以表示,组间均数比较采用t检验,OS运用Kaplan-Meier法和Log-rank检验进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 2组患者疗效评估
2.1.1 短期疗效:2组患者共52例完成3周期化疗,11例完成2周期化疗,共完成胸腔内化疗178次,63例患者均可评价疗效,根据胸腔积液控制情况评价A、B组患者治疗有效率,分别为84.3%、61.3%,差异有统计学意义(χ2=4.26,P<0.05),见表2。
2.1.2 远期疗效:2组患者随访时间均为0~16个月,共失访8例,失访率12.7%。A组中位OS为13.0月,B组为12.0月,采用Kaplan-Meier法和Log-rank检验对OS曲线进行分析,2组OS差异无统计学意义(χ2= 2.09,P>0.05),见图1。随访期间A组2例PD患者、B组5例PD患者接受再次胸穿抽液治疗;A组7例、B组12例出现包裹性胸腔积液,均未再次行胸穿治疗;2组SD+NC患者均拒绝接受进一步静脉维持化疗及靶向治疗。

表2 2组患者胸腔积液疗效比较Tab.2 Comparison of efficacy of treatment for pleural effusion between the two groups
2.2 胸腔积液VEGF的表达及与疗效的关系
治疗前2组患者胸腔积液VEGF平均值差异无统计学意义(P>0.05),经胸腔内给药后,2组患者胸腔积液VEGF水平均明显下降,A组患者VEGF下降更为显著,见表3。进一步分析,2组CR+PR患者VEGF初始水平无明显差异,B组治疗无效患者胸腔积液VEGF高于A组,但无统计学差异(t=1.909,P=0.079),考虑样本含量较小,故可能存在误差,见表4。A组5例患者第2周期化疗后胸引管无液体引出,4例经过胸穿采集胸水行VEGF检测,B组6例患者第2周期化疗后胸引管无液体引出,3例经过胸穿采集胸水行VEGF检测。上述11例患者未行第3次胸腔内化疗。
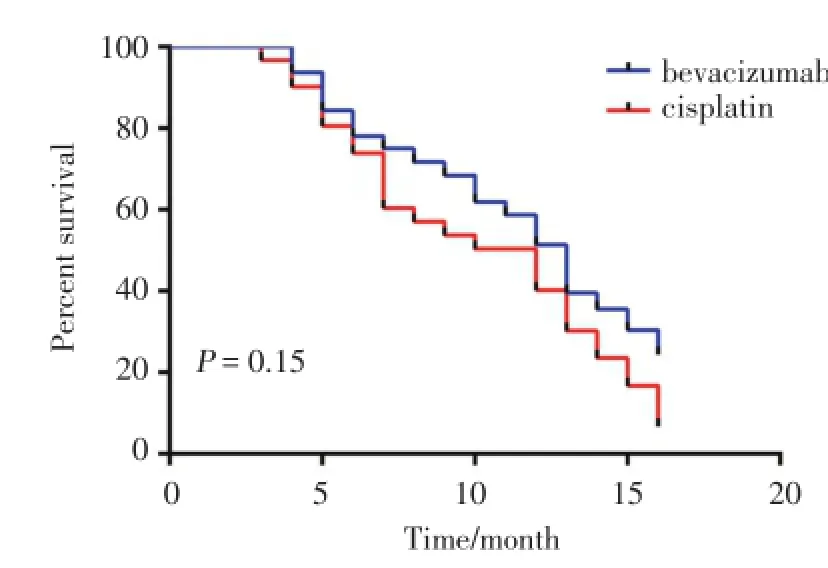
图1 两组患者OS比较Fig.1 Comparison of OS between the two groups

表3 各周期胸腔积液VEGF检测值(pg/mL)Tab.3 The VEGF level in pleural effusion in each cycle of treatment(pg/mL)

表4 胸腔积液VEGF初始水平与疗效的关系(pg/mL)Tab.4 Relationship betweent the initial VEGF level in pleural effusion and the efficacy(pg/mL)
2.3 2组患者不良反应比较
2组患者在治疗过程中均出现中性粒细胞减少、恶心、呕吐和腹泻的症状,但都是典型的化疗不良反应,且给予对症处理后均能继续接受化疗,贝伐单抗治疗的主要不良反应是蛋白尿和高血压,A组有5例出现高血压,2例出现蛋白尿,均为Ⅰ~Ⅱ级,给予相应治疗后好转,2组患者Ⅲ~Ⅳ级不良反应发生率无统计学差异(12.5%vs 12.9%,P>0.05),见表5。
3 讨论
MPE是非小细胞肺癌的不良预后因素,大量胸腔积液可引起压迫性肺不张,增加感染风险,同时长时间的肺不张可能导致肺实变,造成不可逆的肺功能损害。尽早控制MPE,不仅可以减少并发症的发生,改善患者的症状,而且可能延长患者的生命。目前治疗MPE的常用方案是胸腔内注射硬化剂或化疗药物及生物制剂[6],随着对MPE形成的分子机制的进一步认识,抗血管生成药物对于控制MPE的价值引起了越来越多的关注。研究证实[7]有多种活性物质可调节肿瘤血管的生成,VEGF是目前已知最有效最特异的正向调控因子,同时也是目前发现的增加血管通透性最强的物质,比组胺作用强5 000倍。是胸腔积液形成的关键[8]。

表5 2组患者不良反应比较Tab.5 Comparison of adverse reactions between the bevacizumab and cisplatin groups
贝伐单抗可与内源性的VEGF竞争性结合VEGF受体,减少新生血管形成,制肿瘤生长[9]。此外贝伐单抗还可促进肿瘤血管的正常化,降低组织间隙压和影响血管通透性,从而增加到达肿瘤细胞的化疗药物浓度来提高化疗疗效[10]。国外两个大样本的Ⅲ期临床ECOG4599[11]和AVAIL[12]实验证实了贝伐单抗联合标准化疗治疗局部晚期或转移性非鳞非小细胞肺癌的有效性和安全性,突破了传统非小细胞肺癌化疗疗效生存期1年的瓶颈,基于这一实验结果,美国FDA批准贝伐单抗用于治疗非小细胞肺癌[13]。贝伐单抗在抑制MPE进展的作用最近才被阐明,并建议作为单药治疗或与其他化疗药物相结合,并且在治疗MPE中起作用[14,15]。到目前为止,胸膜内注入贝伐单抗治疗非小细胞肺癌引起的MPE还没有得出最终结论。基于上述讨论,我们比较胸膜内贝伐单抗联合顺铂治疗和单用顺铂治疗MPE的疗效和安全性。
本研究结果表明,贝伐单抗联合顺铂胸腔内给药治疗MPE的短期疗效显著高于单用顺铂治疗(P<0.05),远期疗效2组OS无统计学差异(P>0.05),与杨晓利等[16]的报道结论一致,考虑贝伐单抗通过胸膜进入体循环的浓度较低,未能对原发病灶发挥作用。另外本研究因随访条件限制未能对2组无进展生存期(progression free survival,PFS)进行比较。在胸腔积液VEGF的表达与疗效方面,本研究结果显示,随着治疗周期的增加,2组患者胸腔积液VEGF水平呈现逐渐下降的趋势,贝伐单抗联合顺铂组VEGF下降更为明显,表明贝伐单抗对MPE中VEGF控制更为有效,这可能是有效率高于单用顺铂的原因。SD+PD患者MPE中VEGF浓度上,顺铂组高于贝伐单抗联合顺铂组,但是无统计学上差异(P=0.079),考虑可能是样本量较小的原因,亦可能是单用顺铂无法中和MPE中VEGF的高表达导致疾病短期进展。另外本结果未能表明初始VEGF高水平患者对贝伐单抗治疗更为有效,2组CR+PR患者VEGF水平无明显差异,与杜楠等[17]及韩娜等[18]的报道一致,需要今后更大规模的临床试验进一步证实。2组患者不良反应主要是骨髓抑制及胃肠道反应,多为Ⅰ~Ⅱ级,Ⅲ~Ⅳ级不良反应较少,经过对症处理均好转,两组无1例患者因不良反应中途退出治疗,提示贝伐单抗联合顺铂胸腔内灌注治疗晚期非小细胞肺癌安全可行。
本研究表明贝伐单抗联合顺铂局部胸腔内灌注治疗非小细胞肺癌MPE是可靠、安全、可行的。关于胸膜腔内注入药物治疗MPE,国内外均有学者[19]尝试金黄色葡萄球菌素、香菇多糖、博来霉素、白细胞介素2、华蟾素等,除引起化学性胸膜炎促进胸膜粘连机制较为明确外,其他作用机制还有待阐明,还有学者[20]试用胸腔局部热灌注治疗MPE,所有这些方法疗效不一,尚未得到多中心大样本RCT证实,有必要开展严格的临床研究来收集可靠的证据。贝伐单抗因具有特定靶点,不易产生耐药性,为MPE的治疗提供了一种新的思路和手段[21]。另外,MPE中VEGF表达水平对疗效的影响值得进一步研究探讨。
以贝伐单抗为基础的抗血管生成治疗已成为一线非鳞型非小细胞肺癌的标准治疗方法,为目前临床上绝大多数表皮生长因子受体突变阴性或状态未知的患者提供了显著提高生存获益的机会。但是它的疗效预测因子尚未找到,相关靶点及检测未知[22],今后的研究需要增加样本量,并对研究对象进一步分层,以期寻找其疗效预测因子。
[1]Bradshaw M,Mansfield A,Peikert T.The role of vascular endothelial growth factor in the pathogenesis,diagnosis and treatment of malignant pleural effusion[J].2013,15(3):207-216.
[2]Ishida A,Miyazawa T,Miyazu Y,et al.Intrapleural cisplatin and OK432 therapy for malignant pleural effusion caused by non-small cell lung cancer[J].Respirology,2006,11(1):90-97.
[3]Kitamura K,Kubota K,Ando M,et al.Bevacizumab plus chemotherapy for advanced non-squamous non-small-cell lung cancer with malignant pleural effusion[J].Cancer Chemother Pharmacol,2013,71(2):457-461.
[4]Langer C,Soria JC.The role of anti-epidermal growth factor receptor and anti-vascular endothelial growth factor therapies in the treatment of non-small-cell lung cancer[J].Clin Lung Cancer,2010,11(2):82-90.
[5]Sloan JA,Berk L,Roscoe J,et al.Integrating patient-reported outcomes into cancer symptom management clinical trials supported by the National Cancer Institute-sponsored clinical trials networks[J]. Clin Oncol,2007,25(32):5070-5077.
[6]Morgensztern D,Waqar S,Subramanian J,et al.Prognostic impact of malignant pleural effusion at presentation in patients with metastatic non-small-cell lung cancer[J].Thorac Oncol,2012,7(10):1485-1489.
[7]Yano S,Matsumori Y,Ikuta K,et.al.Current status and perspective of angiogenesis and antivascular therapeutic strategy:non-small cell lung cancer[J].Int J Clin Oncol,2006,11(2):73-81.
[8]Fiorelli A,Vicidomini G,Di Domenico M,et al.Vascular endothelial growth factor in pleural fluid for differential diagnosis of benign and malignant origin and its clinical applications[J].Interact Cardiovasc Thorac Surg,2011,12(3):420-424.
[9]Vaziri SA,Kim J,Ganapathi MK,et al.Vascular endothelial growth factor polymorphisms;role in response and toxicity of tyrosine kinase inhibitors[J].Curr Oncol Rep,2010,12(2):102-108.
[10]Chowdury MW,Scaranuzzi RJ,Wheeler-Jones CP,et al.The expression of angiogenic growth factors and their receptors in ovarian follicles throughout the estrous cycle in the ewe[J].Theriogenology,2010,73(7):856-872.
[11]Sandler A,Yi J,Dahlberg S,et al.Treatment outcomes by tumor histology in Eastern Cooperative Group(ECOG)study E4599 of bevacizumab with paclitaxel/carboplatin for advanced non-small cell lung cancer[J].J Thorac Oncol,2010,5(9):1416-1423.
[12]Reck M,von Pawel J,Zatloukal P,et al.PhaseⅢtrial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for non-squamous non-small cell lung cancer:AVAil[J].J Clin Oncol,2009,27(8):1227-1234.
[13]FDA approves Avasin in combination with chemotherapy for firstline treatment of most common type of lung cancer[J].Cancer Biol Ther,2006,5(11):1425-1428.
[14]Sack U,Hoffmann M,Zhao XJ,et al.Vascular endothelial growth factor in pleural effusions of different origin[J].Eur Respir,2005,25(4):600-604.
[15]Kobold S,Hegewisch-Becker S,Oechsle K,et al.Intraperitoneal VEGF inhibition using bevacizumab:a potential approach for the symptomatic treatment of malignant ascites?[J].Oncologist,2009,14(12):1242-1251.
[16]杨晓利,王峰,何炜,等.贝伐单抗联合培美曲塞加顺铂一线治疗IV期非小细胞肺癌的临床观察[J].西安交通大学学报(医学版),2013,7(4):554-556.
[17]杜楠,赵辉,王海滨,等.顺铂联合贝伐珠单抗对老年肺癌胸腔积液血管内皮生长因子表达的影响及疗效观察[J].中华临床医师杂志(电子版),2012,6(20):6291-6295.
[18]韩娜,张孟贤,于世英,等.贝伐单抗联合顺铂/培美曲塞治疗非鳞癌性非小细胞癌恶性胸腔积液的临床研究[J].华中科技大学学报(医学版),2013,42(5):588-591.
[19]徐春华,于力克.顺铂联合白细胞介素-2治疗恶性胸腔积液的研究[J].肿瘤防治研究,2011,38(08):937-939.
[20]向莉,任培蓉,杨红茹,等.老年恶性胸腔积液患者灌注化疗联合热疗的临床观察[J].重庆医学,2010,39(05):555-556,559.
[21]Tamiya M,Tamiya A,Yamadori T,et al.Phase 2 study of bevacizumab with carboplatin-paclitaxel for non-small cell lung cancer with malignant pleural effusion[J].Med Oncol,2013,30(3):676.
[22]李杰.血管内皮生长因子与贝伐单抗在非小细胞肺癌中的治疗进展[J].临床合理用药,2012,5(12A):179-180.
[23]Du N,Li X,Li F,et al.Intrapleural combination therapy with bevacizumab and cisplatin for non-small cell lung cancer-mediated malignant pleural effusion[J].Oncol Rep,2013,29(6):2332-2340.
(编辑 武玉欣)
ClinicalResearch ofIntrapleuralCombination Therapy with Bevacizumab and Cisplatin for Non-small CellLung Cancer Mediated MalignantPleuralEffusion
QUBo,JIANGWei,ZHOU Zhi-ming
(DepartmentofThoracic Surgery,The Shenyang CenterHospitalAffiliated to Shenyang MedicalCollege,Shenyang 110024,China)
Objective To evaluate the efficacy and safety of combined intrapleural therapy with bevacizumab and cisplatin in controlling malignant pleural effusion(MPE)caused by non-small cell lung cancer(NSCLC).MethodsA total of 63 NSCLC study subjects with MPE were randomly assigned to one of two groups(A and B).Group A(bevacizumab,n=32)received intrapleural bevacizumab(5 mg/kg)with cisplatin(40 mg/m2)therapy once a week fora totalofthree cycles.Group B(cisplatin,n=31)received intrapleuralcisplatin therapy alone with the same dose and cycle. Pleuralfluid was collected from both groups priorto and aftertreatment.The levelsofVEGF in the pleuralfluid were determined by ELISA.The curative effectand adverse reaction were observed and follow-up was conducted.ResultsIn 63 evaluable study subjects,the curative efficacy in the bevacizumab group was significantly higher than that found in the cisplatin group(84.3%vs 61.3%,respectively,P<0.05).But the overall survival(OS)of the two groups showed no statistically significant difference(13.0 months vs 12.0 months,P>0.05).After treatment,The VEGF levels in the MPE were significantly decreased in both groups.In the bevacizumab group,the levels ofVEGF in the pleuralfluid were significantly lowercompared to those ofthe cisplatin group aftertreatment,showing greaterefficacy(P<0.05).The VEGFlevels ofthe two groups whose treatmentwas invalid had no statistically significant difference(P=0.079).There was no significant difference in gradeⅢ/Ⅳadverse events between the two groups.All procedures were well tolerated by the patients.ConclusionCombined intrapleural therapy with bevacizumab and cisplatin was effective and safe in managing NSCLC-mediated MPE.The patients showed high tolerance to the therapy.For prediction of local treatment efficacy of bevacizumab using the VEGF expression levels in MPE,furtherresearch was needed.
non-small-cell lung cancer;malignant pleural effusion;VEGF;bevacizumab
R734.2
A
0258-4646(2015)07-0648-05
曲博(1981-),男,主治医师,硕士. E-mail:qubo2012@126.com
2015-01-04
网络出版时间:
