肥胖男性不育患者精子线粒体膜电位、游离脂肪酸、活性氧的关系
2015-02-07白双勇王剑松赵庆华
白双勇,王剑松,赵庆华
(昆明医科大学第二附属医院1.泌尿外科;2.妇科,昆明 650101)
·论著·
肥胖男性不育患者精子线粒体膜电位、游离脂肪酸、活性氧的关系
白双勇1,王剑松1,赵庆华2
(昆明医科大学第二附属医院1.泌尿外科;2.妇科,昆明 650101)
目的探讨肥胖男性不育患者精子线粒体膜电位的改变,以及线粒体膜电位与精浆中游离脂肪酸、活性氧之间的关系。方法按照研究条件,随机整群选取正常生育男性51人(对照组)、正常体重指数不育男性36人(正常体重不育组)、超重不育男性44人(超重不育组)、肥胖不育男性45人(肥胖不育组)。精液常规分析,ELSA法检测精浆中游离脂肪酸、活性氧,流式细胞仪检测精子线粒体膜电位。结果线粒体膜电位正常率的比较中正常体重不育组(27.34%±13.38%)、超重不育组(28.26%±9.76%)、肥胖不育组(25.27%±7.51%)均低于对照组(35.12%±15.90%),差异有统计学意义(P<0.01)。肥胖不育组中线粒体膜电位正常率虽然低于正常体重不育组及超重不育组,但差异无统计学意义。精子线粒体膜电位正常率与精子前向运动率呈明显正相关(r=0.29,P<0.01)。精浆中游离脂肪酸与精浆中活性氧呈明显正相关(r=0.30,P<0.01),精浆中活性氧与精子正常线粒体膜电位呈明显负相关(r=-0.24,P<0.01)。结论超重及肥胖男性不育患者精浆中游离脂肪酸增高,引起活性氧增加,活性氧使得线粒体膜电位下降,最终可能导致精子运动能力下降。治疗时应考虑建议患者减少高脂餐、适当运动。
肥胖;男性不育;活性氧;游离脂肪酸;线粒体膜电位
随着全球人口肥胖率上升,肥胖对生育的影响逐渐引起人们的重视。研究显示,肥胖可能增加男性不育率[1]。肥胖男性内脏脂肪堆积,过多的游离脂肪酸(free fatty acid,FFA)在进行氧化过程中产生活性氧(reactive oxygen species,ROS)[2]。在低水平时ROS可以调节精子生理功能,包括精子获能、顶体反应、线粒体鞘稳定性和精子的运动性。但是过量的ROS及其代谢产物可能损伤DNA、脂质、蛋白,改变酶系统,影响精子线粒体功能,改变精子线粒体膜电位(mitochondrial membrane potential,MMP),而精子运动能力的维持主要依赖于线粒体提供的能量[3]。本研究目的是探讨在肥胖男性精子MMP与精浆中ROS、FFA三者之间的关系,为临床分析肥胖男性不育病因以及诊治提供一定基础。
1 材料与方法
1.1 一般资料
本研究在昆明医科大学第二附属医院伦理委员会同意下进行,每个参与的患者都被告知相应的权利。在2013年3月至12月于昆明医科大学第二附属医院生殖中心就诊的人群中随机整群抽取男性。男性不育症标准:有规律性生活未避孕1年而未使妻子受孕的男性。根据中华人民共和国国家卫生和计划生育委员会2013年10月1日实施卫生行业标准的成人体质量判定标准,男性正常体重指数(body mass index,BMI)标准:24.00 kg/m2>BMI≥18.5 kg/m2;超重组:28.00 kg/m2>BMI≥24.0 kg/m2;肥胖组:BMI≥28.0 kg/m2。排除标准:与超重/肥胖无关的疾病或异常病史(包括精索静脉曲张、隐睾症、肿瘤、男性绝育术、睾丸扭转);严重附属性腺炎症;有明显的影响生育力的毒物接触,如农药厂、电焊、油漆等工作人群;严重少弱精症和无精子症。随机整群抽取来生殖中心就诊已经生育健康一孩且BMI正常男性51人为对照组,正常BMI不育男性36人(正常体重不育组),超重不育男性44人(超重不育组),肥胖不育男性45人(肥胖不育组)。
1.2 方法
1.2.1 精液分析:所有参与课题男性不育症患者禁欲48~72 h后,通过手淫办法获取精液,严格按照世界卫生组织2010年第5版人类精液检验与处理实验室手册要求,由昆明医科大学第二附属医院男科实验室工作人员按操作规程精液常规分析。
1.2.2 流式细胞仪检测精子MMP:制备单细胞悬液:取10万个精子,重悬于0.5 mL细胞培养液中。加入0.5 mL JC-1染色工作液(购于碧云天生物技术公司,MMP检测试剂盒JC-1),颠倒数次混匀。细胞培养箱中37℃孵育20 min。600 g、4℃离心3~4 min,沉淀细胞。弃上清,用JC-1染色缓冲液洗涤2次。加入1 mL JC-1染色缓冲液重悬细胞,600 g、4℃离心3~4 min,沉淀细胞,弃上清。再用适量JC-1染色缓冲液重悬后,行流式细胞仪分析。把试剂盒中提供的CCCP(10 mmol/L)推荐按照1:1 000的比例加入到细胞培养液中,稀释至10 μmol/L,处理细胞20 min。随后按照下述方法装载JC-1,进行MMP的检测。10 μmol/L CCCP处理20 min后线粒体的膜电位会完全丧失,JC-1染色后观察应呈绿色荧光。未经10 μmol/L CCCP处理的精子为阴性对照。流式细胞仪(FACSCalibur型,美国BD公司)检测JC-1单体时可以把激发光设置为490 nm,发射光设置为530 nm;检测JC-1聚合物时,可以把激发光设置为525 nm,发射光设置为590 nm。绿色荧光说明MMP下降,该细胞很可能处于细胞凋亡早期。红色荧光说明MMP比较正常,细胞的状态也比较正常。
1.2.3 检测精浆中FFA、ROS:精液相关指标检测后,将精液标本经2 000 g离心25 min获取精浆,行ELISA(上海鑫乐生物有限公司试剂盒)检测精浆中ROS、FFA。根据标准品的浓度及对应的吸光度计算出标准曲线的直线回归方程,再根据样品的吸光度在回归方程上计算出对应的样品浓度。
1.3 统计学分析
采用SPSS 19.0软件导入数据库进行数据分析。数据以表示,采用单因素方差分析比较,LSD分析各组间差异,Person相关性分析检测各因素之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 不同BMI组男性不育患者中精液分析、精浆中ROS、FFA、精子正常MMP率及MMP下降率比较
在精液各项指标比较中,超重不育组精子活动率高于正常体重不育组,差异均有统计学意义(P<0.05)。精浆FFA的比较中,超重不育组及肥胖不育组高于对照组及正常体重不育组,差异均有统计学意义(P<0.05)。在精浆ROS水平比较中,肥胖不育组高于对照组、正常体重不育组、超重不育组,差异均有统计学意义(P<0.05)。在各组精液中精子正常MMP率的比较中,3个不育组均低于对照组,差异有统计学意义(P<0.05)。而3个不育组的比较中,肥胖不育组中正常MMP率虽然低于正常体重不育组及超重不育组,但差异无统计学意义(P>0.05)。在MMP下降率的比较中,3个不育组均高于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 BMI、精浆中ROS、FFA、精子正常MMP率、MMP下降率与精液常规各项指标相关性分析
BMI与精子浓度呈正相关(r=0.17,P<0.05),与精子正常MMP率呈负相关(r=-0.17,P<0.05),与精子MMP下降率呈正相关(r=0.18,P<0.05)。BMI与精浆中FFA呈明显正相关(r=0.56,P<0.01),与精浆中ROS呈明显正相关(r=0.44,P<0.01)。精子正常MMP率与精子前向运动率呈明显正相关(r=0.29,P<0.01),而精子MMP下降率与精子活动率呈负相关(r=-0.27,P<0.05),与精子前向运动率呈明显负相关(r=-0.24,P<0.01)。精浆中FFA与精浆中ROS呈明显正相关(r=0.30,P<0.01),精浆中ROS与精子正常MMP率呈明显负相关(r=-0.24,P<0.01)。见表2。
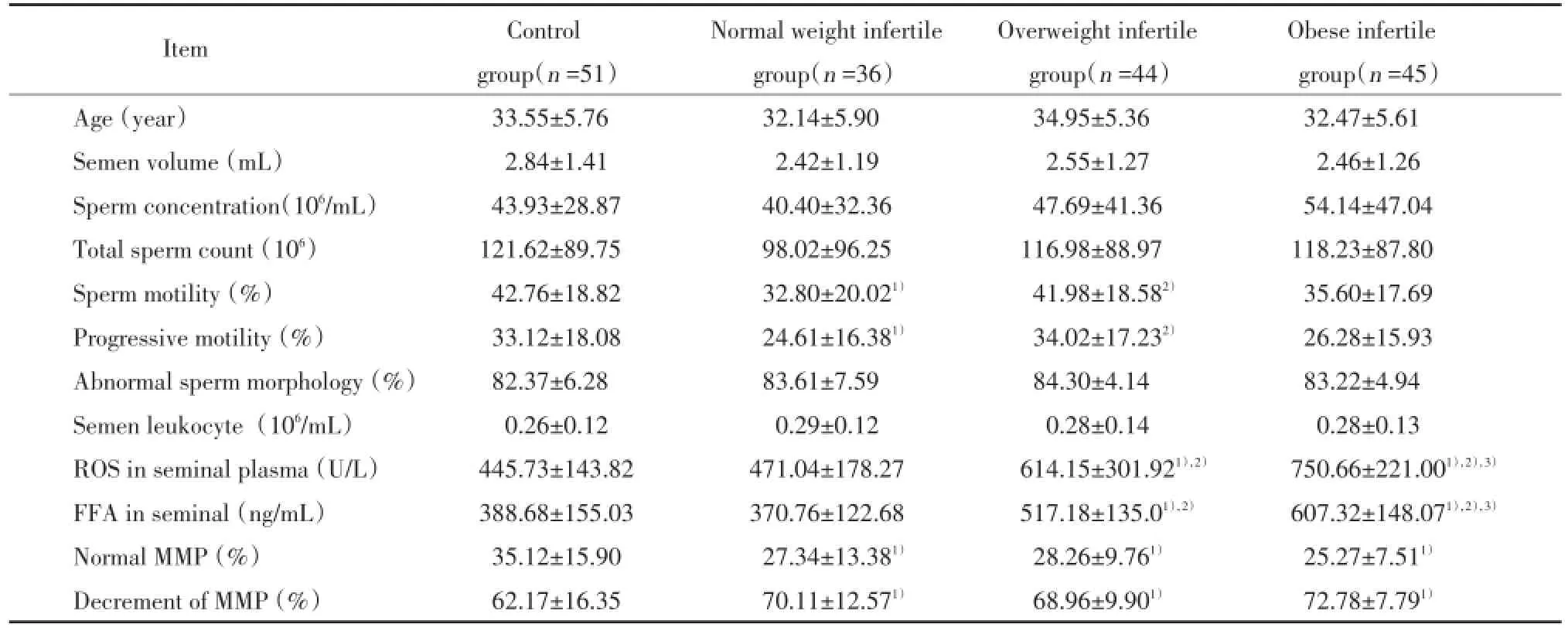
表1 不同BMI男性不育患者MMP及精浆中ROS、FFA的比较Tab.1 Comparison of ROS,FFA in the seminal plasma and MMP in different BMI infertile patient groups
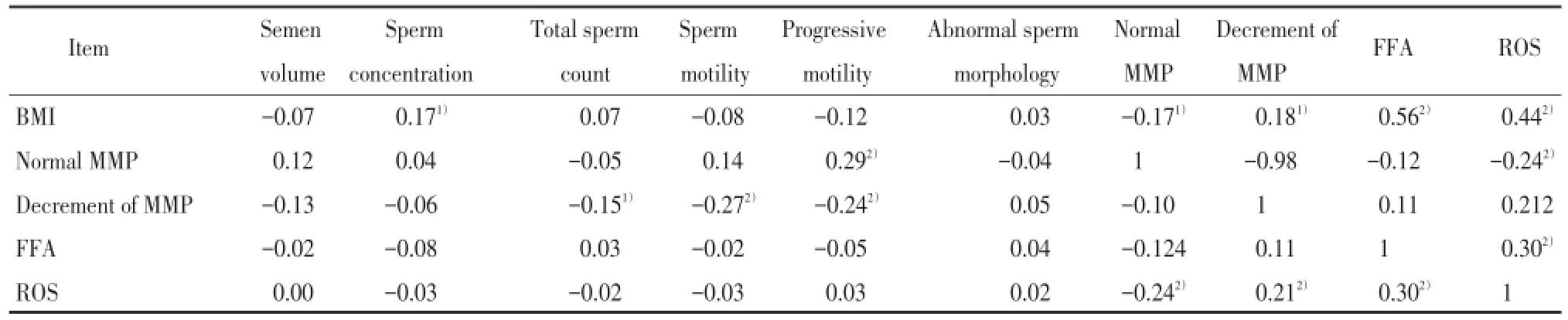
表2 男性不育患者中精液指标、MMP、精浆中ROS、FFA及BMI相关性分析Tab.2 Correlation analysis of ROS,FFA in the seminal plasma,BMI,MMP and semen analysis
3 讨论
线粒体的呼吸链是机体产生ROS的主要部位,呼吸链的各复合体在传递电子的过程中,由于将漏出的电子直接交给氧,产生部分被还原的氧,所以得到ROS这样的“副产物”,特别O2-产生主要来自呼吸链。复合体Ⅲ中通过Q循环传递电子,接受单电子的半醌型QH-在内膜中自由移动,通过非酶促反应直接将单个电子泄露给O2而生成O2-[5]。
肥胖患者中有较高水平的FFA,导致线粒体产生过量ROS[5]。有研究[6]发现在小鼠脂肪前体细胞中添加FFA,24 h后该细胞ROS明显上升。Erdemir等[7]发现肥胖导致睾丸内ROS增加,ROS类能使脂质氧化、蛋白质硝基化而损伤细胞膜和膜蛋白。羟自由基可直接引起蛋白质、核酸等各种生物分子的氧化损伤而丧失功能,进而破坏细胞的正常结构和功能。线粒体是细胞产生ROS的主要部位,因此线粒体DNA、基质中的酶最易融到ROS攻击而损伤[8]。本研究结果发现肥胖不育组精浆中FFA高于对照组、正常体重不育组、超重不育组,与后3组比较差异有统计学意义。在精浆中ROS水平比较中,肥胖不育组精浆中FFA高于对照组、正常体重不育组、超重不育组,与后3组比较差异有统计学意义。超重不育组精浆中ROS含量高于对照组及正常体重不育组,差异有统计学意义。而正常体重不育组与对照组比较无统计学差异。精浆中FFA与精浆中ROS呈明显正相关,与前两者研究结果相似。ROS被认为是男性不育的重要病因,有研究发现[9]在30%~40%男性不育患者精浆中发现ROS水平增加。精子容易受到ROS攻击,而且缺乏细胞内酶修复系统,主要是由于精子膜富含多不饱和脂肪酸,易受氧的作用和损伤,出现脂质过氧化,继而快速大量ATP丧失,导致精子运动能力下降[10]。
线粒体正常膜电位主要是依赖于位于线粒体基质和线粒体膜间隙内的质子泵,使得基质与膜之间不同的质子保持一定电化学梯度。当线粒体内ROS过度增加时,MMP下降。Ferramosca等[11]发现线粒体呼吸链的效率与精子活动率呈正相关,而与精子不活动率呈负相关,在其随后的研究[12]中进一步发现精子活动率不仅与线粒体呼吸链功能呈正相关,与ROS呈负相关,且线粒体呼吸链功能受到ROS的抑制作用。Mupfiga等[13]认为MMP与精液中ROS有明显相关性,而与精液中白细胞数量无相关性。La Vignera[14]的研究结果显示,在超重和肥胖男性与对照组精子MMP下降率的比较中,后两者增高。在各组精液中精子正常MMP率的比较中,正常体重不育组、超重不育组、肥胖不育组3组均低于对照组,差异有统计学意义。而3组不育人群的比较中,肥胖不育组正常MMP率虽然低于正常体重不育组及超重不育组,但差异无统计学意义。在MMP下降率的比较中,结果与正常MMP率一致。精子正常MMP率与精子前向运动率呈明显正相关,而精子MMP下降率与精子活动率呈负相关,与精子前项运动率呈明显负相关。精浆中ROS与精子正常MMP率呈明显负相关。
综上所述,本研究结果显示由于超重及肥胖男性不育患者精浆中FFA增高,引起ROS增加,ROS使得MMP下降,最终可能导致精子运动能力下降。该结果对于临床超重、肥胖男性不育的病因分析及诊治提供了一定参考,在治疗肥胖及超重男性不育患者时,应该考虑改变其不良的生活、饮食习惯,减少高脂餐的摄入,适量运动。但由于本次研究样本数量有限,还需要进一步扩大样本量去证实该结果。
[1]Du Plessis SS,Cabler S,McAlister DA,et al.The effect of obesity on sperm disorders and male infertility[J].Nat Rev Urol,2010,7(3):153-161.
[2]Takahashi K,Yamaguchi S,Shimoyama T,et al.JNK-and IkappaB-dependent pathways regulate MCP-1 but not adiponectin release from artificially hypertrophied 3T3-L1 adipocytes preloaded with palmitate in vitro[J].Am J Physiol Endocrinol Metab,2008,294(5):E898-E909.
[3]Henkel RR.Leukocytes and oxidative stress:dilemma for sperm function and male fertility[J].Asian J Androl,2011,13(1):43-52.
[4]Hampl R,Drábková P,Kand′ár R,et al.Impact of oxidative stress on male infertility[J].Ceska Gynekol,2012,77(3):241-245.
[5]Bournat JC,Brown CW.Mitochondrial dysfunction in obesity[J]. Curr Opin Endocrinol Diabetes Obes,2010,17(5):446-452.
[6]Davis LM,Rho JM,Sullivan PG.UCP-mediated free fatty acid uncoupling of isolated cortical mitochondria from fasted animals:correlations to dietary modulations[J].Epilepsia,2008,49(Suppl 8):117-119.
[7]Erdemir F,Atilgan D,Markoc F,et al.The effect of diet induced obesity on testicular tissue and serum oxidative stress parameters[J].Actas Urol Esp,2012,36(3):153-159.
[8]Amaral A,Lourenço B,Marques M,et al.Mitochondria functionality and sperm quality[J].Reproduction,2013,146(5):R163-R174.
[9]Lanzafame FM,La Vignera S,Vicari E,et al.Oxidative stress and medical antioxidant treatment in male infertility[J].Reprod Biomed Online,2009,19(5):638-659.
[10]Gharagozloo P,Aitken RJ.The role of sperm oxidative stress in male infertility and the significance of oral antioxidant therapy[J]. Hum Reprod,2011,26(7):1628-1640.
[11]Ferramosca A,Provenzano SP,Coppola L,et al.Mitochondrial respiratory efficiency is positively correlated with human sperm motility[J].Urology,2012,79(4):809-814.
[12]Ferramosca A,Pinto Provenzano S,Montagna DD,et al.Oxidative stress negatively affects human sperm mitochondrial respiration[J].Urology,2013,82(1):78-83.
[13]Mupfiga C,Fisher D,Kruger T,et al.The relationship between seminal leukocytes,oxidative status in the ejaculate,and apoptotic markers in human spermatozoa[J].Syst Biol Reprod Med,2013,59(6):304-311.
[14]La Vignera S,Condorelli RA,Vicari E,et al.Negative effect of increased body weight on sperm conventional and nonconventional flow cytometric spermparameters[J].J Androl,2012,33(1):53-58.
(编辑 陈 姜)
Relationship ofFree Fatty Acid,Reactive Oxygen Speciesand Sperm MitochondrialMembrane Potentialin Obese Male Infertility Patients
BAIShuang-yong1,WANGJian-song1,ZHAOQing-hua2
(1.Department of Urology,The Second Affiliated Hospital,Kunming Medical University,Kunming 650101,China;2.Department of Gynecology,The Second Affiliated Hospital,Kunming MedicalUniversity,Kunming 650101,China)
Objective To investigate the change ofsperm mitochondrialmembrane potentialin obese male infertility patients,and to explore the relationship of sperm mitochondrial membrane potential with the reactive oxygen species and free fatty acids in seminal plasma.MethodsAccording to the research conditions,samples were randomly selected by clustersampling from outpatient,and divided into normalbody massindex fertile men as control group(n=51),normal body mass index infertile group(n=36),overweight infertile group(n=44),and obesity infertile group(n=45). Semen routine analysis was performed.Free fatty acid and reactive oxygen species in the seminal plasma was determined by ELSA method,sperm mitochondrial membrane potential was determined by flow cytometry.ResultsThe rate of normal sperm mitochondrial membrane potential in normal weight infertility(27.34%±13.38%),overweight infertility(28.26%±9.76%),obesity infertility group(25.27%±7.51%)were lower than the control group(35.12%±15.90%),the difference was statistically significant(P<0.05).Although obesity infertility group normal rate of mitochondrial membrane potential were lower than normal weight infertility group and the overweight infertility group,but there was no statistically significant difference.The rate ofsperm normalmitochondrialmembrane potentialwas positively correlated with the rate ofsperm progressive motility(r=0.29,P<0.01).Free fatty acid was positively correlated with reactive oxygen species in seminal plasma(r=0.30,P<0.01),reactive oxygen species in seminal plasma was negatively correlated with sperm normal mitochondrial membrane potential(r=-0.24,P<0.01).ConclusionFree fatty acid was elevated in the seminal plasma of overweight and obese patients with male infertility,which causes increased reactive oxygen species,reduced mitochondrial membrane potential,and eventually lead to the decline of sperm movement ability.Patients undergoing the treatment should be advised to reduce the high fatdietand perform properexercise.
obesity;male infertility;reactive oxygen species;free fatty acid;mitochondrial membrane potential
R698
A
0258-4646(2015)07-0653-04
白双勇(1972-),男,副主任医师,博士研究生.
王剑松,E-mail:jiansongwang@yahoo.com
2014-12-30
网络出版时间:
