多发性脑转移瘤手术治疗及预后分析☆
2015-02-06刘正豪邓跃飞郑眉光李忠军李超
刘正豪邓跃飞郑眉光李忠军李超
·论 著·
多发性脑转移瘤手术治疗及预后分析☆
刘正豪*邓跃飞*郑眉光*李忠军*李超*
目的探讨多发性脑转移瘤的临床特点与治疗方法,提高其治疗效果。方法收集2002年2月-2014年3月在我院神经外科行手术治疗的多发性脑转移瘤42例患者临床及随访资料,分析多发性脑转移瘤的临床特点、治疗及生存情况。结果术后2周神经系统症状完全消失3例(7.1%),明显缓解31例(73.8%);整体中位生存期为11.0个月。单因素分析显示,是否合并颅外转移、血清肿瘤标志物水平及脑转移瘤手术后综合治疗状况是影响预后的因素(χ2=6.007~13.704,P<0.05);多因素分析显示,是否合并颅外转移(RR=2.302,95%CI:1.151~4.607)及是否采用综合治疗方法(RR=0.262,95%CI:0.118~0.585)是影响患者预后的独立因素(P<0.05)。结论合并颅外转移是影响多发性脑转移瘤预后的不利因素,采用手术切除辅以放、化疗等综合治疗能延长患者生存时间、改善患者预后。
脑转移瘤 多发性 手术治疗 预后分析 统计学
目前脑转移瘤的发病率是脑内原发肿瘤的4~5倍,脑转移瘤已成为颅内发病率第一位的肿瘤[1]。随着脑转移瘤发病率增加,多发性脑转移瘤在脑转移瘤中的比例也在加大[2],但目前对于多发性脑转移瘤的治疗没有规范的方法,而且因多发性脑转移瘤预后极差,甚至认为治疗意义不大。为改善多发性脑转移瘤患者预后,我们对42例患者进行了手术治疗,并对手术效果及影响患者预后的因素进行分析,以期为多发性脑转移瘤的治疗提供参考。
1 资料与方法
1.1 一般资料收集2002年2月至2014年3月在我院神经外科行手术治疗的多发性脑转移瘤患者42例。入组标准:①原发肿瘤控制;②患者KPS评分≥70;③影像学示脑转移瘤数量≥2,瘤体最大直径≥2cm;④具有一般情况、影像学、治疗方法、术后病理及随访等完整临床资料;⑤预计术后生存期≥6个月。排除标准:①肿瘤位于脑干等重要功能区;②年龄>80岁;③心脏、肺等重要器官功能不能耐受手术;④合并其他基础疾病不能耐受手术或影响术后康复。42例患者中,男16例,女26例,男:女为1:1.63,年龄33~79岁,平均(52.8± 1.6)岁,其中<55岁26例(61.9%),≥55岁共16例(38.1%)。神经系统病程:<3个月32例(76.2%),3~6个月4例(9.5%),>6个月6例(14.3%)。
1.2 临床特征42例患者中,原发肿瘤类型:肺癌21例(50.0%),乳腺癌9例(21.4%),鼻咽癌2例(4.8%),肝癌2例(4.8%),结肠癌、子宫肌瘤、卵巢癌、腮腺混合瘤、软骨肉瘤各1例,原发肿瘤不明确3例(7.2%)。颅内肿瘤数量:2个19例(45.2%),≥3个23例(54.8%)。是否合并颅外转移:无合并转移19例(45.2%),合并转移23例(54.8%)。肿瘤最大直径:<3cm23例(54.8%),≥3cm 19例(45.2%)。肿瘤位置:幕上22例(52.4%),幕下4例(9.5%),幕上、下兼有16例(38.1%)。血清肿瘤标志物水平(包括CEA,CA125,CA153,CA199,CA211,NSE,细胞角蛋白-19片段等):正常16例(38.1%),异常升高26例(61.9%)。
1.3 治疗方法全部病例采取显微手术切除,数量少且位置相邻者切除全部肿瘤,数量多或肿瘤位
置分散者切除导致神经系统症状的责任病灶。单纯行手术治疗20例(47.6%),手术后行放、化疗等综合治疗22例(52.4%)。术后常规脱水、激素、营养支持等治疗,术后行全脑放疗7例(16.7%),伽马刀治疗2例(4.8%),化疗5例(11.9%),全脑放疗、化疗8例(19.0%)。
1.4 随访方法自患者在我科首次行脑转移瘤手术开始,采用电话与患者返院复查相结合的方式,末次随访截止日期为2014年9月。随访3.0~52.0个月,中位随访20.0个月。至随访结束37例(88.1%)死亡,5例(11.9%)存活。评价预后的指标为手术后生存时间(手术后第1天至死亡或随访截止日期)及手术后功能状态评分(KPS评分)。
1.5 统计学方法采用SPSS19.0对数据进行分析。生存分析中,Kaplan-Meier法计算生存率及生存期并进行单因素分析,采用Log-rank检验比较组间差异,采用Cox比例风险回归模型进行多因素分析。检验水准α=0.05。
2 结果
2.1 手术效果术后2周神经系统症状完全消失3例(7.1%),明显缓解31例(73.8%),无缓解或加重7例(16.7%),死亡1例(2.4%)。死亡原因:1例肺癌脑转移瘤术后突发呼吸、循环衰竭死亡。
2.2 随访结果术后早期死亡(≤6.0个月)6例(14.3%),1年生存16例(38.1%),2年生存3例(7.1%),中位生存期11.0个月,最长存活时间1例43.0个月。术后早期死亡6例均为单纯行手术治疗患者。术后3.0个月随访,KPS评分:100分3例,90分8例,80分23例,70分6例,60分1例,与术前评分相比,32例(76.2%)升高,8例(19.0%)无变化,1例(2.4%)下降;术后半年随访,KPS评分:100分3例,90分7例,80分20例,70分5例,60分1例;术后1年随访,100分2例,90分1例,80分9例,70分4例。
2.3 预后分析
2.3.1 单因素分析 在42例多发性脑转移瘤患者中,从手术后第1天到出现死亡或随访截止日期,总体中位生存期 11.0个月(95%CI:9.227~ 12.773)。脑转移瘤合并颅外转移(图1)及血清肿瘤标志物水平异常升高(图2)者预后较差,手术后行放、化疗等综合治疗组预后好于单纯手术组(图3)。见表1。
2.3.2 多因素分析多因素COX比例风险回归分析结果表明,是否合并颅外转移(RR=2.302,95%CI:1.151~4.607,P=0.018)及是否采用综合治疗方法(RR=0.262,95%CI:0.118~0.585,P=0.001)是影响多发性脑转移瘤患者预后的独立因素(P<0.05,表2)。合并颅外转移是多发性脑转移瘤患者死亡的危险因素,手术后行放、化疗等综合治疗是多发性脑转移瘤患者的生存利好因素。
3 讨论
一般认为,脑转移瘤的出现意味着肿瘤患者进入疾病的终末阶段,约50%患者死于颅内脑转移瘤而不是颅外肿瘤[3,4],发生多发性脑转移预后更差,是否采取进一步积极治疗及如何进行治疗存在争议。由于未治患者自然生存期约为1个月,采用激素治疗可至2个月,而采取手术治疗的多发性脑转移瘤患者中位生存期为9.2-10.8个月[5,6],因此手术被认为在脑转移瘤治疗中具有重要作用[7,8]。目前较为统一的脑转移瘤手术指征有[7-9]:①颅外病灶稳定者,瘤体直径>3cm,有明显占位效应;②对放疗不敏感肿瘤(如结肠癌、肾癌转移者);③原发病灶预计可行手术切除或有效控制者;④脑转移瘤数目<3个,肿瘤位于非重要功能区;⑤颅内占位诊断不明确;⑥KPS评分≥70分;⑦预计术后生存期≥6个月,但对多发性脑转移瘤的手术指征甚少有专门文献报道。相对于转移瘤数目和大小,我们选择手术时更重视患者术前基本情况以及多发性转移瘤的占位效应和部位,对水肿占位效应明显或位于后颅窝病灶,只要预计患者原发灶可控和术后生存期≥6个月,不管病灶数目是否>3个或瘤直径是否>3cm我们都予积极手术并术后予系统性治疗。在我们所选取病例中,患者颅内高压、神经功能损害等神经系统症状在术后均得到明显缓解,总体中位生存期为11.0个月,其中,单纯行手术治疗组患者的中位生存期为8.0个月,手术+放、化疗组的中位生存期为15.0个月,显示手术能明显延长多发性脑转移瘤的生存时间,切除多发性脑转移瘤既可缓解颅内高压症状、减轻神经功能损害,也为术后放、化疗赢得时间和发挥更大疗效奠定基础。
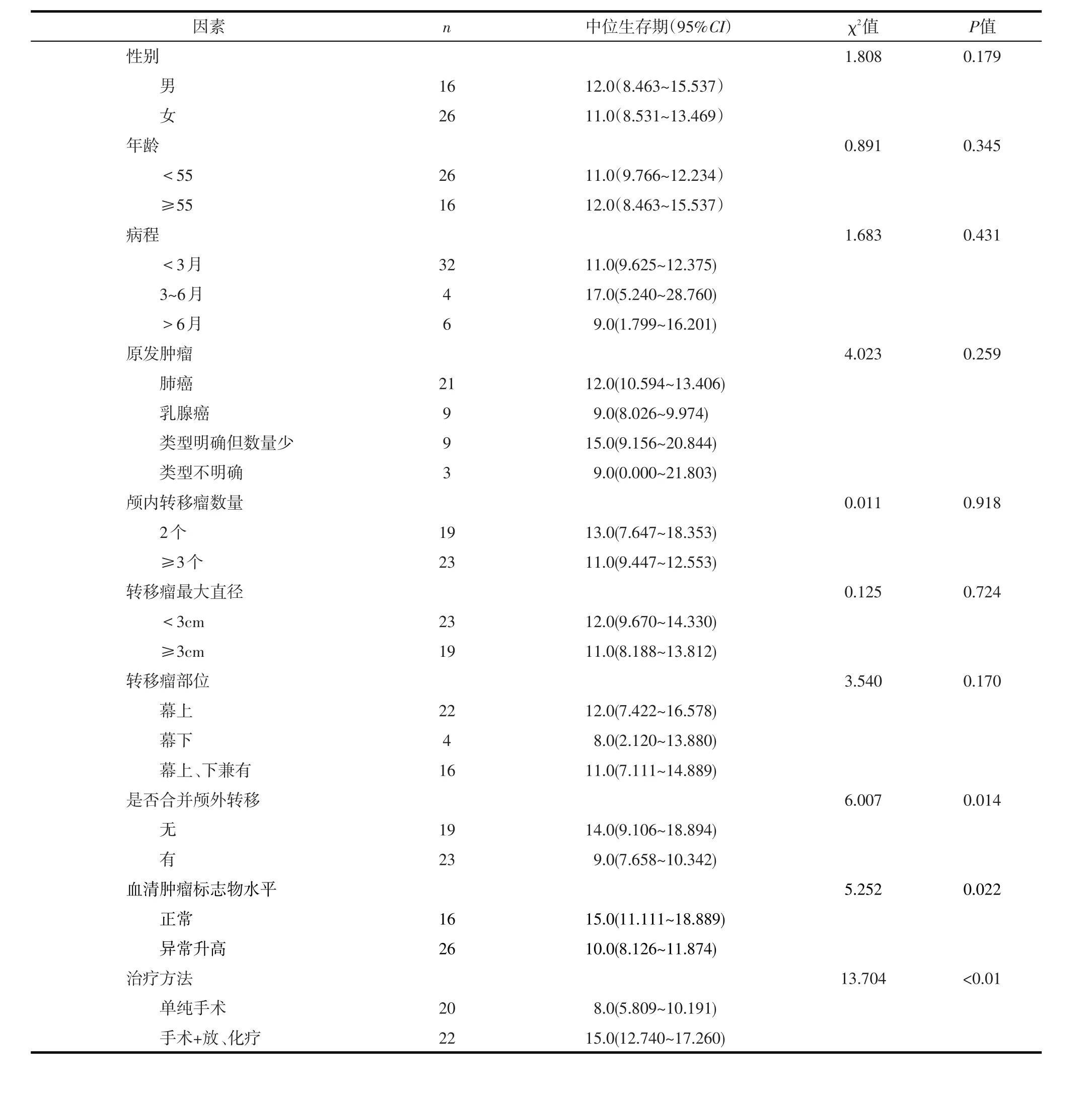
表1 影响多发性脑转移瘤中位生存期的单因素分析(月)
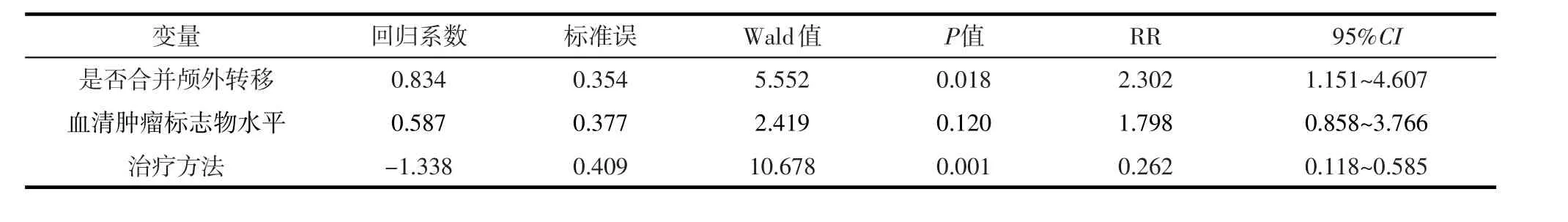
表2 影响多发性脑转移瘤预后的多因素分析
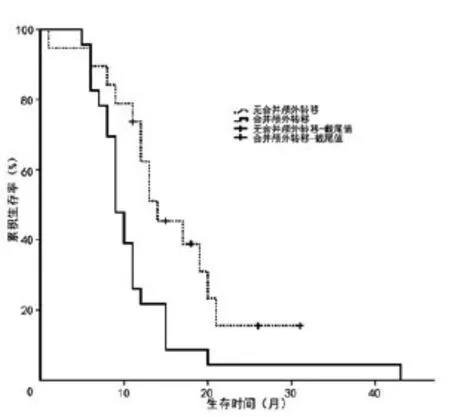
图1 是否合并颅外器官转移患者生存曲线
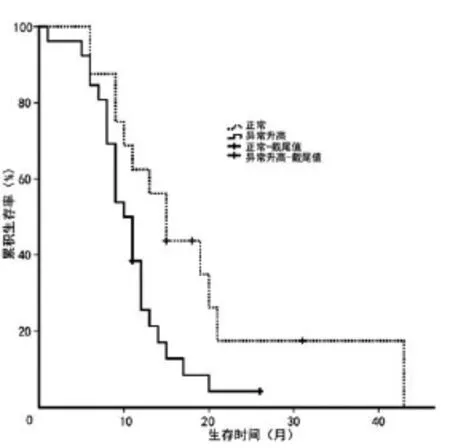
图2 不同血清肿瘤标志物水平患者生存曲线

图3 不同治疗方式患者生存曲线
目前研究认为,影响脑转移瘤预后因素有年龄、转移瘤数量、KPS评分、合并颅外转移、转移瘤最大直径、原发肿瘤控制情况、治疗方式等[5,8,10-11]。另外,研究发现乳腺癌及肺癌等脑转移瘤患者CEA、CA153、细胞角蛋白19片段等肿瘤标志物水平正常者在无进展生存期上明显好于异常升高者[12,13],提示肿瘤标志物水平可作为评估预后的一项因素。我们对数据进行单因素分析,结果提示脑转移瘤是否合并颅外器官转移、血清肿瘤标志物水平是否异常升高、是否采用综合治疗方法是影响预后的因素,无颅外转移组中位生存期(14.0月)明显长于合并颅外转移组(9.0个月),术后行包括放、化疗在内的综合治疗组生存期(15.0个月)明显长于单纯手术治疗组(8.0个月),但性别、年龄、转移瘤数量、转移瘤最大直径、转移瘤部位、神经系统症状病程等对患者预后的影响均无统计学意义。多因素分析后结果显示,脑转移瘤是否合并颅外转移、是否采用综合治疗方法这两个因素是多发性脑转移瘤患者的独立预后因素,这也说明合并颅外转移是多发性脑转移瘤取得良好预后的不利因素,而采取手术切除辅以放、化疗等综合治疗能延长患者生存时间、改善患者预后,是目前治疗多发性脑转移有效的方式。
综上所述,合并颅外转移是影响多发性脑转移瘤预后的不利因素,手术切除辅以放、化疗等综合治疗能延长患者生存时间、改善患者预后。
[1]Gavrilovic IT,Posner JB.Brain metastases:epidemiololgy and pathophysiology[J].J Neurooncol,2005,75(1):5-14.
[2]Nieder C,Spanne O,Mehta MP,et al.Presentation,patterns of care, and survival in patients with brain metastases:what has changed in the last 20 years?[J].Cancer,2011,117(11):2505-2512.
[3]Kalkanis SN,Kondziolka D,Gaspar LE,et al.The role of surgical
resection in the management of newly diagnosed brain metasta⁃ses:a systematic review and evidence-based clinical practice guideline[J].J Neurooncol,2010,96(1):33-43.
[4]Mut M.Surgical treatment of brain metastasis:a review[J].Clin Neurol Neurosurg,2012,114(1):1-8.
[5]Hong N,Yoo H,Gwak HS,et al.Outcome of surgical resection of symptomatic cerebral lesions in non-small cell lung cancer pa⁃tients with multiple brain metastases[J].Brain Tumor Res Treat, 2013,1(2):64-70.
[6]Iwadate Y,Namba H,Yamaura A.Significance of surgical resec⁃tion for the treatment of multiple brain metastases[J].Anticancer Res,2000,20(1B):573-577.
[7]李振业,蒋小兵,张湘衡,等.非小细胞肺癌同步脑转移的治疗(附19例临床分析)[J].中华神经医学杂志,2011,10(11): 1134-1137.
[8]Owonikoko TK,Arbiser J,Zelnak A,et al.Current approaches to the treatment of metastatic brain tumours[J].Nature Reviews Clin Oncol,2014,11(4):203-222.
[9]Robinson PD,Kalkanis SN,Linskey ME,et a1.Methodology used to develop the AANS/CNS management of brain metastases ev⁃idence—based clinical practice parameter guidelines[J].J Neu⁃rooncol,20l0,96(1):11-16.
[10]Zhu W,Zhou L,Qian JQ,et al.Temozolomide for treatment of brain metastases:A review of 21 clinical trials[J].World J Clin Oncol,2014,5(1):19-27.
[11]Zhuang H,Yuan Z,Wang J,et al.Phase II study of whole brain ra⁃diotherapy with or without erlotinib in patients with multiple brain metastases from lung adenocarcinoma[J].Drug Des Devel Ther,2013,8(7):1179-1186.
[12]Nieder C,Marienhagen K,Astner ST,et al.Prognostic scores in brain metastases from breast cancer[J].BMC Cancer,2009,7(9): 105.
[13]刁艺,黄强,董军,等.人脑转移癌组织裸小鼠脑内移植模型的建立[J].中国神经精神疾病杂志,2008,34(4):216-220.
R739.41
A
2014-11-18)
(责任编辑:甘章平)
10.3936/j.issn.1002-0152.2015.02.009
* 中山大学孙逸仙纪念医院神经外科(广州 510120)
