丛枝菌根真菌群落沿高寒草原海拔梯度的变化特征
2015-02-05彭岳林蔡晓布
彭岳林,蔡晓布
西藏大学农牧学院, 林芝 860000
丛枝菌根真菌群落沿高寒草原海拔梯度的变化特征
彭岳林,蔡晓布*
西藏大学农牧学院, 林芝 860000
基于丛枝菌根(Arbuscular mycorrhizal,AM)真菌孢子形态学的鉴定,对沿不同海拔(4584、4628、4744、4880、4956 m)梯度采集的高寒草原建群植物根际土壤样品进行了分析。结果表明,高寒草原AM真菌属、种构成均较简单,Acaulospora、Claroideoglomus、Funneliformis、Glomus属见于各海拔梯度,海拔4744 m地带未见Pacispora属,海拔4744、4956 m地带无Scutellospora属分布,Rhizophagus属仅见于海拔4584 m地带。随海拔上升,AM真菌种数、物种丰度均呈显著下降;海拔4584—4880 m范围Shannon-Weiner 指数(H)无显著差异,但在最高海拔时显著下降;优势种种数及所占比例与海拔梯度则呈显著正相关(Funneliformisgeosporum、Claroideoglomusclaroideum为不同海拔梯度优势种);沿海拔梯度,孢子密度基本呈单峰分布格局,峰值出现在海拔4744 m地带;海拔梯度对菌根侵染效应影响显著,菌根侵染率、侵染强度和丛枝丰度随海拔上升均呈显著下降趋势;不同海拔梯度高寒草原AM真菌群落相似度(Sorensen相似性系数0.821— 0.969)较高,并在总体上表现出随海拔梯度增大而降低的趋势。土壤pH值、有效磷、有机碳、海拔对AM真菌的群落分布均产生显著影响,尤以海拔的影响最为显著。研究结果对预测高寒草原微生物的作用与影响,以及高寒草原环境对全球变化的响应等提供了理论依据。
海拔梯度;AM真菌群落组成;高寒草原;藏北高原
微生物群落趋于生境选择[1- 2],研究微生物的种群多样性及其地理分布对预测不同区域微生物的作用与影响具有重要意义[3]。海拔梯度包含了多种环境因子的梯度效应[4- 5]和不同的植物群落[6],因此,高山环境(通常指高差悬殊的高大山体)有助于在相对较短的距离内研究微生物群落的空间分布格局[7]。近年来,研究者对微生物群落沿海拔梯度的变化等问题给予了较多关注[8- 10]。研究发现,微生物群落组成、种群丰度和物种多样性随海拔梯度而变化,如美国科罗拉多州落基山脉细菌类群丰富度、系统发育多样性均随海拔高度上升而降低[10],奥地利中部阿尔卑斯山真菌多样性随海拔升高显著增加[11]。对法国南部阿尔卑斯山海拔1900—2800 m地带的研究则发现地理距离对细菌、真菌的β多样性(Beta-diversity)均无显著影响[2]。可见,海拔梯度对微生物群落的影响较为复杂,可能受控于海拔主导的多种因素的综合作用。AM真菌在植物矿质营养、碳循环和生物间相互作用等方面发挥着重要作用[12- 13],其多样性决定着植物的多样性、生产力和生态系统的变化[12- 14]。迄今,人们对区域和全球范围内AM真菌的多样性格局仍不十分清楚[15],描述不同生境中AM真菌群落结构的数据相当缺乏[16]。沿海拔梯度的AM真菌相关研究主要集中在菌根侵染方面[7- 9,17],对其物种多样性垂直分布格局的研究相对较少[7,18]。同时,这些工作主要集中于高山环境[7,19- 20],对面积较大且海拔梯度相对较小的草原环境的研究相对较少[21]。因此,进一步了解AM真菌对植被群落和生态系统的影响与作用,需要在更多的环境,特别是极端环境背景下对AM真菌群落组成和物种多样性沿海拔高度的变化及其规律开展研究。广泛分布于藏北高原的高寒草原是青藏高原隆升过程中所特化形成的高寒草地类型,对高寒生态系统的稳定具有重大影响。与高差较大的高山环境不同,藏北高寒草原主要分布区虽地势高峻,但地形相对平坦,平均海拔仅在4500—5000 m之间。因此,在这一高差相对较小的极端环境中,AM真菌群落组成、菌根侵染水平沿海拔梯度会发生怎样的变化,其变化的特点和原因分别是什么?均为本研究拟回答的重要问题。
1 材料和方法
1.1 研究地点和样品采集
藏北高原(建群植物主要由耐寒、耐旱的多年生禾本科针茅属植物组成)是青藏高原平均海拔(4500—5000 m)最高、高原形态保存完整的自然区域之一,亦是西藏高寒草原的集中分布区。因地处高原亚寒带干旱、半干旱气候区,多数区域年均温度-6—-2 ℃、年均降水量150—350 mm、年均蒸发量2000 mm左右[22]。随地势由南向北逐步抬升,气候愈加寒冷、干旱。研究表明,西藏高原海拔、纬度每升高100 m和1°,年均温度分别下降0.57、0.63 ℃[23],由南向北高寒草原分布区年均温最大温差最少可达2.85—3.78 ℃。高寒草原(土壤为高山草原土,土壤质地均为砂土)植物构成极为简单,植被低矮、稀疏(植被盖度最高仅为50%—60%)。高寒草原草地分类上,以占绝对比重的某类建群植物为依据而划分为不同的草地型,如紫花针茅(Stipapurpurea)草地型、沙生针茅(Stipaglareosa)草地型、昆仑针茅(Stiparoborowskyi)草地型、羽柱针茅(Stipasubsessilifloravar.Basiplumosa)草地型等,而不同草地型中的建群植物普遍具有丛生或片生的特征,伴生植物种类少,仅呈零星分布[22]。因此,高寒草原不同草地型中的植物分布特点有利于建群植物根系及根际土壤的采集,从而可有效避免其它植物对建群植物根际的干扰。
2008、2009年9月分别在西藏北部班戈、申扎、尼玛县境内采集样品。由于各海拔地带高寒草原面积差异很大,且多数海拔地带不同草地型较为分散,因此在不同海拔地带所确定的高寒草原采样区数量、各采样区采样点数量均不同。如某一区域草地型较多,则确定为采样区,之后按该区域草地型确定采样点;如某一海拔高度仅见某类草地型,则以50—70 km间隔确定采样点。其中,海拔4500—4600 m(E1)、4601—4700 m(E2)、4701—4800 m(E3)、4801—4900 m(E4)、4901—5000 m(E5)地带采样区数量(平均海拔依次为4584、4628、4744、4880、4956 m)分别为6、7、4、4、5个,各采样区采样点(面积均>1 hm2)数量分别为14、17、4、8、16个。采样时,分别在各采样点按水平方向随机确定面积为1 m × 1 m的样方3个(间隔100—150 m);采集2—30 cm土层带根土样后,将3个样方的样品组成1个混合样品。在实验室将部分根系存放在4 ℃冰箱,土壤样品经室内自然风干后备用。土壤pH值、土壤有效磷(P2O5)、土壤有机碳测定分别采用电位法、0.5 mol/L NaHCO3法、重铬酸钾容量法—外加热法(表1)。

表1 不同海拔梯度高寒草原样点分布、建群植物组成及土壤特征Table 1 Sample distribution, dominant species composition and soil characteristics in alpine grasslands at different altitudinal gradients
1.2 AM真菌侵染率测定
将根系用自来水冲洗干净,剪成约1 cm长根段;经KOH-曲利苯蓝染色,随机取30条根段制片并在200 倍显微镜下观测侵染点、丛枝、泡囊、菌丝圈和无隔菌丝;根据根段中菌根侵染(0,<1%,<10%,<50%,>50%和>90%)和丛枝丰度分级(0,<50%,>50%)的标准,定义每一条根;据Trouvelot等[24]的方法,采用MYCOCALC软件计算菌根侵染率(F,%)、侵染强度(M,%)和丛枝丰度(A,%),并同时观测泡囊 、内生菌丝等结构。
1.3 AM真菌形态学鉴定
取100 g自然风干土样,采用湿筛倾析-蔗糖离心法筛取孢子;之后,用微吸管挑取孢子于载玻片上(加30%甘油浮载剂封片),显微观测并记录孢子颜色、连孢特征,测定孢子大小;压碎孢子后观测内含物、孢壁层次及各层颜色,测定各层孢壁的厚度(莱卡显微镜自带图像分析软件测定)等。鉴定中辅助使用Melzer′s试剂以观测孢子的特异性反应。综合以上观测结果,根据http://schuessler.userweb.mwn.de/amphylo/上的分类描述进行属种检索、鉴定。
1.4 统计分析
①孢子密度(SD) 每100 g风干根层土样中不同AM真菌种的孢子数。
②物种丰度(SR) 每100 g根层土样所含AM真菌种的平均数,即SR=AM真菌种出现总次数/土壤样本数。
③物种多样性(H) 采用Shannon-Weiner指数公式计算:
(1)
式中,k为某样点中AM真菌的种数,Pi为该样点AM真菌种i的孢子密度占该样点总孢子密度的百分比。
④物种均匀度指数(J)
J=H/ lnS
(2)
式中,H为Shannon-Weiner指数,S为某采样区AM真菌的种类数目。
⑤分离频度(IF) 某AM真菌属或种在样本总体中的出现频率,即IF=AM真菌某属或种的出现土样数/总土样数)× 100%。据此将AM真菌划分为3个优势度等级,即分离频度≥50%为优势属(种),≥10%—<50%为常见属(种),<10%为偶见属(种)。
⑥相对多度(RA)
RA=SD/∑SD× 100%
式中,SD为某样点AM真菌某属(种)的孢子数,∑SD为某样点AM真菌总孢子数。
⑦重要值(IV) 某采样点或某环境中AM真菌属(种)的分离频度、相对多度的平均值,即:
IV=(IF+RA/2
⑧Sorensen群落相似性系数(C)
C=Ij/ (a+b)
(3)
式中,Ij为2个不同海拔梯度中AM真菌共有种重要值的总和,a和b分别为2个海拔梯度中全部AM真菌种的重要值总和。据此,将群落物种相似度划分为极低(<0.20)、低(0.21—0.40)、中(0.41—0.60)、高(0.61—0.80)、极高(0.80—1.00)等级。
差异显著性分析采用LSR法,相关分析、CCA分析分别采用Excel 2003、CANOCO 4.5计算。
2 研究结果
2.1 AM真菌多样性
于高寒草原分离出Acaulospora、Glomus、Scutellospora等7属共20种AM真菌。随海拔上升,AM真菌种数显著下降(r=-0.569,P<0.05),优势种种数(r=0.694,P<0.05)及所占比例(r=0.574,P<0.05)显著提高,Funneliformisgeosporum、Claroideoglomusclaroideum为不同海拔梯度优势种。同时,不同海拔梯度AM真菌共有种较多,且所占比例亦随海拔上升趋于提高(表2)。
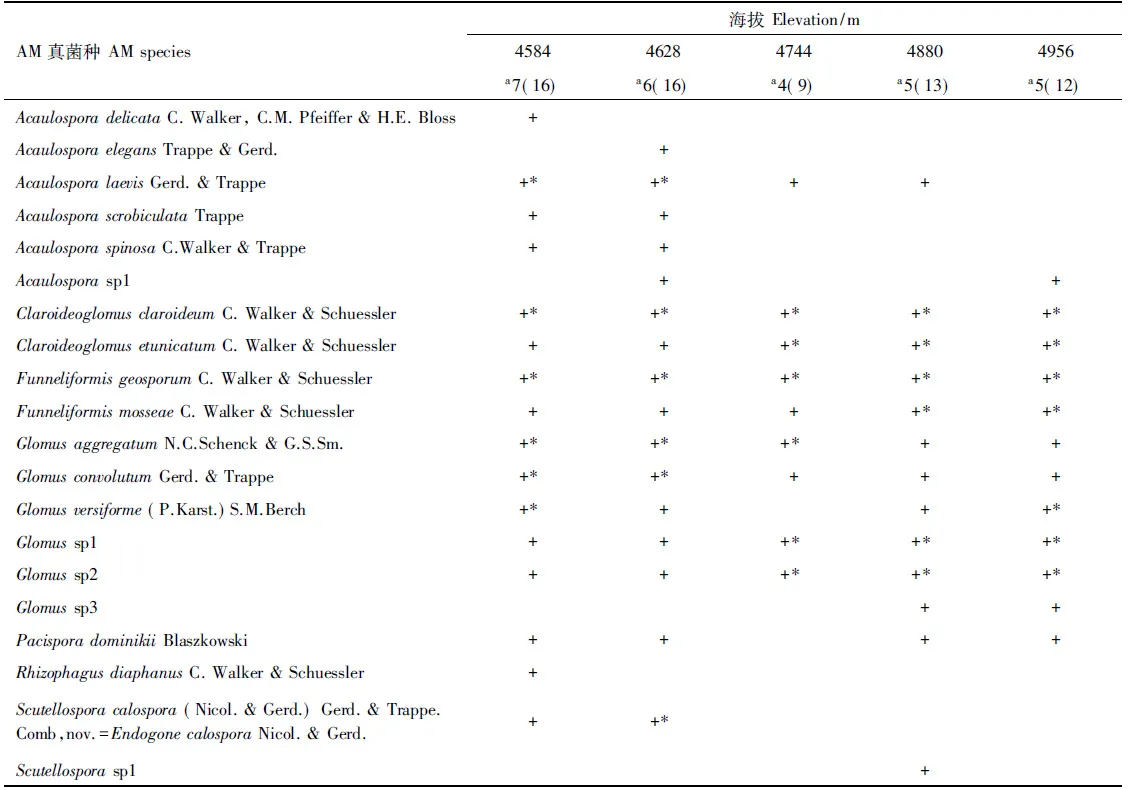
表2 高寒草原AM真菌Table 2 Species composition of AMF in alpine grasslands
高寒草原环境中,随海拔上升,AM真菌物种丰度(r=-0.681,P<0.05)、Shannon-Weiner 指数(H,r=-0.537,P>0.05)均趋下降,但海拔4584—4880 m范围H均无显著差异,但在最高海拔时显著降低;AM真菌孢子密度、物种均匀度随海拔上升在总体上均趋于单峰分布,海拔4744—4880 m不仅对AM真菌的繁殖与产孢较为有利,AM真菌群落受干扰的程度亦较低(图1)。
同种植物根际AM真菌群落在不同海拔梯度中的变化在整体上亦与上述趋势基本一致(表3)。
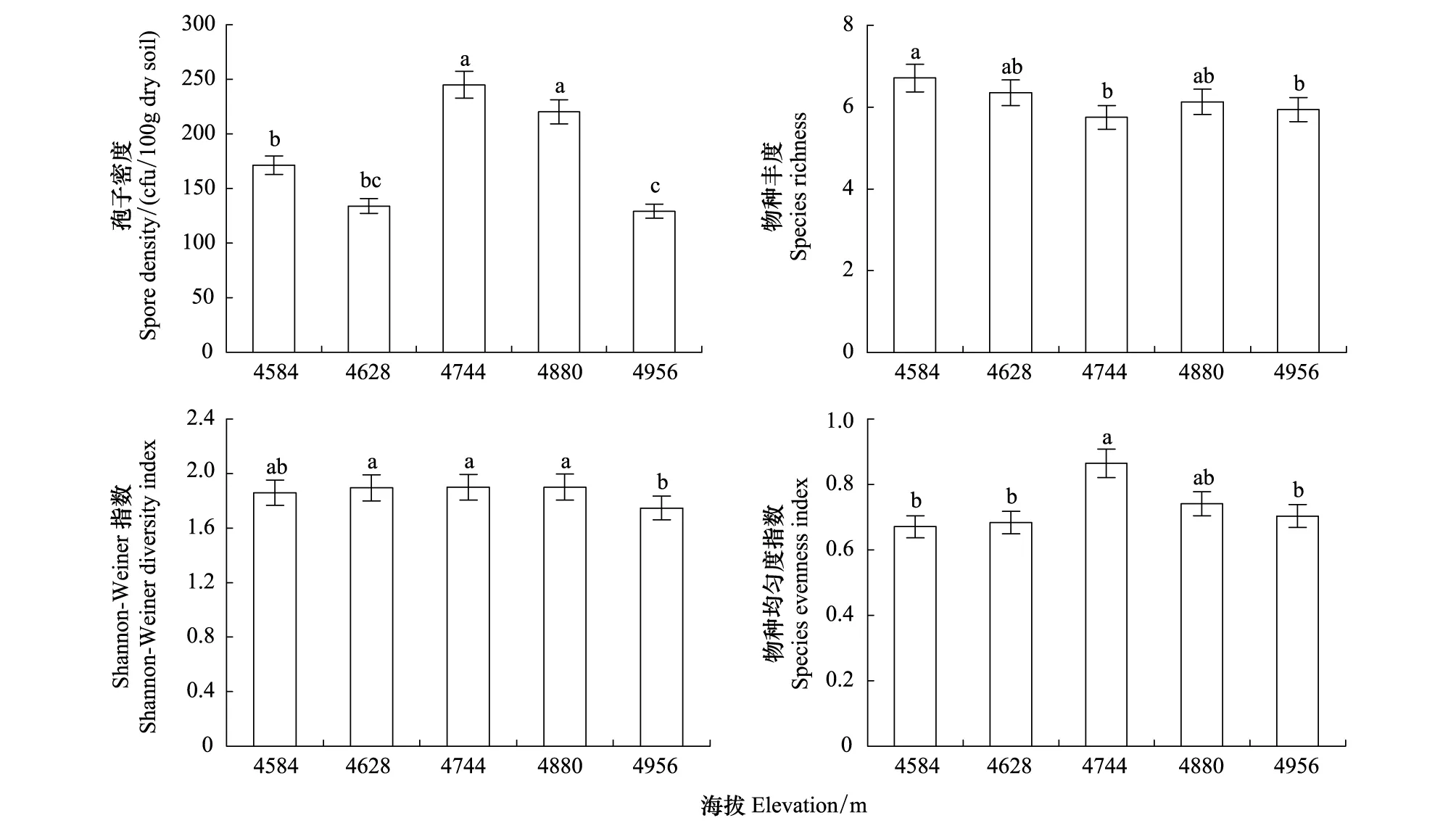
图1 不同海拔梯度AM真菌孢子密度、物种丰度、Shannon-Weiner指数和物种均匀度指数Fig.1 AM fungal spore number,species richness,Shannon-Weiner index and species evenness index at different altitudes gradient图内不同字母表示差异显著(P<0.05)

表3 不同海拔梯度紫花针茅根际AM真菌孢子密度、物种丰度与Shannon-Weiner指数Table 3 Stipa purpurea rhizosphere AMF spore density, species richness and H valuein different altitudinal gradient
2.2 AM真菌群落相似度
不同海拔梯度高寒草原AM真菌群落的Sorensen相似性系数均>0.800,同种植物(如紫花针茅)根际AM真菌群落的Sorensen相似性系数(0.427—0.944)则变化很大。无论是全部建群植物,还是同种建群植物,AM真菌群落相似度在总体上均表现出随海拔梯度扩大而降低的趋势,但同种建群植物根际AM真菌群落Sorensen相似性系数的降幅相对较大(表4)。
2.3 丛枝菌根侵染
随海拔上升,高寒草原建群植物菌根侵染率(F,r=-0.779,P<0.01)、侵染强度(M,r=-0.775,P<0.01)和丛枝丰度(A,r= -0.556,P<0.05)均呈显著下降,不同海拔梯度紫花针茅也表现出相同的趋势(图2)。可见,AM真菌对植物根系的侵染效率受海拔梯度的制约,这与随海拔上升AM真菌物种丰度、物种多样性显著下降的趋势一致。孢子数量对F、M、A均无显著影响,物种丰度,特别是H对菌根侵染率则具有显著影响,H与F(r= 0.940,P<0.01)、M(r= 0.714,P<0.05)、A(r= 0.694,P<0.05)均呈显著正相关,物种丰度则仅对M(r=0.783,P<0.01)、A(r=0.673,P<0.05)具有显著影响。

表4 不同海拔梯度高寒草原AM真菌群落、紫花针茅AM真菌群落Sorensen相似性系数Table 4 Sorensen similarity coefficient of AMF community, Stipa purpurea AMF community at different altitude in alpine grassland

图2 不同海拔梯度菌根侵染率(F)、侵染强度(M)和丛枝丰度(A)Fig.2 AM colonization rate (F), infect intensity (M) and arbuscule richness (A) at different elevation图内不同字母表示差异显著(P<0.05)

表5 土壤因子与孢子密度、物种丰度和H值的相关系数Table 5 Correlation coefficient of spore density, species richness and H value with soil factors
2.4 海拔与土壤因子对AM真菌群落的影响
CCA分析结果表明,第一轴和第二轴的解释量分别为23.0%和2.7%,第一轴的蒙特卡罗检验P<0.01,所有排序轴P<0.01。pH值、有效磷、海拔和有机碳均显著影响AM真菌的群落组成,但相对于其它变量,海拔对AM真菌群落的影响最为显著(图3)。
土壤因子中,土壤pH值对物种丰度、土壤有机碳对H均无显著影响,土壤有效磷对物种丰度、孢子密度和H均无显著影响(表5)。
3 讨论
了解微生物群落的空间分布格局是预测生态系统对全球变化响应的因素之一[25]。不同环境中的微生物群落分布特征不同[1],即使环境条件类似,不同区域微生物群落的组成和功能亦可能不同[3]。近年来,研究者对AM真菌等不可培养微生物的地理分布给予了较多关注[3,26- 27],认为资源的限制是菌根共生体产生区域适应性的驱动力之一[28],生境(地理距离、土壤温度和湿度)或扩散限制的影响对AM真菌的群落形成可能更具重要作用[29]。研究发现,无论是海拔梯度较大的高山,还是海拔梯度较小的草原环境,AM真菌物种丰度、菌根侵染率一般随海拔上升而降低[7,19- 21],对西藏高原不同海拔条件下发育的多类草地的比较研究也有类似的结果[30]。受高原寒旱环境的强烈影响,尽管高寒草原AM真菌类群(7属)远低于藏东南高山环境[7]及全球多类生态系统[31],但AM真菌群落及菌根侵染率亦表现出随海拔上升而下降的趋势,说明高寒草原相对较小的海拔梯度对AM真菌群落和菌根侵染亦存在着显著影响。而AM真菌优势种种数及所占比例随海拔上升均呈显著提高的现象,可能暗示AM真菌对高原寒旱环境的特殊适应策略。孢子数量不能直接反映AM真菌群落对植物根系的侵染[32],但能较好地说明AM真菌的繁殖环境与产孢能力。高寒草原环境中,AM真菌孢子密度随海拔上升呈现较为典型的单峰分布,海拔低于或高于4744—4880 m孢子密度均呈显著降低,表明AM真菌对高原寒旱环境的超强适应及其限度。这与前人有关西藏高原的其它研究结果明显不同,如对西藏山地灌丛草原(海拔3500—4100 m)、高寒草原(海拔4500—4900 m)和高寒草甸(海拔4500—5200 m)的研究发现,不同类型草地间孢子密度随海拔高度上升显著提高,并认为这主要与气候条件(特别是温度)等有关[30],对藏东南色季拉山(海拔1990—2648 m)的研究发现孢子密度随海拔上升显著下降[7]。可见,AM真菌的繁殖与产孢能力可能受不同环境中以海拔为主导因子的多种因素的综合影响和作用。此外,本研究表明,不同海拔梯度高寒草原Glomus属真菌的优势地位均非常明显,这与内蒙古东部典型草原[33]、阿根廷埃尔帕尔玛国家公园草原等植被[34]的研究结果一致,说明Glomus属真菌对高寒环境亦具有极强的适应能力。
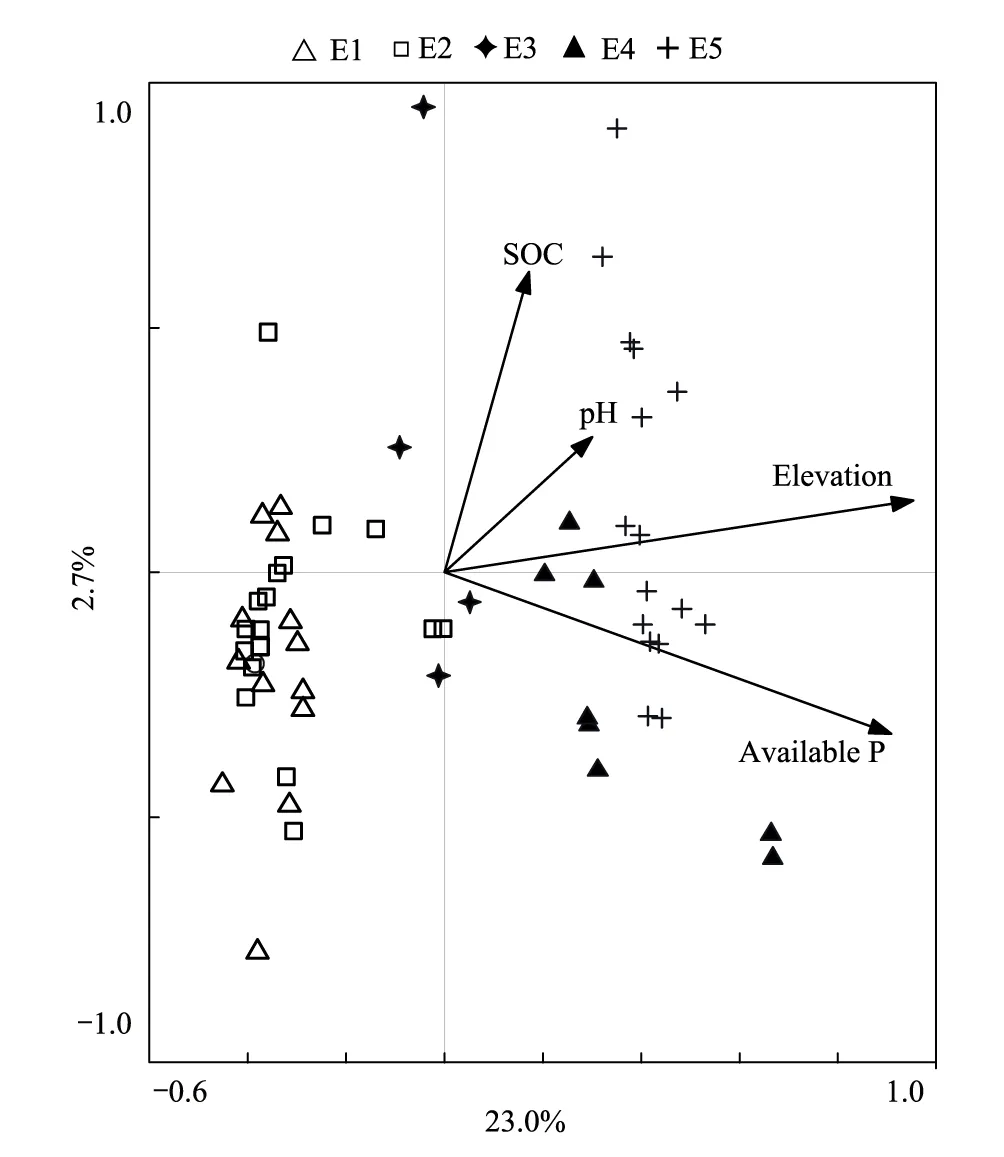
图3 高寒草原样方与环境变量的CCA排序 Fig.3 CCA ranking of alpine grassland plots and environmental variables in alpine grassland
关于海拔对H的影响,对西藏高原不同区域的研究亦有不同的结果。Gai 等[30]发现,海拔最低的山地灌丛草原H较高寒草原、高寒草甸均呈大幅度降低,降幅分别达30.0%、26.9%,高海拔环境H大幅度提高;海拔差异很大的藏东南高山环境中,海拔梯度对H则没有显著影响[7]。高寒草原环境中,海拔4584—4880 m范围H均无显著差异,但至最高海拔显著降低。这些不同的结果表明,环境条件不同,海拔梯度对H的影响亦不相同,这为不同区域生态系统变化的预测提供了理论依据。本研究中,AM真菌孢子密度对菌根侵染效率没有显著影响,而AM真菌种群组成与孢子相对多度的综合影响对提高菌根侵染效率则具有显著作用。
Kivlan 等[29]认为仅在全球背景下,AM真菌群落相似度随地理距离增加而下降,但在洲际尺度并无显著差异。对内蒙古非牧区、自然恢复牧区和过度放牧区的研究发现,人为干扰是导致AM真菌群落相似度非常接近(Sorensen相似性系数在0.504—0.64之间)的根本原因[35]。从总体看,西藏高原不同海拔梯度高寒草原AM真菌群落的Sorensen相似性系数较高。AM真菌扩散主要依靠菌丝的生长,但菌丝扩散距离一般<10 m[36],自然扩散(如风和动物取食)则可能使孢子的传播距离加大至2 km之内,人为因素尤其是农业是导致AM真菌扩散的一个重要原因[36]。主要分布于青藏高原“无人区”的高寒草原尚处于原生状态,因此,受生境和扩散限制的影响,高寒草原AM真菌群落的较高相似度应主要在于不同海拔梯度中AM真菌的自然进化。从单一植物(紫花针茅)看,不同海拔梯度中AM真菌群落相似度的较大差异亦反映了环境的影响。
影响AM真菌群落的多种因素沿海拔梯度所产生的相应变化均可能影响AM真菌的功能和组成[7],其中温度的影响至关重要[37]。高寒草原环境中,对AM真菌群落具有显著影响的土壤pH值、有效磷和有机碳含量受海拔梯度影响。可见,海拔主导下的水热环境所导致的土壤环境变化的综合作用影响着AM真菌的群落组成。因此,如果能进一步了解西藏高寒草原环境,特别是水、热梯度变化对AM真菌群落的影响,将有助于深入理解AM真菌沿海拔梯度变化的实质。同时,土壤pH值、有机碳对高寒草原AM真菌的繁殖与产孢能力也具有显著影响,但影响趋势与藏东南色季拉山完全不同[7],说明生境对AM真菌群落的重要影响。一些研究发现,随土壤pH降低AM真菌物种多样性下降[38- 39],但孢子数量趋于增加[38],高寒草原环境中孢子密度、H值则均随pH下降显著降低。可见,不同环境中影响AM真菌群落、产孢与侵染能力的主导因素、多种因子的综合作用存在差异,更为深入地了解AM真菌群落的地理分布对预测其对高寒草原的影响与作用十分重要。需要指出的是,要全面、深入地理解土壤环境对AM真菌群落的影响,尚需从氮等其它土壤养分,以及土壤质地、土壤结构等方面开展进一步的探索。
4 结论
高原寒旱环境下,相对较小的海拔变化对AM真菌群落组成和菌根侵染具有较为显著的影响。其中,AM真菌种数、物种丰度、菌根侵染效应(菌根侵染率、侵染强度和丛枝丰度)随海拔上升在总体上均趋显著下降,优势种、共有种种数及所占比例则呈相反趋势;AM真菌繁殖与产孢能力对海拔变化亦很敏感,并表现出较为典型的单峰分布格局;Shannon-Weiner 指数(H)随海拔梯度的变化不甚明显,仅至最高海拔4956 m时显著下降;不同海拔梯度中极高的AM真菌Sorensen相似性系数则体现了共有种对群落构成的重要影响,这为进一步探寻具高效抗逆能力的AM真菌的影响与作用提供了重要信息。结果还表明,海拔主导下的土壤环境变化对AM真菌群落组成具有重要影响。
[1] Fierer N, Jackson R B. The diversity and biogeography of soil bacterial communities. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(3): 626- 631.
[2] Zinger L, Lejon D P H, Baptist F, Bouasria A, Aubert S, Geremia R A, Choler P. Contrasting diversity patterns of crenarchaeal, bacterial and fungal soil communities in an alpine landscape. PLoS ONE, 2011, 6(5): e19950.
[3] Martiny J B H, Bohannan B J M, Brown J H, Colwell R K, Fuhrman J A, Green J L, Claire Horner-Devine M, Kane M, Krumins J A, Kuske C R, Morin P J, Naeem S, Øvreås L, Anna-Louise Reysenbach, Smith V H, Staley J T. Microbial biogeography: putting microorganisms on the map. Nature Reviews Microbiology, 2006, 4: 102- 112.
[4] Tang Z Y, Fang JY. A review on the elevational patterns of plant species diversity. Biodiversity Science, 2004, 12(1): 20- 28.
[5] Djukic I, Zehetner F, Mentler A, Gerzabek M H. Microbial community composition and activity in different Alpine vegetation zones. Soil Biology and Biochemistry, 2010, 42(2): 155- 161.
[6] Vandenkoornhuyse P, Ridgway K P, Watson I J, Fitter A H, Young J P W. Co- existing grass species have distinctive arbuscular mycorrhizal communities. Molecular Ecology, 2003, 12(11): 3085- 3095.
[7] Gai J P, Tian H, Yang F Y, Christie P, Li X L, Klironomosa J N. Arbuscular mycorrhizal fungal diversity along a Tibetan elevation gradient. Pedobiologia-international Journal of Soil Biology, 2012, 55(3): 145- 151.
[8] Korb J E, Johnson N C, Covington W W. Arbuscular mycorrhizal propagule densities respond rapidly to ponderosa pine restoration treatments. Journal of Applied Ecology, 2003, 40(1): 101- 110.
[9] Tsuyuzaki S, Hase A, Niinuma H. Distribution of different mycorrhizal classes on Mount Koma, Northern Japan. Mycorrhiza, 2005, 15(2): 93- 100.
[10] Bryant J A, Lamanna C, Morlon H, Kerkhoff A J, Enquist B J, Green J L. Microbes on mountainsides: contrasting elevational patterns of bacterial and plant diversity. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(1): 11505- 11511.
[11] Margesin R, Jud M, Tscherko D, Schinner F. Microbial communities and activities in alpine and subalpine soils. FEMS Microbiology Ecology, 2009, 67(2): 208- 218.
[12] Rillig M C. Arbuscular mycorrhizae and terrestrial ecosystem processes. Ecology Letters, 2004, 7(8): 740- 754.
[13] van der Heijden M G A, Wiemken A, Sanders I R. Different arbuscular mycorrhizal fungi alter coexistence and resource distribution between co-ocurring plant. New Phytologist, 2003, 157(3): 569- 578.
[14] van der Heijden M G A, Bardgett R D, van Straalen N M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecology Letters, 2008, 11(3): 296- 310.
[15] Chaudhary V B, Lau M K, Johnson N C. Macroecology of Microbes-Biogeography of the Glomeromycota. // Vama A. Mycorrhiza. Berlin: Springer-Verlag, 2008: 529- 563.
[16] Sanders I R. Plant and arbuscular mycorrhizal fungal diversity-are we looking at the relevant levels of diversity and are we using the right techniques?. New Phytologist, 2004, 164(3): 415- 418.
[17] Fisher M A, Fule P Z. Changes in forest vegetation and arbuscular mycorrhizae along a steep elevation gradient in Arizona. Forest Ecology and Management, 2004, 200(1- 3): 293- 311.
[18] Chaurasia B, Pandey A, Palni L M S. Distribution, colonization and diversity of arbuscular mycorrhizal fungi associated with central Himalayan rhododendrons. Forest Ecology and Management, 2005, 207(3): 315- 324.
[19] Shi Z Y, Chen Z C, Zhang L Y, Feng G, Christie P, Tian C Y, Li X L. Diversity and zonal distribution of arbuscular mycorrhizal fungi on the northern slopes of the Tianshan Mountains. Science in China Series D: Earth Sciences, 2007, 50(1): 135- 141.
[20] Schmidt S K, Sobieniak-Wiseman L C, Kageyama S A, Halloy S R P, Schadt C W. Mycorrhizal and dark-septate fungi in plant roots above 4270 meters elevation in the Andes and Rocky Mountains. Arctic, Antarctic, and Alpine Research, 2008, 40(3): 576- 583.
[21] Lugo M A, Ferrero M, Menoyo E, Estévez M C, Sieriz F, Anton A. Arbuscular mycorrhizal fungi and rhizospheric bacteria diversity along an altitudinal gradient in South American Puna Grassland. Microbial Ecology, 2008, 55(4): 705- 713.
[22] 西藏自治区土地管理局. 西藏自治区土壤资源. 北京: 科学出版社, 1994: 51- 153.
[23] 向阳. 西藏国土资源. 拉萨: 西藏人民出版社, 1998: 11- 12.
[24] Trouvelot A, Kough J L, Gianinazzi-Pcarson V. Mesure Dutaux de Mycorrhization VA dun Systeme Radiculaire. Recherche de Methodes destimation ayant une signification functionnelle // Gianinazzi-Pearson V, Gianinazzi S. Physiological and Genetic Aspects of Mycorrhizae. Paris: INRA, 1986: 217- 221.
[25] Singh B K, Bardgett R D, Smith P, Reay D S. Microorganisms and climate change: terrestrial feedbacks and mitigation options. Nature Reviews Microbiology, 2010, 8(11): 779- 790.
[26] Venter J C, Remington K, Heidelberg J F, Halpern A L, Rusch D, Eisen J A, Wu D Y, Paulsen I, Nelson K E, Nelson W, Fouts D E, Levy S, Knap A H, Lomas M W, Nealson K, White O, Peterson J, Hoffman J, Parsons R, Baden-Tillson H, Pfannkoch C, Rogers Y H, Smith H O. Environmental genome shotgun sequencing of the Sargasso Sea. Science, 2004, 304(5667): 66- 74.
[27] Fierer N. Microbial biogeography: patterns in microbial diversity across space and time // Zengler K. Accessing Uncultivated Microorganisms: From the Environment to Organisms and Genomes and Back. Washington DC: ASM Press, 2008: 95- 115.
[28] Johnson N C, Wilson G W T, Bowker M A, ilson J A, Miller R M. Resource limitation is a driver of local adaptation in mycorrhizal symbioses. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(5): 2093- 2098.
[29] Kivlin S N, Hawkes C V, Treseder K K. Global diversity and distribution of arbuscular mycorrhizal fungi. Soil Biology and Biochemistry, 2011, 43(11): 2294- 2303.
[30] Gai J P, Christie P, Cai X B, Fan J Q, Zhang J L, Feng G, Li X L. Occurrence and distribution of arbuscular mycorrhizal fungal species in three types of grassland community of the Tibetan Plateau. Ecological Research, 2009, 24(6): 1345- 1350.
[31] 刘润进, 焦惠, 李岩, 李敏, 朱新产. 丛枝菌根真菌物种多样性研究进展. 应用生态学报, 2009, 20(9): 2301- 2307.
[32] Clapp J P, Young J P W, Merryweather J W, Fitter A H. Diversity of fungal symbionts in arbuscular mycorrhizae from a natural community. New Phytologist, 1995, 130(2): 259- 265.
[33] Tian H, Gai J P, Zhang J L, Christie P, Li X L. Arbuscular mycorrhizal fungi associated with wild forage plants in typical steppe of eastern Inner Mongolia. European Journal of Soil Biology, 2009, 45(4): 321- 327.
[34] Velázquez S, Cabello M. Occurrence and diversity of arbuscular mycorrhizal fungi in trap cultures from El Palmar National Park soils. European Journal of Soil Biology, 2011, 47(4): 230- 235.
[35] Su Y Y, Guo L D. Arbuscular mycorrhizal fungi in non-grazed, restored and over-grazed grassland in the Inner Mongolia steppe. Mycorrhiza, 2007, 17(8): 689- 693.
[36] Mangan S A, Adler G H. Consumption of arbuscular mycorrhizal fungi by terrestrial and arboreal small mammals in a Panamanian cloud forest. Journal of Mammalogy, 2000, 81(2): 563- 570.
[37] Koske R E, Gemma J N. Mycorrhizae and succession in plantings of beachgrass in sand dunes. American Journal of Botany, 1997, 84(1): 118- 130.
[38] Coughlan A P, Dalpé Y, Lapointe L, Piché Y. Soil pH induced changes in root colonization, diversity, and reproduction of symbiotic arbuscular mycorrhizal fungi from healthy and declining maple forests. Canadian Journal of Forest Research, 2000, 30(10): 1543- 1554.
[39] Toljander J F, Santos-González J C, Tehler A, Finlay R D. Community analysis of arbuscular mycorrhizal fungi and bacteria in the maize mycorrhizosphere in a long-term fertilization trial. FEMS Microbiology Ecology, 2008, 65(2): 323- 338.
Changes of arbuscular mycorrhizal fungal community in an alpine grassland altitudinal gradient
PENG Yuelin, CAI Xiaobu*
AgriculturalandAnimalHusbandryCollegeofTibetUniversity,Linzhi860000,China
Current studies on the changes in arbuscular mycorrhizal (AM) fungi and root colonization across an altitudinal gradient have mainly focused on alpine environments; however, studies on prairie environments that have a larger area and smaller elevational gradient are markedly insufficient, which limits our understanding of the community composition of AM fungi and their roles across altitudinal gradients. Alpine grassland (mainly composed of cold-resistant and drought-tolerant perennial herbaceous plants), is the largest grassland with the most important ecological functions in the hinterland of the Qinghai-Tibet Plateau. The grassland is characterized by a high altitude (average altitude of 4500—5000 m), with a flat terrain and relatively low elevational change. Therefore, the study of changes in the AM community composition and root colonization across an altitudinal gradient in this extreme environment with low elevational change provides important scientific data for predicting the roles and influences of microorganisms on alpine grasslands as well as understanding the impact of the alpine grassland environment on global environmental change. The present study targeted the alpine grassland in northern Tibet. We analyzed rhizosphere soil samples of colonized alpine grassland plants collected across varying altitudes (4584, 4628, 4744, 4880, and 4956 m) and identified AM fungal spores based on their morphology. The results showed the following: (1) Relatively few genera and species of AM fungi were found in alpine grassland. Four genera, includingAcaulospora,Claroideoglomus,Funneliformis, andGlomus, were observed in every altitudinal gradient. The genusPacisporawas not identified in samples collected at 4744 m altitude. The genusScutellosporawas not found at 4744 m or 4956 m altitude, whereas the genusRhizophaguswas only found at 4584 m altitude. (2) The abundance and diversity of AM fungal species significantly decreased as the altitude increased. No significant differences were observed in the Shannon-Weiner index (H) at 4584—4880 m altitude, while a significant decrease in the index was noted at the highest altitude. The numbers and proportions of dominant species showed significant positive correlations with the altitudinal gradient (FunneliformisgeosporumandClaroideoglomusclaroideumwere the dominant species at different altitudes). In alpine grassland, the proliferation and sporulation of AM fungi were sensitive to changes in altitude. Spore density of AM fungi was observed to be distributed in a typical unimodal manner with increasing altitude. Spore density significantly decreased at altitudes below or above 4744—4880 m. (3) The root colonization rate (F,r=-0.779,P< 0.01), intensity of root colonization (M,r=-0.775,P< 0.01), and arbuscular abundance (A,r=-0.556,P< 0.05) of targeted alpine grassland plants significantly decreased with increasing altitude, indicating that the efficiency of root colonization by AM fungi was restricted by the altitudinal gradient. Spore density had no significant effect onF,M, orA.F(r=0.940,P<0.01),M(r=0.714,P< 0.05), andA(r=0.694,P< 0.05) showed significant increases with increasing altitude. (4) The similarity of the alpine grassland AM fungal community (Sorensen similarity coefficient, 0.821—0.969) was higher at various altitudes, presenting an overall decreasing trend with increasing altitude, which reflects the influence of common species on the AM fungi community. (5) CCA analysis showed that pH, phosphorus, organic carbon, and altitude significantly influenced AM fungal community composition, but compared to the other variables, altitude exerted a higher and more significant impact on the AM fungal community. Thus, changes in soil conditions across an altitudinal gradient play an important role in AM fungal community composition.
altitudinal gradient; composition of AM fungal community; alpine grassland; Northern Tibetan plateau
国家自然科学基金(41161043)
2014- 04- 05;
日期:2015- 04- 20
10.5846/stxb201404050651
*通讯作者Corresponding author.E-mail: xbcai21@sina.com
彭岳林,蔡晓布.丛枝菌根真菌群落沿高寒草原海拔梯度的变化特征.生态学报,2015,35(22):7475- 7484.
Peng Y L, Cai X B.Changes of arbuscular mycorrhizal fungal community in an alpine grassland altitudinal gradient.Acta Ecologica Sinica,2015,35(22):7475- 7484.
