过量表达琥珀酸输出蛋白SucE对谷氨酸棒杆菌厌氧生产琥珀酸的影响
2015-02-03夏慧华尹国民朱年青
夏慧华,尹国民,朱年青,陈 涛*
(1.天津大学化工学院,教育部系统生物工程重点实验室,天津 300072;2.烟台只楚药业有限公司,山东 烟台 264002)
琥珀酸,学名丁二酸,在化学工业中是合成很多重要大宗化学品如四氢呋喃、1,4-丁二醇、γ-丁内酯和己二酸的基本原料[1]。传统的琥珀酸生产是以不可再生资源石油为原料。近年来,随着石油价格的不断增长以及环境污染的压力,生物法制备琥珀酸以其利用可再生资源,固定温室气体二氧化碳等优点成为世界各国关注的焦点[2-3]。由于琥珀酸是三羧酸循环(TCA)的中间物之一,同时也是微生物代谢途径中的共同中间物,因此微生物成为琥珀酸生物合成的理想生产菌。
目前研究最集中的有产琥珀酸放线杆菌(Actinobacillus succinogenes)[4],产琥珀酸厌氧螺菌(Anaerobiospirillumsucciniciproducens)[5],产琥珀酸曼氏杆菌(Mannheimia succiniciproducens)[6],大肠杆菌(Escherichia coli)[7]和谷氨酸棒杆菌(Corynebacteriumglutamicum)[8-9]等。谷氨酸棒杆菌是一种兼性厌氧、生长快速的革兰氏阳性菌。由于其遗传背景清晰且基因操作手段成熟,已被广泛应用于氨基酸、核苷酸、生物塑料以及其它专用化学品的工业化生产。在厌氧的条件下谷氨酸棒杆菌能够高效利用葡萄糖生成各种有机酸。此外,丙酮酸脱氢酶复合体在厌氧条件下处于激活状态,能够提供更多的还原力用于琥珀酸的合成。因此,利用谷氨酸棒杆菌作为宿主生产琥珀酸尤为合适。
高效地将细胞内的琥珀酸输出到胞外,对于琥珀酸的合成具有重要意义。目前大部分细菌中琥珀酸的输出蛋白并不清楚,Huhn等[10]利用生物信息学方法鉴定出谷氨酸棒杆菌中的琥珀酸输出蛋白,并将其命名为SucE(由基因cg2425编码)。失活cg2425导致琥珀酸的输出减少并影响琥珀酸的生产。Fukui等[11]也鉴定了谷氨酸棒杆菌中的琥珀酸输出蛋白基因sucE。微好氧发酵时,过表达sucE能够提高琥珀酸产率,而敲除sucE导致琥珀酸无法运输到胞外,导致糖耗速率、琥珀酸生产速率和琥珀酸得率均下降,厌氧下缺失sucE的菌株不生产琥珀酸。
本研究以实验室构建的谷氨酸棒杆菌C.glutamicumXZ为出发菌株,构建了重组表达质粒pExhsucE,并进一步构建了菌株 C.glutamicumXZ(pExhsucE)。研究考察了过量表达琥珀酸输出蛋白SucE对厌氧发酵生产琥珀酸的影响,并进行了通量分析。该研究对提高琥珀酸的生产速率和产量有重要意义,对琥珀酸的工业化生产应用也有一定的参考价值。
1 实验部分
1.1 主要材料和实验仪器
试剂:硫酸卡那霉素、氯霉素、酵母提取物、胰蛋白胨、基因组提取试剂盒、DNA胶回收试剂盒、PCR产物纯化试剂盒和质粒DNA小量抽提试剂盒均购自上海生工生物工程有限公司;Fast Pfu高保真快速DNA聚合酶购自北京全式金,限制性内切酶和T4 DNA连接酶均购自加拿大富酶泰斯Fermentas公司。其他试剂为国产分析纯。
仪器:TU1901双光束紫外可见分光光度计(北京普析通用仪器有限公司);BioFlo 110系列1.3 L小型发酵罐(美国 NewBrunswick Scientific);SBA40C生物传感仪(山东省科学院生物研究所);HP 1100 LC高效液相色谱仪(Agilent Technologies,USA)。
1.2 菌株和质粒
大肠杆菌 DH5α和谷氨酸棒杆菌 C.glutamicumATCC 13032由本实验室保藏;C.glutamicumXZ(在 ATCC13032△ldhA△pta△pqo△cat的基础上过表达丙酮酸羧化酶、磷酸烯醇式丙酮酸羧化酶、柠檬酸合酶、异柠檬酸裂解酶和苹果酸合酶)由本实验室之前构建;质粒 pExh(在穿梭质粒 pECXK99E的基础上过表达丙酮酸羧化酶和柠檬酸合酶)由本实验室之前构建。
1.3 质粒的构建
首先用试剂盒提取C.glutamicumATCC13032基因组DNA并以其为模板,按照引物 sucE1、sucE2(sucE1:5’-CGCG TCTAGA ACCAAGACCGCTG TTGCAGTGA-3’;sucE2:5’-AGAT CCTGCAGGTGCGC TTAAGGGGTCAATGC-3’,带下划线的部分为限制性酶切位点)进行sucE基因的PCR扩增,启动子采用基因自身的启动子序列。纯化后的sucE基因片段与载体pExh分别经 Xba I和 Sbf I双酶切,酶切产物纯化后用T4 DNA连接酶连接得到表达载体pExhsucE,并电转化到XZ感受态细胞,涂布含有卡那霉素和氯霉素的BHIS平板,挑选抗性克隆,提质粒进行Xba I和Sbf I双酶切鉴定。
1.4 代谢通量分析
代谢通量分析网络和反应式分别如图3和表1所示,包括葡萄糖吸收途径、糖酵解途径、三羧酸循环途径、乙醛酸循环途径和副产物生成途径。v1到v16代表不同的途径。由于实际实验中发现,谷氨酸棒杆菌在厌氧条件下不合成生物量[12-13],因此生物量方程没有包括在代谢通量分析中。由于胞内存在很多无效循环,因此可忽略ATP总量的平衡[14]。

表1 谷氨酸棒杆菌ATCC 13032中心代谢反应式Tab le 1 Reactions of the centralmetabolic model of C.glutamicumATCC13032
与 Schez等[14]的研究方法相同,PEP和 Pyr节点作为一个点考虑,并将PEP到OAA的通量和Pyr到OAA的通量合并为v4。通过质量守恒和胞内氧化还原平衡可以得到如表2所示的中间代谢物方程。包括16个反应和10个中间代谢物,方程的自由度为6。有7个速率是通过实验测定,包括葡萄糖的消耗速率 v1,琥珀酸、苹果酸、延胡索酸、丙酮酸、酮戊二酸和乙酸的生成速率(分别为 v16、v11、v13、v5、v15、v6),其余的速率通过 Matlab 计算得到。
1.5 培养基
LB培养基:10 g·L-1胰蛋白胨,5 g·L-1酵母抽提物,5 g·L-1氯化钠;BHIS固体培养基:牛脑心浸粉 37 g·L-1,山梨醇 91 g·L-1,按照比列加入 1.5%(质量体积比)的琼脂粉,115℃高压蒸汽灭菌30 min。
CGIII培养基:10 g·L-1胰蛋白胨,10 g·L-1酵母抽提物,21 g·L-1MOPS,用 1 mol·L-1NaOH调节pH值到7.4,115℃高压蒸汽灭菌30 min。CGXII培养基参考谷氨酸棒杆菌手册[15]。

表2 谷氨酸棒杆菌厌氧代谢的化学计量关系Tab le 2 Stoichiometric relationships for the anaerobic fermentation with C.glutamicum
1.6 发酵培养
1.6.1 摇瓶发酵培养
摇瓶发酵采用两阶段操作法:1)取-80℃保藏的种子培养液接入20 mL CGIII培养基中,30℃,200 r/min过夜培养。以20%接种量接种到50 mL的CGIII培养基中,添加葡萄糖至浓度为20 g·L-1,30℃,220 r/min培养至对数后期,OD600约为 20。2)将上述 50 mL培养液于 4℃,5 000×g离心15 min。用 CGXII培养基洗涤菌体 2次,再用CGXII培养基悬浮菌体,接入到50 mL封闭的血清瓶中。发酵初始 OD600约为40,添加葡萄糖、NaHCO3和 MgCO3至浓度分别为 20 g/L、200 mmol·L-1和20 g/L。30℃,180 r/min振荡培养。
1.6.2 发酵罐发酵培养
用同一发酵罐两阶段生产琥珀酸:采用CGIII丰富培养基培养,将菌株接种到1.3 L发酵罐中,保持通气量为1 L·min-1。通过溶氧和转速的偶联控制使得好氧阶段(阶段I)的溶氧水平保持在30%左右。当菌株生长到对数期时,降低转速到300 r/min,降低通气量到 0.5 L·min-1,20 min后通入 CO2,添加200 mmol/L的 NaHCO3和 2%MgCO3;采用 6 mol/L的KOH和3 mol/L的K2CO3调节pH值。
发酵培养基中均添加终浓度为25 mg·L-1的硫酸卡那霉素和6 mg·L-1的氯霉素。
1.7 代谢产物分析
细胞生长是用紫外可见分光光度计于波长600 nm处测定吸光度值,生物量(CDW)是由公式CDW=0.25×OD600g·L-1换算得到。培养基中的葡萄糖用生物传感仪检测,有机酸用高效液相色谱法(HPLC)检测,包括紫外吸光度检测器(UV,Agilent Technologies)和示差检测器(RI)。 HPLC以阳离子交换柱(HPX-87H,BioRad,USA)来分离样品,流动相为5 mmol/L的 H2SO4,流速为0.5 mL·min-1,紫外检测波长210 nm。
2 结果与讨论
2.1 sucE基因的克隆
图1a)为以C.glutamicumATCC 13032基因组为模板PCR扩增得到的sucE片段,大小2.2 kb,与理论值相同。将sucE片段和载体pExh分别酶切、连接后得到表达载体 pExhsucE。重组质粒 pExhsucE经Xho I单酶切鉴定,分别得到1.6 kb、3.7 kb和8.7 kb的3个片段,见图1b),与预期结果一致。对pExhsucE质粒中的sucE基因测序后发现与NCBI公布的碱基序列完全一致。
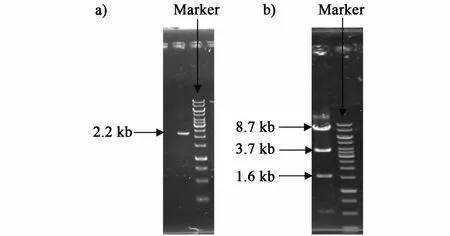
图1 sucE基因的克隆Fig.1 Cloning of gene sucE
2.2 摇瓶厌氧发酵
将表达质粒pExhsucE电转化到菌株C.glutamicumXZ中得到突变菌株 C.glutamicumXZ(pExhsucE)。按照上述的方法对突变菌株C.glutamicumXZ(pExhsucE)进行厌氧血清瓶发酵。发酵过程的糖消耗和有机酸产量如表3所示。突变菌株C.glutamicumXZ(pExhsucE)12 h内耗尽葡萄糖,产生158.4 mmol/L琥珀酸,1 mol glucose得率为1.43 mol,相对于菌株C.glutamicumXZ提高了7%,而且所有副产物的生成都显著的降低。此外,如图2所示,相对于菌株 C.glutamicumXZ,突变株 C.glutamicumXZ(pExhsucE)的琥珀酸生产率提高了19%(2.17和1.82 mmol·gCDW-1·h-1),葡萄糖的比消耗速率提高了 8%(1.50 和 1.34 mmol·gCDW-1·h-1)。
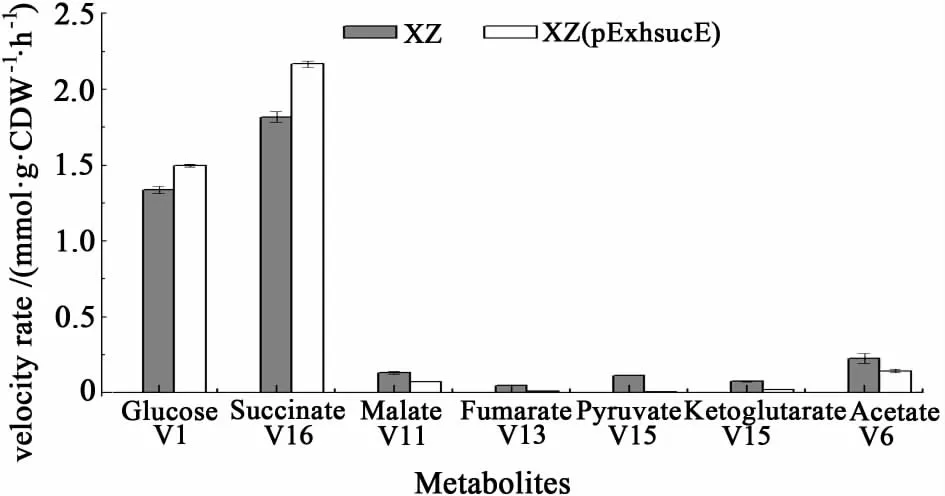
图2 突变株C.glutamicumXZ和C.glu tamicumXZ(pExhsucE)的葡萄糖消耗速率和有机酸生产速率Fig.2 Specific rates of glucose consump tion and organic acids production of strain C.glutamicumXZ and C.glu tamicumXZ(pExhsucE)

表3 谷氨酸棒杆菌突变株的厌氧发酵Tab le 3 Fermentation by C.glutamicumstrains under anaerobic conditions
2.3 代谢通量分析
为了研究过表达sucE基因对通量分布的影响,分别对突变株 C.glutamicumXZ(pExhsucE)和 C.glutamicumXZ进行了通量比较分析。按照上述方法发酵菌株12 h,测定发酵液中葡萄糖的比消耗速率以及琥珀酸、乙酸、丙酮酸、酮戊二酸、延胡索酸和苹果酸的比生成速率。根据建立的方程,求解出未知步骤的通量。图3显示了归一化处理后的通量分布。
从图3中可以看出,过表达基因 sucE后,突变株C.glutamicumXZ(pExhsucE)的乙醛酸循环相对通量v5增加了50%,并且TCA还原臂通量v14和乙醛酸循环通量v10的比值为127/19,这与最佳的琥珀酸合成途径的通量分布更为接近(1 mol glucose琥珀酸得率为理论最大值1.71 mol时,TCA还原臂与乙醛酸循环的通量比值为 143/29)[16]。Fukui等[11]发现在C.glutamicumR菌株中,提高 sucE基因的表达量能够显著降低胞内的琥珀酸浓度,从而减轻其对乙醛酸循环功能的抑制。由此,我们的实验结果表明过量表达琥珀酸输出蛋白能够激活乙醛酸循环。
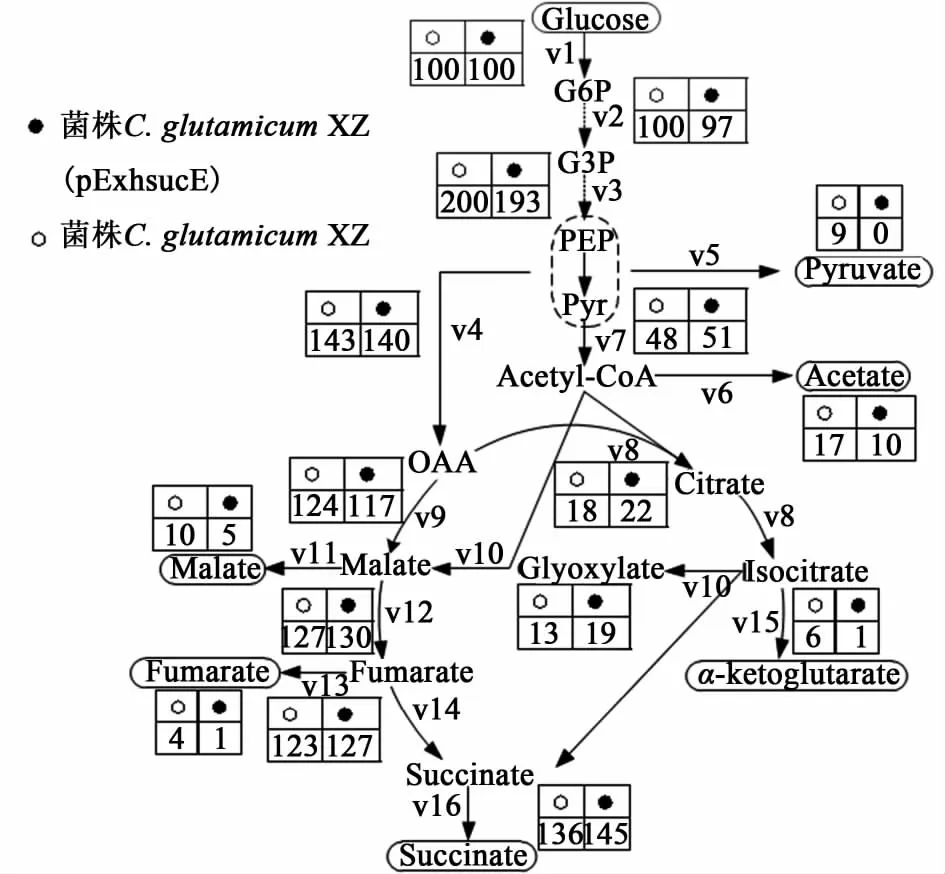
图3 突变株C.glu tamicumXZ和C.glu tamicumXZ(pExhsucE)的通量分布Fig.3 Flux d istributions of C.glutamicumXZ and C.glutamicumXZ(pExhsucE)
2.4 同一发酵罐两阶段生产琥珀酸
Inui等[17-18]研究了一种两阶段发酵生产琥珀酸的方式。首先好氧培养富集菌体,然后离心转入另一个生物反应器中厌氧发酵,虽然这种方式能够得到高的琥珀酸产量和生产率,但放大到工业生产对于成本控制将是一个很大的挑战。因此我们研究了在单一发酵罐中:1)好氧培养菌体;2)逐渐过渡到厌氧阶段,利用静止细胞生产琥珀酸的两阶段方式。这种发酵方式的优势在谷氨酸棒杆菌生产异丁醇的过程中也有所体现[12]。
以突变株C.glutamicumXZ(pExhsucE)为发酵菌株,采用CGIII培养基进行两阶段培养。发酵罐中的初始OD600为 7.2,通气量为 1 L·min-1。通过溶氧和转速的偶联控制使得好氧阶段(阶段I)的溶氧水平保持在30%左右。如图 4所示,4 h时候OD600达到 38.3,此时处于对数期,把转速降低到300 r/min,通气量降低为 0.5 L·min-1, 20 min 后通入 CO2,添加200 mmol/L的 NaHCO3和2%MgCO3;采用6 mol/L KOH和3 mol/L的K2CO3调节pH值。琥珀酸产量为518 mmol/L,厌氧阶段(阶段 II)的比生产率是 0.95 mmol gCDW-1·h-1,1 mol glucose平均得率为1.5 mol。

图4 厌氧条下分批补料生产琥珀酸Fig.4 Fed-Batch fermentations for succinate p roduction
3 结论
1)本研究以实验室自主构建的谷氨酸棒杆菌C.glutamicumXZ为出发菌株,以质粒的形式pExhsucE过量表达了琥珀酸输出蛋白。重组菌株C.glutamicumXZ(pExhsucE)的琥珀酸得率提高7%,生产率提高19%,并且葡萄糖的比消耗速率提高8%。另外,通量分析表明,过表达sucE基因后乙醛酸循环的通量提高了5%。
2)采用两阶段发酵培养方式,在1.3 L的发酵罐中发酵突变株 C.glutamicumXZ(pExhsucE),琥珀酸产量达到518 mmol/L,厌氧阶段的比生产率为0.95 mmol gCDW-1·h-1,1 mol glucose平均得率为1.5 mol。
[1]Cheng K,Zhao X,Jing Z,et al.Biotechnological production of succinic acid:Current state and perspectives[J].Biofuels, Bioproducts and Biorefining, 2012, 6(3): 302-318
[2]Detlef W.What should and what can biotechnology contribute to chemical bulk production[J].FEMSMicrobiology Reviews, 1995, 16(2/3): 89-100
[3]Bozell J J,Gene R P.Technology development for the production of biobased products frombiorefinery carbohydrates—The USDepartment of Energy′s“Top 10” revisited[J].Green Chemistry, 2010, 12 (4):525-728
[4]Zou W,Zhu L,Li H,et al.Significance of CO2donor on the production of succinic acid by Actinobacillus succinogenes ATCC 55618[J].Microbial Cell Factories,2011,10:87-116
[5]Bretz K,Kabasci S.Feed-Control development for succinic acid production with Anaerobiospirillumsucciniciproducens[J].Biotechnology Bioengineering,2012,109(5):1 187-1 192
[6]Lee JW,Lee SY.Proteome-Based physiological analysis of themetabolically engineered succinic acid producer Mannheimia succiniciproducens LPK7[J].Bioprocess and BiosystemEngineering, 2010, 33 (1):97-107
[7]Thakker C,San K Y,Bennett G N.Production of succinic acid by engineered E.coli strains using soybean carbohydrates as feedstock under aerobic fermentation conditions[J].Bioresoure Technology, 2013, 130:398-405
[8]Litsanov B,Brocker M,Bott M.Toward homosuccinate fermentation:Metabolic engineering of Corynebacteriumglutamicumfor anaerobic production of succinate fromglucose and formate[J].Applied and Environmental Microbiology, 2012, 78(9): 3 325-3 337
[9]Litsanov B,Kabus A,Brocker M,et al.Efficient aerobic succinate production fromglucose in minimal mediumwith Corynebacteriumglutamicum[J].Microbial Biotechnology, 2012, 5(1): 116-128
[10]Huhn S,Jolkver E,Kramer R,et al.Identification of the membrane protein SucE and its role in succinate transport in Corynebacteriumglutamicum[J].App lied Microbiology and Biotechnology, 2011, 89 (2):327-335
[11]Keita F,Koseki C,Yamamoto Y,et al.Identification of succinate exporter in Corynebacteriumglutamicumand its physiological roles under anaerobic conditions[J].Journal Biotechnology, 2011, 154(1): 25-34
[12]Bastian B, Riester T, Wieschalka S, et al.Corynebacteriumglutamicumtailored for efficient isobutanol production[J].Applied and Environmental Microbiology,2011, 77(10): 3 300-3 310
[13]Litsanov B,Brocker M,BottM.Towards homosuccinate fermentation:Metabolic engineering of Corynebacteriumglutamicumfor anaerobic succinate production fromglucose and formate[J].App lied and Environmental Microbiology, 2012, 78(9): 3 325-3 337
[14]Sanchez A M,Bennett G N,San K.Batch culture characterization and metabolic flux analysis of succinate-producing Escherichia coli strains[J].Metabolic Engineering, 2006, 8(3): 209-226
[15]Eggeling L,Bott M.Handbook of Corynebacteriumglutamicum[M].USA: CRC Press,2005
[16]Sanchez A M,Bennett G N,San K.Novel pathway engineering design of the anaerobic centralmetabolic pathway in Escherichia coli to increase succinate yield and productivity[J].Metabolic Engineering, 2005, 7(3):229-239
[17]Inui M,Murakami S,Okino S,et al.Metabolic analysis of Corynebacteriumglutamicumduring lactate and succinate productions under oxygen deprivation conditions[J].Journal of Molecular Microbiology and Biotechnology, 2004, 7(4):182-196
[18]Inui M,Kawaguchi H,Murakami S,et al.Metabolic engineering of Corynebacteriumglutamicumfor fuel ethanol production under oxygen-deprivation conditions[J].Journal of Molecular Microbiology and Biotechnology,2004, 8(4):243-254
