新型四齿手性含硫(氮)配体的合成及其在芳香酮不对称氢转移中的应用*
2015-02-02于会娟莫伟杰广东工业大学轻工化工学院广东广州510006
于会娟,赵 营,何 军,莫伟杰,余 林(广东工业大学轻工化工学院,广东广州 510006)
新型四齿手性含硫(氮)配体的合成及其在芳香酮不对称氢转移中的应用*
于会娟,赵营,何军,莫伟杰,余林
(广东工业大学轻工化工学院,广东广州510006)
摘要:以(1R,2R) -环己二胺酒石酸盐为原料,分别与2-噻唑甲醛和4-咪唑甲醛经缩合反应合成了两个四齿手性亚胺配体——(1R,2R) -N,N'-二(2-噻唑基) -1,2-环己二胺(L1,CCDC: 1 003 830)和(1R,2R) -N,N'-二(4-咪唑基) -1,2-环己二胺(L2),其中L1为新化合物,其结构经1H NMR,ESI-MS,元素分析和X-单晶衍射表征。研究了L1和L2分别与金属络合物[MR]经原位反应制得的催化剂(和)对苯乙酮经不对称氢转移反应合成手性α-苯乙醇的催化性能。结果表明: L1与[IrCl(cod)]2经原位反应制得的催化剂的催化活性优于。以异丙醇为氢源,在异丙醇/氢氧化钾反应体系中,研究了对芳香酮的不对称氢转移。结果表明:能有效地催化还原芳香酮,大部分芳香酮的转化率均>99%。
关键词:手性四齿配体;不对称氢转移;芳香酮;手性芳香醇仲醇;合成;催化活性
E-mail: xiaoheiyu79@163.com
通信联系人:余林,教授,博士生导师,E-mail: gychgdut@126.comAbstract: Two chiral sulphur(nitrogen) -containing tetradentate ligand,(1R,2R) -N,N'-bis(2-thiazolyl) -1,2-cyclohexyldiimine (L1) and (1R,2R) -N,N'-bis (4-imidazolyl) -1,2-cyclohexyldiimine (L2),were synthesized by condensation of 1,2-cyclohexyldiimine with 2-thiazole and 4-imidazole,respectively.L1(CCDC: 1 003 830) was a novel compound and the structure was characterized by1H NMR,ESI-MS,elemental analysis and X-ray single crystal diffraction.Two series of catalysts,and,were prepared by reaction in-suit of L1 or L2 with metal complexes[MR].The catalytic activities ofandwere investigated by asymmetric transfer hydrogenation(ATH) of acetophenone with i-PrOH.The results showed that,which was obtained by reaction in-suit of Cat1with[IrCl(cod)]2,exhibited better catalytic activity than.Catalytic activities ofwere investigated by ATH of aromatic ketones in i-PrOH/KOH.The results indicated that aromatic ketones with conversion of>99% were reduced to chiral secondary aromatic alcohol,usingas the catalyst.
Synthesis of Novel Tetradentate Chiral Sulphur(nitrogen) -containing Ligands and Their Application in Asymmetric Transfer Hydrogenation
YU Hui-juan,ZHAO Ying,HE Jun,MO Wei-jie,YU Lin
(School of Chemical Engineering and Light Industry,Guangdong University of Technology,Guangzhou 510006,China)
Keywords: tetradentate chiral ligand; asymmetric transfer hydrogenation; aromatic ketone; chiral secondary aromatic alcohol; synthesis; catalytic activity
具有光学活性的芳香仲醇是重要的化工产品,在医药、农药、香料等精细化工领域应用广泛。芳香酮的不对称氢转移(AHT)催化由于具有高效、环保、成本低廉、操作简单等优点而成为制备手性芳香仲醇的最佳方法。手性配体是实现高选择性不对称氢化的关键,优秀手性配体的设计与合成一直是科学家们关注的热点[1-3]。近年来,研究者们在传统的配体中引入了氮元素,同时发现含氮配体存在优异的手性催化效果和立体选择性,其中以Noyori等合成的Ts-DPEN最为著名[1-3]。
近年来,一系列[PN],[NPN],[NPO]及[PNNP]等优异的“混合型”手性配体不断涌现。由于这类“混合型”配体与金属中心配位时具有更好的稳定性并能够形成特殊的手性环境,因而倍受关注[4-7]。而在这些“混合型”多齿配体中,含硫配体的报道则相对较少,但含硫手性配体比传统的膦、氮、氧配体具有更好的通用性,而且含硫手性配体可以呈不同的立体形状,具有丰富的配位化学性能,可以巧妙地修饰催化剂金属中心的手性微环境,因此一些含硫手性配体被合成并表现出优异的不对称催化性能[8-11]。
噻唑是一个五元富电子含硫杂环,环上的硫和氮可以直接与金属中心配位,而环的富电子效应又可以影响配体的催化性能,而噻唑类多齿配体用于芳香酮不对称氢化领域的极少有报道。
在文献[12]方法的基础上,本文以(1R,2R) -环己二胺酒石酸盐(1)为原料,分别与2-噻唑甲醛(2)和4-咪唑甲醛(3)经缩合反应合成了两个四齿手性亚胺配体——(1R,2R) -N,N'-二(2-噻唑基) -1,2-环己二胺(L1)和(1R,2R) -N,N'-二(4-咪唑基) -1,2-环己二胺(L2) (Scheme 1),其中L1为新化合物,其结构经1H NMR,ESI-MS,元素分析和X-单晶衍射表征。研究了L1和L2分别与金属络合物[MR]经原位反应制得的催化剂(和)对苯乙酮(4a)经AHT合成手性α-苯乙醇(5a)的催化性能。结果表明: L1与[IrCl(cod)]2经原位反应制得的催化剂的催化活性优于。对反应底物进行扩展,以异丙醇为氢源,在异丙醇/氢氧化钾反应体系中,研究了对芳香酮(4b~4i)的ATH反应(Scheme 2)。结果表明:能有效地催化还原4b~4i,大部分芳香酮的转化率均>99%。

Scheme 1

Scheme 2aConversion and ee were determined by GC analysis using chiral CP-chirasil-dex CB column
1 实验部分
1.1仪器与试剂
Bruker AV400 MHz型核磁共振仪(DMSO-d6为溶剂,TMS为内标) ; Nicolet Avatar 360 FT-IR型红外光谱仪(KBr压片) ; LCQ System型液相色谱质谱联用仪; Aglient GC-7820型气相色谱仪[Astec CHIRALDEXTM G-TA Capillary Colum(30 m×0.25 mm×0.25 μm)手性毛细管色谱柱,FID检测器,柱温110℃]; Perkin-Elmer 240Q型元素分析仪; Bruker SMART Platform CCD型X-射线衍射仪。
所用试剂均为分析纯,广州化学试剂厂或J&K Chemical试剂公司。
1.2 L1和L2的合成(以L1为例)
在三颈圆底烧瓶中加入1 2.64 g(10 mmol) 和2 2.26 g(20 mmol),通氮气除氧,氮气保护下加入无水乙醇45 mL,搅拌下回流反应8 h。氮气保护下过滤,滤液减压浓缩后于40℃真空干燥,用无水乙醇重结晶得棕色晶体L1 2.70 g,产率89%;1H NMR δ: 8.35(s,2H),7.89(s,2H),7.76(s,2H),3.48(s,1H),2.51(s,1H),1.80 (d,J =8.0 Hz,4H),1.65(d,J =9.0 Hz,4H) ; ESI-MS m/z: 305.1{[M + H]+} ; Anal.calcd for C14H16N4S2: C 55.23,H 5.30,N 18.40; found C 55.38,H 5.28,N 18.26。
用3替代2,用类似的方法合成棕色晶体L2 2.35 g,产率87%;1H NMR δ: 12.21(br,2H),8.04(s,2H),7.39(s,2H),5.75(s,2H),3.29 (s,1H),2.50(s,1H),1.75(m,4H),1.42(d,J =7.0 Hz,4H) ; ESI-MS m/z: 271{[M + H]+} ; Anal.calc for C14H18N6: C 62.20,H 6.71,N 31.09; found C 62.38,H 6.80,N 30.82。
1.3 4的ATH反应
在Schlenk反应管中加入[MR]0.01 mmol和L 0.02 mmol,注入异丙醇6 mL,搅拌20 min;加入异丙醇/KOH溶液(PrOH 6 mL + KOH 2.2 mg),反应10 min。注入4 1 mmol,于45℃反应13 h。经气相色谱测定转化率和芳醇(5)的ee值。
1.4 L1的晶体结构测定
将L1 10 mg溶于20 mL乙醇中,搅拌使其溶解;于室温静置自然挥发得棕色晶体L1。选取合适的单晶L1置衍射仪上,于173.2 K下用经石墨单色器单色纯化的Mo-Kα射线为光源,以ω方式扫描,收集衍射数据,全部强度数据经Lp校正和吸收校正。结构由直接法通过SHELXTL软件解出,全部非氢原子坐标、各项异性温度因子和氢原子坐标及各向同性温度因子经全矩阵最小二乘法F2精修修正至收敛。所有计算均使用SHELXL-97程序包完成,全部非氢原子经Fourier合成及差值电子密度函数修正,全部氢原子坐标从差值电子密度函数并结合几何分析方法获得[13]。
2 结果与讨论
2.1表征
L1的晶体结构见图1。晶体结构解析表明: L1(304.08)属正交晶系,P212121空间群,晶胞参数a =7.689 6(17)Å,b =11.445(3)Å,c =17.712 (4)Å,α=β=γ=90°,V =1 558.8(6)Å3,Dc = 1.297 g·cm-3,μ=0.337 mm-1,Z =4。L1的键长和键角数据以及原子坐标和等效温度因子等相关晶体数据以DIF-file形式存放于剑桥晶体数据中心(CCDC: 1 003 830)。

图1 L1的分子结构图Figure 1 Molecular structure drawing of L1
L1和L2的CD光谱表明: (R,R) -L和(S,S) -L构型显示出非常对称的镜面对映曲线(图2)。
2.2催化活性
(1)[MR]
将L1和L2与[MR]原位制备组成催化体系,评价其对苯乙酮(4a)的催化氢化性能(表1),筛选最佳的催化剂。从表1可见,L1与[IrCl (cod)]2原位制备的催化体系()对4a表现出一定的催化活性,获得了30%的转化率(No.4)。而L2与Ru,Rh,Ir三种金属络合物组成的催化体系均未表现出有效的催化效果(No.5~No.8),说明噻唑环上的硫原子可能与金属铱进行了配位,硫原子的引入有助于提高催化反应活性。
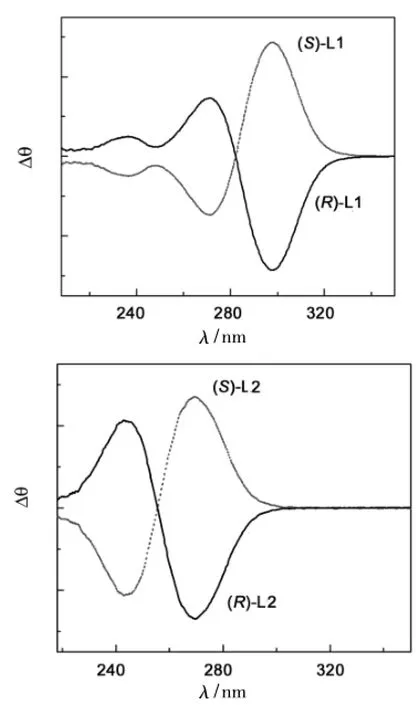
图2 L1和L2的CD光谱图Figure 2 CD spectra of L1 and L2

表1 [MR]与L1或L2催化4a的ATH反应aTable 1 ATH reaction of 4a with L1 or L2 and[MR]
(2) ATH反应条件优化
碱的用量对反应的影响见表2中No.5~No.8。从中可见,在没有添加碱时,4a基本没有转化(No.5) ;随着其碱量的增加,转化率明显升高;当碱与金属配合物的摩尔比为16∶1时,反应只需要2.5 h即可实现完全转化(No.7) ;继续增加碱量,反应时间增长(No.8),说明16∶1为最佳碱添加量。

表2 Cat1Ir催化体系反应条件优化aTable 2 Optimization of the reaction conditions of Cat1Ir
(3)底物扩展
3 结论
设计并合成了两个手性四齿亚胺配体L1和L2。研究配体对芳香酮的不对称氢转移催化效果。结果表明: L1和配合物[IrCl(cod)]2原位制备的催化剂可以有效催化还原芳香酮,对于绝大部分的芳香酮均可实现完全转化,并具有中等的立体选择性(ee 42%)。L2与Ru,Rh,Ir三种金属络合物组成的催化体系均未表现出有效的催化效果,说明噻唑环的硫原子对于芳香酮的不对称催化还原具有重要意义。虽然手性含P,N,O的配体被广泛用于芳香酮的不对称氢转移催化,而手性含硫配体的研究却相对较少,手性含硫杂环配体的研究更为稀少,本文的结果将对新型高效手性含硫配体的设计提供重要的实验依据。
参考文献
[1]Ikariya T,Murata K,Noyori R.Bifunctional transition metal-based molecular catalysts for asymmetric syntheses[J].Org Biomol Chem,2006,4: 393-406.
[2]S E Clapham,A Hadzovic,R H Morris.Mechanisms of the H2-hydrogenation and transfer hydrogenation of polar bonds catalyzed by ruthenium hydride complexes [J].Coord Chem Rev,2004,248: 2201-2237.
[3]Gladiali S,Alberico E.Asymmetric transfer hydrogenation: Chiral ligands and applications[J].Chem Soc Rev,2006,36: 226-236.
[4]Malacea R,Poli R,Manoury E.Asymmetric hydrosilylation,transfer hydrogenation and hydrogenation of ketones catalyzed by iridium complexes[J].Coord Chem Rev,2010,254: 729-752.
[5]Sues P E,Demmans K Z,Morris R H.Rational development of iron catalysts for asymmetric transfer hydrogenation[J].Dalton Trans,2014,43: 7650-7667.
[6]Zuo W W,Lough A J,Li Y F,et al.Amine(imine) diphosphine iron catalysts for asymmetric transfer hydrogenation of ketones and imines[J].Science,2013,342: 1080-1083.
[7]S W Krabbe,M A Hatcher,R K Bowman,et al.Copper-catalyzed asymmetric hydrogenation of aryl and heteroaryl ketones[J].Org Lett,2013,15: 4560-4563.
[8]Fernández I,Khiar N.Recent developments in the synthesis and utilization of chiral sulfoxides[J].Chem Rev,2003,103: 3651-3706.
[9]Masdeu-Bultó AM,Diéguez M,Martin E,et al.Chiral thioether ligands: Coordination chemistry and asymmetric catalysis[J].Coord Chem Rev,2003,242: 159-201.
[10]Zhang X Q,Li Y Y,Dong Z R,et al.Asymmetric transfer hydrogenation of aromatic ketones with chiral diamino-thiophene/iridium catalyst systems[J].J Mol Catal A: Chem,2009,307: 149-153.
[11]Tang L,Wang Q,Wang J,et al.A new chiral sulfinyl-NH-pyridine ligand for Ir-catalyzed asymmetric transfer hydrogenation reaction[J].Tetrahedron Lett,2012,53: 3839-3842.
[12]于会娟,赵营,韩西伦.新型四齿手性硫氮配体的合成及其在不对称催化还原苯乙酮中的应用[J].合成化学,2015,23(5) : 382-386.
[12]Sheldrick G M.SHELX-9[K].University of Göttingen,Germany,1997.
·研究论文·
作者简介:于会娟(1979-),女,汉族,山东济宁人,讲师,主要从事手性配体的设计合成和不对氢转移催化性能的研究。
基金项目:国家自然科学基金资助项目(21306026) ; 2014广东工业大学创新创业项目
*收稿日期:2014-12-01;
修订日期:2015-05-18
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.07.0569
文献标识码:A
中图分类号:O626; O643.36
