活体双光子成像观察小鼠脑血管CO2反应性及其机制☆
2015-02-01李明月吴腾腾张赛裴中陶玉倩
李明月吴腾腾张赛裴中陶玉倩
·论 著·
活体双光子成像观察小鼠脑血管CO2反应性及其机制☆
李明月*吴腾腾*张赛*裴中*陶玉倩*
目的活体观察脑血管CO2反应性及初步探讨其反应机制。方法利用双光子成像技术,在磨薄的颅窗下观察5只雄性C57小鼠脑皮层动脉、穿支动脉、皮层静脉及毛细血管共4种脑血管对吸入CO2的反应,分别使用一氧化氮合酶抑制剂L-NAME及前列腺素合成抑制剂吲哚美辛阻断血管扩张通路,观察血管反应性变化。结果吸入1 min 5%CO2后4种脑血管分别出现不同程度的扩张,其中穿支动脉扩张最显著(45.01%± 4.45%);使用L-NAME后4种脑血管对CO2反应性较使用前显著下降(P<0.05);使用吲哚美辛后动脉CO2反应性较使用前及使用L-NAME后显著下降(P<0.05),但毛细血管CO2反应性较使用前无下降(P>0.05)。结论4种脑血管在吸入CO2后出现不同程度的扩张反应,前列腺素类及NO参与介导反应。本实验方法有较好的应用价值。
脑血管反应性 CO2一氧化氮 前列腺素 双光子成像
脑血管反应性(cerebrovascualar reactivity, CVR)是指脑血管在各种因素影响下的舒缩能力,是反应脑血管功能变化的敏感指标。近年来发现散发性阿尔兹海默病、糖尿病、脑卒中、高血压等疾病早期就有CVR的改变[1-4],CVR已成为研究脑血管功能的重要检测指标之一。目前最常用的CVR刺激物是CO2,然而吸入CO2后血管反应能代表CVR的程度及反应的机制尚未明确,需进一步研究。常用的CVR测量方法有经颅多普勒、功能磁共振等皆通过测量脑血流量变化间接了解脑血管舒缩[5],而双光子活体成像技术可在活体内无创直接观察皮层脑血管的舒缩,在实时监测下使用不同药物干预,结合多次、短暂CO2吸入策略,可进一步研究反应的相关机制。
1 材料与方法
1.1 实验动物健康雄性6周龄体重22~24 g的C57/BL6J小鼠5只(广东省动物中心),普食喂养。
1.2 双光子显微镜活体成像下记录吸入CO2脑血管反应性采用乌拉坦(1 g/kg,Sigma)麻醉小鼠,将小鼠固定于立体定位仪上,消毒,剪开头皮,以前囟后1 mm,外侧3 mm为中心,使用高速颅骨钻(SAESHIN)磨薄直径约5 mm区域的颅骨,磨颅时小心避免损伤颅骨下脑组织,当光镜下能清晰看到颅骨下小血管时完成磨颅[6](图1)。
使用改性丙烯酸酯胶将专用固定板固定于小鼠头部颅窗上,通过尾静脉注射FITC荧光染料(150 mg/kg,Sigma)。将小鼠固定在双光子固定架上,安装小鼠恒温装置,使其体温维持在37℃。
1.3 双光子活体成像使用双光子显微镜(Leica,25*,标准细胞外盐水浸润物镜),选择FITC激发波长800 nm,可观察到颅窗下填充FITC荧光染料的血管。如有染料渗出于血管外或血管内血栓形成,提示脑血管损伤,应剔除。如图1所示安装小鼠呼吸面罩,打开流量计,气流量固定为2 L/min,吸入CO2混合气体(5%CO2+20%O2+75%N2,中山大学附属第一医院配气),录下吸入CO21 min影像。在吸CO2前后,分别扫描脑表面0到300 μm深的图像,每张图像间隔2 μm,叠加150张图像后用于检测脑血管直径变化,使用血管直径变化率%=(同根血管吸入CO2后直径/吸入CO2前直径-1)×100%公式计算,以此结果对比吸入前后血管扩张程度。
1.4 药物干预吸入CO2本实验使用NO合酶抑制剂L-NAME和前列腺素合成抑制剂吲哚美辛干预CVR。在测量小鼠正常CO2脑血管反应性后腹腔注射L-NAME(50 mg/kg,Sigma),半小时药物作用峰值时[7]重复上述过程吸入CO2测量脑血管直径前后变化。两小时L-NAME从体内完全清除后[8]尾静脉注射吲哚美辛(6 mg/kg,Sigma),半小时后吲哚美辛作用峰值时重复吸入CO2测量脑血管直径前后变化。
1.5 脑血管直径变化的测量双光子采集数据后可根据血管形态、分支情况、血流方向及直径区分皮层动脉、穿支动脉、皮层静脉、毛细血管,皮层动脉血流从主干流向分支,一般长而直,分支较少;穿支动脉从脑表面穿入脑实质,其周围毛细血管分布稀疏;皮层静脉血流从分支流向主干,有较多的分支,毛细血管为不直接与动脉、静脉相连的管径小于8 μm的血管[9]。使用Leica Las AF软件测量采集的数据,按照Sekiguchi,Y的方法[10]测量同一根同一部位脑血管吸入CO2前后直径变化,药物干预后重复测量以上指标。
1.6 统计学方法利用SPSS 19.0软件进行统计分析,每根血管重复测量,采用paired-t-test检验同根血管直径变化,及直径变化率,α=0.05。采用Graphpad Prism 5.0软件及Leica LAS AF软件进行图片及数据处理。
2 结果
2.1 未经药物干预时各血管吸入CO2反应小鼠处于乌拉坦麻醉稳定状态且体温维持在37℃,动静脉及毛细血管直径稳定此时各血管直径水平称为血管直径基线水平,吸入1 min CO2后脑血管直径能在停止吸入5 min内恢复基线水平。
此时小鼠吸入CO2后,皮层动脉和穿支动脉扩张显著,扩张原直径的40%左右,其中穿支动脉扩张最大(45.01%±4.45%),而静脉及毛细血管扩张相对较小(8.04%±2.10%;14.92%±2.53%)(详见图3、图4、表2)。
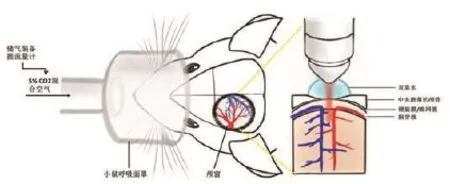
图1 小鼠CO2吸入装置及双光子观察示意图
2.2 药物干预对吸入二氧化碳前血管直径的影响小鼠处于乌拉坦麻醉稳定状态且体温维持在37℃,分别使用L-NAME和吲哚美辛后,血管直径水平与血管直径基线水平差异无统计学意义(P>0.05)(图2、表1)。
2.3 药物干预后各血管对吸入CO2的反应情况小鼠使用L-NAME后再吸入CO2各血管扩张明显减小且有统计学意义(P<0.05),而使用吲哚美辛后皮层动脉和穿支动脉扩张更小,且与使用L-NAME后吸入CO2反应下降程度相比有统计学意义(t=3.860,P<0.001;t=3.323,P<0.01)。使用吲哚美辛对比无药干预时小鼠毛细血管CO2反应性差异无统计学意义(P>0.05)(表2、图4)。
3 讨论
3.1 小鼠脑血管对吸入CO2后反应及其机制的初步探讨本研究使用双光子显像技术活体内直接观察到乌拉坦麻醉状态下小鼠脑皮层动脉、穿支动脉、皮层静脉、毛细血管在吸入1 min 5%CO2后有明显的扩张反应,其中吸入CO2后皮层动脉及穿支动脉扩张最显著,主要与平滑肌的舒张功能有关,穿支动脉是重要的毛细血管前阻力血管,其舒张能力对于脑血管储备有重要的意义;而静脉的扩张是相对被动的,受整体血流量影响;毛细血管扩张还与血管周细胞舒张有关[11]。为了更深入的了解吸入CO2检测CVR的机制,我们分别使用L-NAME和吲哚美辛干预,两种药物不改变吸入CO2前各血管的直径,提示NO和前列腺素类在维持静息状态血管直径方面并未起到关键作用,但分别使用两种药物后可不同程度的减弱各血管对CO2的扩张反应,尤其是吲哚美辛干预后脑动脉扩张程度明显下降,但毛细血管扩张下降不明显,提示前列腺素相关(PG)通路比NO通路在小鼠吸入CO2后脑动脉扩张反应中影响更大,而毛细血管在吸入CO2后的扩张反应不依赖前列腺素(PG)通路,但受NO通路影响。可见脑不同种血管舒张机制不同。NO和PG都是重要的血管舒张因子,其作用通路相互独立又有内在联系[12](图5),某一条通路障碍,血管对CO2的反应性可一定程度上被另一条通路所代偿,可能无法早期发现CVR异常。

图2 药物干预对吸入CO2前血管直径的影响注:a皮层动脉;p穿支动脉;v皮层静脉;c毛细血管
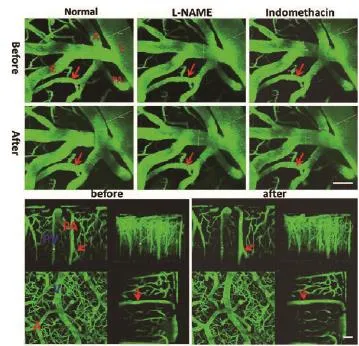
图3 双光子下无药物干预时(normal)及L-NAME、吲哚美辛干预后吸入CO2血管扩张情况注:a、c、e、g为吸入CO2前,b、d、f、h为吸入CO2后,a、b为无药物干预时c、d为使用L-NAME后,e、f为使用吲哚美辛后,g、h为无药物干预时血管扩张三维合成图,截取冠状位、矢状位及横切面图,图中红色箭头指示动脉,红色字母A皮层动脉;V皮层静脉;C毛细血管;PV穿支静脉;PA穿支动脉;标尺=40 μm

图4 无药物干预及L-NAME、吲哚美辛干预后吸入CO2各血管直径变化率注:a皮层动脉;p穿支动脉;v皮层静脉;c为毛细血管。*P<0.05,**P<0.01,***P<0.001
3.2 本实验方法学优劣分析
3.2.1 直接观察局部各脑血管扩张情况 本研究方法优势在于其能实时直接测量300 μm深度内各脑血管直径,且荧光损伤较小。目前大部分研究都是观察高碳酸血症后血流变化这一指标,间接反映脑血管扩张程度。血流变化与很多因素有关,如全身血压、颈动脉等大血管扩张程度等。像高血压、糖尿病、代谢综合征等全身血管病变下,使用脑血流量变化来反应CVR会较大程度上受到颅外大血管病变的影响,不能准确反应脑局部血管真实的血管扩张能力;而像脑血管淀粉样病变、脑炎症性病变及脑微小卒中等脑局部血管的病变通过测量血流量变化间接反应血管功能变化可使其检测敏感度大大降低。
3.2.2 无创活体观察 利用双光子能够无损的穿透一定厚度组织的特性,采用小鼠颅骨磨薄技术[13],仍保留一定厚度的颅骨作为支撑,维持了正常颅内压及内环境,能够较好的模拟体内环境,直接观察血管扩张变化。
3.2.3 自身吸入CO2的可重复性 目前大多CVR研究为观察到稳定的血流变化,需吸入CO25 min以上,而长时间吸入CO2可致机体酸中毒,影响正常反应。由于使用双光子成像可实时记录脑血管扩张变化,可采用1 min吸入CO2技术,避免机体酸中毒[14],且不影响下一次重复吸入。

图5 吸入CO2脑血管反应性可能机制

表1 药物干预对吸入CO2前血管直径的影响(μm)

表2 无药物干预及L-NAME、吲哚美辛干预后吸入CO2各血管直径变化率
3.2.4 本实验方法学的局限性 然而本实验方法也存在局限性,麻醉状态下的小鼠CO2反应受到麻醉剂的影响。C57小鼠在乌拉坦麻醉条件下,能保留基本的生理反射,是目前较适于检测脑血管反应性的麻醉剂之一。乌拉坦麻醉下,小鼠由于过度呼吸,处于轻度低碳酸血症状态,对吸入CO2反应敏感,而在预实验中我们使用4.2%水合氯醛(0.1 ml/10 g)麻醉,此麻药有轻度呼吸抑制作用,小鼠本身处于轻度高碳酸血症状态,吸入CO2后反应差。考虑到尽量减少小鼠创伤及实验条件有限等问题,我们没有检测小鼠呼气末CO2浓度或血气分析等指标,通过使小鼠处于相同的麻醉状态,控制温度、湿度等外界环境变量一致,采用相同的吸入气体的浓度及流量,可使小鼠在使用呼吸面罩自主呼吸时血管反应保持稳定,且最后统计结果显示不同小鼠脑血管扩张程度较一致。
综上所述,我们使用双光子显微镜活体无创直接观察小鼠脑血管CO2反应性,并使用药物干预观察反应性变化,从而探讨其内在机制,是对现代先进影像技术的应用探索。此实验对于临床应用方面,提示我们可在原有吸入CO2反应基础上添加药物干预,改善检测CVR方法,更好的分析和解释结果;对于实验研究方面,此方法可应用于多种疾病动物模型,如AD、糖尿病、中风等动物模型,动态观察脑血管功能变化发生在何时、由于何机制。CVR的研究可为脑疾病临床早期诊断、早期治疗及治疗效果的评估提供有价值的信息。
[1]Wirz KT,Keitel S,Swaab DF,et al.Early molecular changes in Alzheimer disease:can we catch the disease in its presymptom⁃atic phase?[J].J Alzheimers Dis,2014,38(4):719-740.
[2]Kim T,Richard Jennings J,Kim S.Regional cerebral blood flow and arterial blood volume and their reactivity to hypercapnia in hypertensive and normotensive rats[J].Journal of Cerebral Blood Flow&Metabolism,2013.
[3]Olah L,Franke C,Schwindt W,et al.CO2 Reactivity Measured by Perfusion MRI During Transient Focal Cerebral Ischemia in Rats Editorial Comment[J].Stroke,2000,31(9):2236-2244.
[4]Vuletic V,Drenjancevic I,Rahelic D,et al.Effect of indometha⁃cin on cerebrovascular reactivity in patients with type 2 diabe⁃tes mellitus[J].Diabetes Research and Clinical Practice,2013, 101(1):81-87.
[5]Fierstra J,Sobczyk O,Battisti-Charbonney A,et al.Measuring cerebrovascular reactivity:what stimulus to use?[J].The Journal of physiology,2013,591(Pt 23):5809-5821.
[6]Yang G,Pan F,Parkhurst C N,et al.Thinned-skull cranial win⁃dow technique for long-term imaging of the cortex in live mice [J].Nature Protocols,2010,5(2):201-208.
[7]Iadecola C,Pelligrino DA,Moskowitz MA,et al.Nitric oxide synthase inhibition and cerebrovascular regulation[J].J Cereb Blood Flow Metab,1994,14(2):175-192.
[8]Vitecek J,Lojek A,Valacchi G,et al.Arginine-based inhibitors of nitric oxide synthase:therapeutic potential and challenges[J]. Mediators Inflamm,2012,2012:318087.
[9]Dorr A,Sahota B,Chinta L V,et al.Amyloid-beta-dependent compromise of microvascular structure and function in a model of Alzheimer's disease[J].Brain,2012,135(Pt 10):3039-3050.
[10]Sekiguchi Y,Masamoto K,Takuwa H,et al.Measuring the vas⁃cular diameter of brain surface and parenchymal arteries in awake mouse[J].Adv Exp Med Biol,2013,789:419-425.
[11]Hall C N,Reynell C,Gesslein B,et al.Capillary pericytes regu⁃late cerebral blood flow in health and disease[J].Nature,2014.
[12]Heinert G,Nye PC,Paterson DJ.Nitric oxide and prostaglandin pathways interact in the regulation of hypercapnic cerebral vaso⁃dilatation[J].Acta Physiol Scand,1999,166(3):183-193.
[13]Drew PJ,Shih AY,Driscoll JD,et al.Chronic optical access through a polished and reinforced thinned skull[J].Nat Methods, 2010,7(12):981-984.
[14]Silva J,Polesskaya O,Knight W,et al.Transient hypercapnia reveals an underlying cerebrovascular pathology in a murine modelfor HIV-1 associated neuroinflammation:role of NO-cGMP signaling and normalization by inhibition of cyclic nucleotide phosphodiesterase-5[J].J Neuroinflammation,2012, 9:253.
A study of in vivo two-photon imaging of cerebravascular CO2reactivity in mice
.LI Mingyue,WU Tengteng,ZHANG Sai,PEI Zhong,TAO Yuqian.The Department of Neurology,the First Affiliated Hospital of Sun Yat-sen Universi⁃ty,58 Zhongshan II Rd,Guangzhou 510080,China.Tel:020-87755766-8291.
ObjectiveTo examine cerebrovascular reactivity to CO2inhalation in mice.MethodsIn vivo Two-Pho⁃ton imaging technique was used to record the reaction of cerebral cortical vessels including penetrating artery,surface vein and capillary in 5 male C57 mice after CO2inhalation under a thinned-skull cranial window.Nitric oxide syntheses inhibitor L-NAME and Prostaglandin syntheses inhibitor Indomethacin were used to block different vasodilator pathways, respectively.ResultsDifferent mouse cortical vessels displayed different degrees of dilation to 1-minute 5%CO2inhala⁃tion.The penetrating artery exhibited the most obvious dilation(45.01%±4.45%).L-NAME intervention significantly di⁃minished cerebravascular CO2reactivity(P<0.05).Indomethacin significantly attenuated the dilation of artery but not capillary comparing with L-NAME intervention(P<0.05).ConclusionsDifferent vessels react differently to CO2inhala⁃tion in which postaglandins and NO signal pathways are involved.
Cerebravascular reactivity CO2Nitric oxide Prostaglandins Two-photon imaging
R743.33
A
2014-12-03)
(责任编辑:李立)
10.3936/j.issn.1002-0152.2015.05.002
☆ 广东省科技计划(编号:2012B031800106)
* 中山大学附属第一医院神经科(广州510080)
E-mail:yuqiantao63@163.com)
