S100A12在重症急性胰腺炎治疗中的潜在作用
2015-01-29张峰詹银楚姜仁鸦方剑姜继华
张峰,詹银楚,姜仁鸦,方剑,姜继华
急性胰腺炎是胰腺最常见的病变,其发病率可达到百分之八,并呈逐年上升的趋势[1]。轻型急性胰腺炎是一种自限性疾病,预后较好,但有约25%的患者表现为重症急性胰腺炎,病死率高达10%~30%[2-3]。
近年来研究发现S100A12在许多疾病中,如心血管疾病[4-5]、炎症性肠病[6]、急慢性肺部疾病[7]、阿尔茨海默病[8]、肾小球肾炎[9]、II型糖尿病[10]、风湿性疾病[11]、川崎病[12]等中均发现S100A12呈特异性高表达状态,并在炎症调节中发挥着重要作用。现已有多项研究证明,S100A12不是管家蛋白,而是在不同细胞种类、细胞周期及状态下选择性表达的,与炎症反应有着十分紧密的联系。
S100A12是S100蛋白家族中的成员之一[13]。S100A12基因定位于人类染色体1q21,介于S100A8和S100A9之间,其编码的钙结合蛋白S100A12以共价二聚体的形式存在。目前研究发现S100A12拥有两个Ca2+结合位点—C端和N端。这两个位点也是S100A12区别于其他S100家族成员的重要依据[14]。当S100A12在与Ca2+结合或受到其他炎症介质刺激而导致蛋白构象发生变化时,目标蛋白结合位点就会暴露,S100A12再通过结合相应的配体,从而发挥其功能。因此,通过阻断S100A12与其相应的配体的结合,如使用S100A12重组抗体抑制S100A12功能,可能会为重症急性胰腺炎的治疗提供一种新的策略。本研究通过建立小鼠重症急性胰腺炎模型,观察、探讨S100A12在小鼠重症急性胰腺炎治疗中的潜在作用。
1 材料和方法
1.1 实验动物
无特定病原体(specific pathogen free,SPF)级雌性ICR小鼠160只,体重(21.26±0.93)g,由浙江中医药大学动物实验中心提供。在适宜温度、湿度和光照条件下于动物实验中心常规饲养一周,实验前禁食12 h,自由饮水。
1.2 主要试剂
雨蛙素(Caerulein,Cn)、脂多糖(lipopolysaccharide,LPS)购于Sigma公司,小鼠S100A12重组抗体购于Sino生物科技公司,小鼠S100A12酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)试剂盒购于Elabscience生物科技有限公司,小鼠AMY ELISA试剂盒购于Cusabio生物科技有限公司,小鼠CRP、IL-1β、IL-6、TNF-α ELISA试剂盒均购于上海西唐生物科技有限公司。
1.3 主要仪器
脱水机(STP120,MICROM公司)、包埋机(AP280-2,MICROM公司)、切片机(HM335E,MICROM公司)、显微镜(Nikon eclipse 80i,Nikon公司)、电荷耦合元件(Charge-coupled Device,CCD)(DS-Fi1,500万象素,Nikon公司)、图像分析软件(Carl Zeiss Imaging Systems,Carl Zeiss公司)、低速自动平衡离心机(LDZ5-2,北京医用离心机厂)由浙江中医药大学动物实验中心提供;孵育箱(宁波海曙赛福实验仪器厂)、酶标仪(WellscanMK-3,Labsystems Dragon公司)等由浙江中医药大学生命科学学院实验室提供。
1.4 模型建立
将160只SPF级雌性ICR小鼠用完全随机方法分成对照组[A组,体重(21.17±1.02)g]、轻型组[B组,(21.28±0.92)g]、重症组[C组,(21.22±0.91)g]和干预组[D组,(21.37±0.91)g],每组40只。小鼠在建模开始前12 h禁食,但不禁水。雨蛙素、脂多糖在开始建模前临时配制[15-16],其中A组小鼠的生理盐水按照25 mg/kg经腹腔注射,连续7次,每次间隔1 h;B组小鼠的雨蛙素按照50μg/kg经腹腔注射,连续7次,每次间隔1 h;C组小鼠的雨蛙素按照50μg/kg经腹腔注射,连续7次,每次间隔1 h,脂多糖按照10 mg/kg在首次雨蛙素注射5 h后经腹腔注射;D组则在首次雨蛙素注射前30 min按照50μg/kg注射S100A12重组抗体,余同C组。
1.5 采血化验
首次雨蛙素注射后8 h、12 h和24 h采血,采用眼眶取血法,接取适量置于2 mL EP管中,不抗凝,待血液凝集后,离心机3000 r/min离心5 min,收集上层血清,-20 ℃冰箱保存,待测各项指标。
1.6 取材观察
高浓度戊巴比妥钠腹腔注射麻醉致死,剖腹,取出小鼠胰腺组织,10%甲醛溶液中固定,常规石蜡包埋、切片,苏木素和伊红(HE)染色,光镜观察。胰腺病理学变化采用双盲法按照Schmidt标准[17]对其进行病理学评分,评分标准见表1。

表1 胰腺病理学评分
1.7 统计学分析
用SPSS 17.0软件进行统计处理。两样本均数比较用t检验,数据用(±s)表示;多个实验组与一个对照组间两两比较采用LSD检验、Dunnett检验,多个样本均数间两两比较采用SNK法;分值等级差异用Ridit分析。P<0.05认为差异有统计学意义。
2 结果
2.1 小鼠生存率
A组、B组、D组无小鼠死亡,生存率均为100%;C组中有1只小鼠在实验开始后约30 h死亡,生存率97.5%。
2.2 血清指标测定
与A组相比,各时段B组和C组血清AMY、CRP、IL-1β、IL-6、TNF-α、S100A12(P<0.05,P<0.01),说明建立模型成功;与B组相比,各时段D组血清S100A12浓度降低(P<0.05),而与C组相比,各时段D组血清中AMY、CRP、IL-1β、IL-6、TNF-α含量均明显降低(P<0.05),S100A12浓度显著降低(P<0.01),说明S100A12可能在监测小鼠重症急性胰腺炎发生、发展以及治疗中起重要作用,见表2。
表2 不同时间点各组血清指标变化情况(±s)

表2 不同时间点各组血清指标变化情况(±s)
与A组比,*P<0.05,**P<0.01;与B组比,#P<0.05;与C组比,△P<0.05,△△P<0.01
C组A组B组D组组别AMY(U/L)8h 12h 24h CRP(mg/L)8h 12h 24h IL-1β(pg/mL)8h 12h 24h IL-6(pg/mL)8h 12h 24h TNF-α(pg/mL)8h 12h 24h S100A12(pg/mL)8h 12h 24h 1161.2±364.01173.1±360.51160.9±342.93156.1±410.6*3592.7±489.1*2952.9±423.8*7353.2±485.1**8148.2±437.9**7119.2±470.8**2352.3±466.6△2724.1±420.8△2144.2±449.7△10.245±0.61410.183±0.66110.180±0.64915.820±0.680*17.862±0.761*13.926±0.759*21.440±0.865*25.261±0.982*19.285±0.969*14.594±0.710△13.648±0.712△12.680±0.716△10.611±1.89210.463±1.83610.516±1.821160.335±3.986**180.178±4.252**150.378±3.487**240.217±2.627*280.681±3.120*231.417±3.281*140.304±2.372△148.579±2.421△138.550±2.399△4.569±0.9974.581±1.0024.598±1.0049.491±1.236*21.707±1.313**16.747±1.432**50.863±1.351**59.914±1.146**55.367±1.240**41.869±1.428△36.775±1.456△31.499±1.377△66.764±4.45168.762±9.36866.353±8.539311.059±6.392**473.223±11.223**331.145±13.735**633.543±7.259**721.063±10.128**654.392±14.289**319.940±6.651△426.614±11.159△345.039±14.652△35.132±6.80034.966±6.49434.966±6.451343.714±7.610**591.451±20.609**464.947±19.527**1413.080±9.069**2393.831±33.564**1778.152±39.919**221.720±7.197**#△△166.902±11.298*#△△137.462±15.098*#△△
2.3 胰腺组织肉眼及光镜观察
肉眼见A组胰腺和胰外器官均基本正常;B组胰腺与周围组织粘连,腺体肿胀,胞膜紧张,色泽苍白,胰外器官无明显异常变化;C组胰腺与周围组织粘连严重,腺体肿胀,色泽灰暗,表面可见多处皂化斑点和出血点,大网膜、肠系膜等处出现少量皂化斑,肝脏色泽较暗,略显肿胀;D组胰腺无明显外观异常,与周围组织稍有粘连,胰外器官无明显异常变化。光镜下观察A组胰腺间质正常,小叶结构完整,无出血、坏死改变(图1A);B组胰腺间质充血水肿,有炎性细胞浸润,可见少量局灶性腺泡坏死,轻微脂肪坏死,偶见出血(图1B);C组胰腺组织严重水肿,腺泡细胞分布相对独立,犹如孤岛,腺体细胞大量坏死,结构模糊,局部呈融合性坏死,坏死区域有大量炎性细胞浸润(图1C);D组胰腺轻微水肿,无空泡形成,有轻微脂肪细胞坏死,少见出血(图1D)。
2.4 各组胰腺组织病理评分
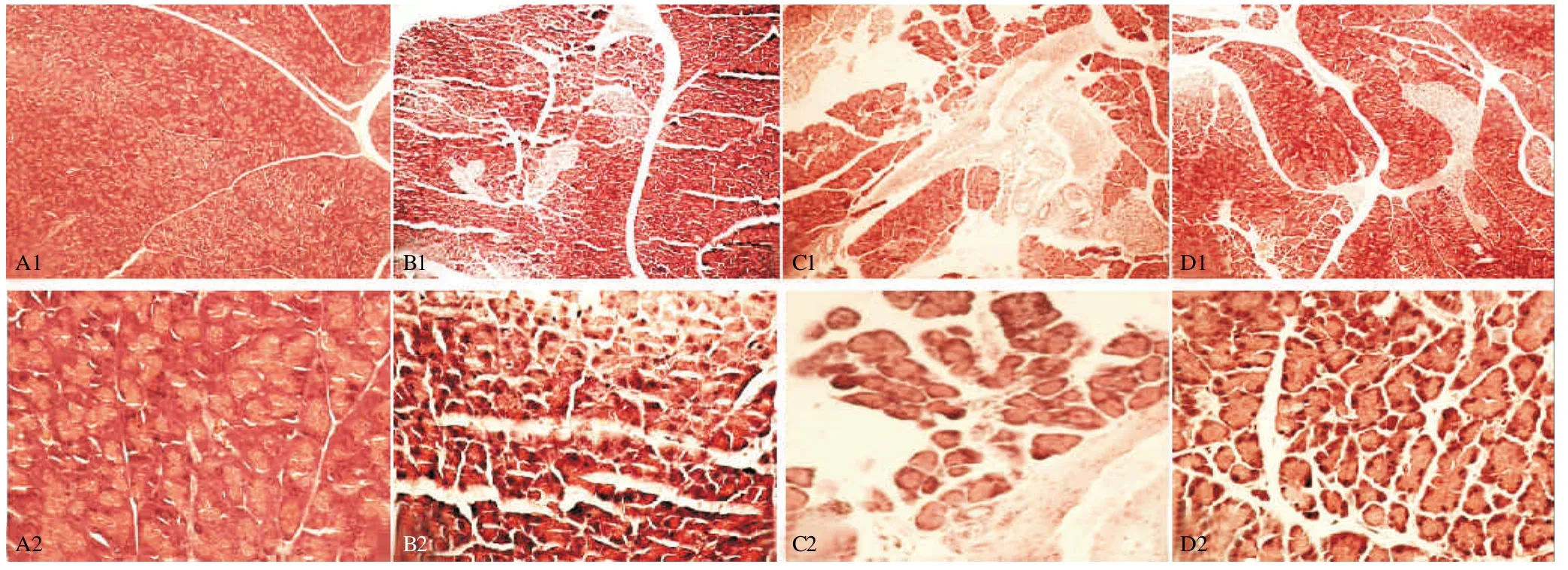
图1 光镜下各组胰腺的病理变化,HE染色(图A1、B1、C1、D1,×100;图A2、B2、C2、D2,×400)
病理评分结果显示:同A组相比,B组胰腺出现显著的间质水肿(P<0.01)和轻中度的炎症浸润(P<0.05),但没有出现明显实质坏死和出血(P>0.05),C组胰腺出现严重的间质水肿、炎症浸润和实质坏死,并出现不同程度的出血(P<0.01),D组胰腺出现轻中度的间质水肿和炎症浸润(P<0.05),但没有出现明显实质坏死和出血(P>0.05);同B组相比,C组胰腺的炎性浸润、实质坏死和出血要严重的多(P<0.01),但D组胰腺的炎性浸润情况相较于B组要有所好转(P<0.05);同C组相比,D组胰腺的炎性浸润、实质坏死及实质出血情况均要明显好转(P<0.01),见表3。
3 讨论
重症急性胰腺炎患者住院时间延长,治疗费用巨大,给人类健康和社会经济构成巨大威胁。而目前用来判断急性胰腺炎严重程度和预后的指标有Ranson评分、Glasgow评分、APACHEII评分、胰酶、胰蛋白酶原激活肽(TAP)等[18],但这些评估方法对重症胰腺炎早期诊断的敏感性、特异性均达不到临床要求,而且还存在检测复杂、费用高昂等局限性。有学者曾用垂盆草提取物来治疗重症急性胰腺炎及其引起的急性肺损伤取得良好效果,并通过病理发现治疗后的动物胰腺组织中腺泡细胞肿胀情况和腺泡细胞间炎症细胞浸润均明显减轻[19],但目前对垂盆草提取物的具体成分,特别是有效成分尚未完全弄清。因此,寻找新的、和急性胰腺炎严重密切相关并能够在临床推广应用的炎性因子并加以调控或许能使急性胰腺炎的治疗产生突破性进展。
通过实验我们发现:轻型胰腺炎组的小鼠血清S100A12浓度就已经开始升高,重症急性胰腺炎小鼠的血清S100A12浓度更是明显升高,通过干预抑制S100A12功能,小鼠胰腺的炎症浸润、实质坏死及实质出血情况相较于重症胰腺炎组的小鼠均要明显好转,甚至相比于轻型胰腺炎组,干预组中小鼠胰腺的炎性浸润情况也有所好转。
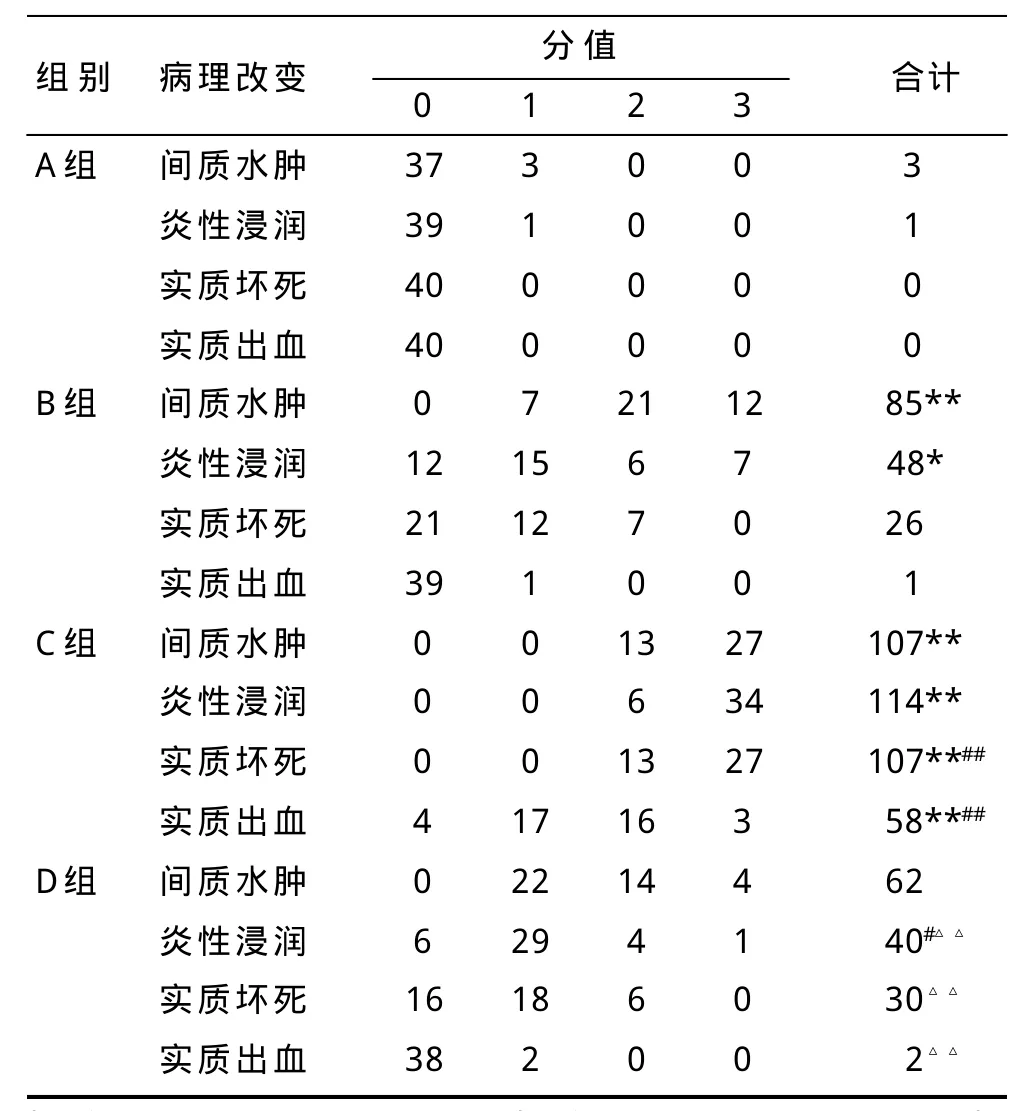
表3 各组胰腺组织病理评分结果
S100A12主要表达于中性粒细胞,除在血浆中,在脑脊液、唾液、滑膜液甚至是胃肠黏膜及粪便等中亦可发现。近来研究表明,S100A12在炎症调节中起关键作用,Rouleau等所做动物实验证实:通过对小鼠静脉注射S100A12,发现骨髓粒细胞向外周血迁移,进而激活粒细胞并使之向炎症区域趋化[20]。在急性胰腺炎的早期,中性粒细胞即被激活,释放大量的细胞因子和炎性介质,是重症急性胰腺炎引起全身炎症反应的中心环节[21]。
通过不同时段对各组中各项指标的结果分析:由雨蛙素和脂多糖建立的重症急性胰腺炎小鼠模型,其血清AMY、CRP、IL-1β、IL-6和TNF-α水平相对于对照组都明显升高,S100A12作为一种炎症应答的标记物,其血清浓度也明显上升,而通过事先注射S100A12重组抗体将会使这些炎症因子水平明显降低(见表2)。组织病理学观察也证实了重症急性胰腺炎的这种变化:胰腺损伤如间质水肿,炎症浸润,实质坏死和出血都明显加强,而通过注射S100A12重组抗体后,这些损伤变化又将会得到减轻(图1,表3)。因此,我们认为S100A12能够作为重症急性胰腺炎治疗的一个有效靶点,通过抑制S100A12的表达,进而控制重症急性胰腺炎时中性粒细胞的过度激活, 就可以通过减少炎性介质的产生和释放来减弱急性胰腺炎的炎症反应,从而为治疗重症急性胰腺炎提供了一个新的策略。
[1] Sekimoto M, Takada T, Kawarada Y, et al. JPN Guidelines for the management of acute pancreatitis: epidemiology, etiology,natural history, and outcome predictors in acute pancreatitis[J]. J Hepatobiliary Pancreat Surg, 2006, 13(1): 10-24.
[2] Granger J, Remick D. Acute pancreatitis: models, markers, and mediators [J]. Shock, 2005, 24 Suppl 1: 45-51.
[3] Mayerle J, Hlouschek V, Lerch MM. Current management of acute pancreatitis [J]. Nat Clin Pract Gastroenterol Hepatol,2005, 2(10): 473-483.
[4] Scheiber-Camoretti R, Mehrotra A, Yan L, et al. Elevated S100A12 and sRAGE are associated with increased length of hospitalization after non-urgent coronary artery bypass grafting surgery [J]. Am J Cardiovasc Dis, 2013, 3(2): 85-90.
[5] Shiotsu Y, Mori Y, Nishimura M, et al. Prognostic utility of plasma S100A12 levels to establish a novel scoring system for predicting mortality in maintenance hemodialysis patients: a two-year prospective observational study in Japan [J]. BMC Nephrol, 2013, 14: 16.
[6] Manolakis AC, Kapsoritakis AN, Georgoulias P, et al. Moderate performance of serum S100A12, in distinguishing inflammatory bowel disease from irritable bowel syndrome [J]. BMC Gastroenterology, 2010, 10: 118.
[7] Lorenz E, Muhlebach MS, Tessier PA, et al. Different expression ratio of S100A8/A9 and S100A12 in acute and chronic lung diseases [J]. Respir Med, 2008, 102(4): 567-573.
[8] Shepherd CE, Goyette J, Utter V, et al. Inflammatory S100A9 and S100A12 proteins in Alzheimer's disease [J]. Neurobiology Aging, 2006, 27(11): 1554-1563.
[9] Komatsuda A, Ohtani H, Wakui H, et al. Increased serum levels of S100A12 in patients with MPO-ANCA-associated glomerulonephritis [J]. Clin Nephrol, 2006, 66(5): 315-321.
[10]Kosaki A, Hasegawa T, Kimura T, et al. Increased plasma S100A12 (EN-RAGE) levels in patients with type 2 diabetes[J]. J Clin Endocrinol Metab, 2004, 89(11): 5423-5428.
[11]Foell D, Wittkowski H, Hammerschmidt I, et al. Monitoring neutrophil activation in juvenile rheumatoid arthritis by S100A12 serum concentrations [J]. Arthritis Rheumatism, 2004, 50(4):1286-1295.
[12]Ye F, Foell D, Hirono K, et al. Neutrophil-derived S100A12 is profoundly upregulated in the early stage of acute Kawasaki disease [J]. Am J Cardiology, 2004, 94(6): 840-844.
[13]Guignard F, Mauel J, Markert M. Identification and characterization of a novel human neutrophil protein related to the S100 family [J]. Biochem J, 1995, 309 (Pt 2): 395-401.
[14]Pietzsch J, Hoppmann S. Human S100A12: a novel key player in inflammation? [J]. Amino Acids, 2009, 36(3): 381-389.
[15]Vaccaro MI, Calvo EL, Suburo AM, et al. Lipopolysaccharide directly affects pancreatic acinar cells: implications on acute pancreatitis pathophysiology [J]. Dig Dis Sci, 2000, 45(5):915-926.
[16]Su KH, Cuthbertson C, Christophi C. Review of experimental animal models of acute pancreatitis [J]. HPB (Oxford), 2006, 8(4): 264-286.
[17]Schmidt J, Lewandrowski K, Fernandez-del Castillo C, et al.Histopathologic correlates of serum amylase activity in acute experimental pancreatitis [J]. Dig Dis Sci, 1992, 37(9): 1426-1433.
[18] Rosty C1, Christa L, Kuzdzal S, et al. Identification of Hepatocarcinoma-Intestine-Pancreas/Pancreatitis-associated Protein I as a Biomarker for Pancreatic Ductal Adenocarcinoma by Protein Biochip Technology [J]. Cancer Res, 2002, 62:1868-1875.
[19] 刘乐伟, 徐志红, 汪茂鸣, 等. 垂盆草对重症急性胰腺炎肺损伤大鼠的作用及其相关机制研究 [J]. 肝胆胰外科杂志, 2014,26(2): 121-125.
[20]Rouleau P, Vandal K, Ryckman C, et al. The calcium-binding protein S100A12 induces neutrophil adhesion, migration, and release from bone marrow in mouse at concentrations similar to those found in human inflammatory arthritis [J]. Clinl Immunol,2003, 107(1): 46-54.
[21] Steer M. Pancreatitis severity: Who calls the shots? [J]. Gastroenterology, 2002, 122(4): 1168-1172.
