超声靶向微泡破裂技术联合shRNA质粒沉默Toll样受体4基因
2015-01-23郑翾梁燕玲陈佳陈智毅李斯颖罗建华方小波
郑翾,梁燕玲,陈佳,陈智毅,李斯颖,罗建华,方小波
Toll样受体(Toll-like receptor,TLR)负责启动胞内一系列细胞因子的转录反应,引起促炎症因子的生成和释放,促使免疫炎症反应的发生,以清除病原微生物;其中TLR4是该家族中有代表性的一员,能特征性地识别革兰阴性菌壁中的脂多糖(lipopolysaccharides,LPS)(外源性配体)及识别机体的各种危险信号(内源性配体)从而导致机体产生炎症和免疫反应。既往的研究证明TLR4通路参与了脑缺血后的神经损伤机制[1-2]。而本课题组前期的研究发现TLR4与高血糖合并脑缺血后的痫性发作相关[3],而TLR4拮抗剂可明显减少急性癫痫模型的痫性发作频率、缩短发作持续时间,推迟首次发作的发生[4]。因此,如果能找出一种安全低价高效的方法抑制TLR4的表达,则有可能减轻患者脑缺血后的神经损伤,也有可能降低高血糖合并脑缺血后的痫性发作。
核糖核酸干扰(RNA interference,RNAi)是指在进化过程中高度保守的、由双链核糖核酸(double-stranded RNA,dsRNA)诱发的、同源mRNA高效特异性降解的现象[5]。其高度的特异性及抑制性能有效降解目的基因的信使RNA(messenger deoxyribonucleic acid,mRNA),该技术已被广泛用于探索基因功能和传染性疾病及恶性肿瘤的治疗领域。在该技术中,短发夹RNA(short hairpin RNA,shRNA)有着良好的抑制效果及持续时间。传统的基因载体使用的病毒载体因其免疫原性及对操作者的潜在危害限制了它的临床应用,而超声靶向微泡破裂(ultrasound-targeted microbubble destruction,UTMD)具有安全性、靶向性、促药物渗透或转移的特点[6],可携带基因或药物到达靶组织,成为近年来药物载体的研究热点。本实验观察UTMD联合shRNA的方法沉默脑中TLR4的可行性,促进对非侵袭性的基因传输的了解。
1 材料与方法
1.1 主要试剂和仪器 根据文献[5],选择TLR4-439起始点为靶序列(靶序列如下:TTAAGAAGCTATAGCTTCACC。设计shDNA模板序列为5’-CACCGTTAAGCTATAGCTTCACCTTCAAGAGAGGT GAAGCTATAGCTTCTTAATTTTTTG-3’,3’-CAATTC TTCGATATCGAAGTGGAAGGTTCTCTCCACTTCGATATC GAAGAATTAAAAAACCTAG-5’。转录产物为GTTAAG AAGCTATAGCTTCACCTTCAAGAGAGGTGAAGCTATAGC TTCTTAATT。由上海吉玛制药技术有限公司合成并插入到pGPU6/Neo中,生成pGPU6/Neo-Tlr4-Rat-439质粒。SonoVue微泡为Bracco公司产品;超声仪经颅多普勒超声(以色列RIMED公司),超声探头直径1.5 cm,超声频率2 MHz。Bio-Rad电泳仪(Bio-Rad公司),Mini PROTEAN Tetra System电泳仪(Bio-Rad公司),Multimade Plate Reader酶标仪(Enspire-PerkinElmer公司),G-Box凝胶成像系统(G-Box公司)。
1.2 SonoVue/DNA复合物制备 使用0.9%生理盐水溶液配制SonoVue微泡悬液,通过倒置或振荡使微泡均匀分布,微泡密度为2×108~5×108/ml,浓度5 mg/ml。实验前将100 μl SonoVue与100 μl质粒DNA溶液(含5 ng质粒)混匀,4℃保存备用。
1.3 实验分组及处理方法 Wistar大鼠(雄性,250~300 g,6~8周)购自南方医科大学实验动物研究中心,严格按照实验动物管理条例饲养于SPF级环境。实验动物分4组,每组8只共32只:空白对照组(NS),在正常大鼠侧脑室内注入40 μl生理盐水;裸质粒组(P),在正常大鼠侧脑室内注入40 μl质粒溶液(含20 μl质粒);质粒联合超声辐照组(P+S+UTMD),在正常大鼠侧脑室内注入40 μl质粒溶液后予以超声辐照;质粒与SonoVue联合超声辐照组(P+UTMD),在正常大鼠侧脑室内注入SonoVue/DNA后予以超声辐照。大鼠予10%水合氯醛腹腔注射麻醉,于立体定位仪上行双侧侧脑室注射,每侧各注射20 μl,注射后留针5 min,拔针后以无漏液视为注射成功,缝皮后超声探头涂布耦合凝胶,对大鼠头部进行超声辐照,超声探头直径1.5 cm,超声频率2 MHz,深度38 mm,脉冲超声,辐照部位为前囟沿着中骨缝向后0.8 mm,照射5 min[7]。术后4 d内Berderson评分为0分者视为手术成功(Berderson评分标准:0分:未见行为缺陷;1分:前肢屈曲即提尾悬空实验阳性;2分:侧推抵抗力下降即侧向推力实验阳性,伴前肢屈曲,无转圈行为;3分:同2分行为,伴自发性旋转)。4 d后杀鼠取脑,观察大鼠大脑有无出血点并提取注射部位处大脑蛋白行Western Blot观察TLR4抑制情况,运用Quantity One凝胶定量分析软件(Bio-Rad公司)分析灰度值,将样品与内参灰度值之比进行统计学分析。
1.4 Western Blot 使用Western Blot配胶试剂盒(碧云天产品),按说明书配制12%的电泳胶并将其放入电泳槽中并加入电泳液至水位线。Marker使用10~170 kDa范围蛋白Marker(500 μl,Tanon公司产品,CatNo:180-6001)取样品蛋白并用RIPA裂解液(Radio Immunoprecipitation AssayLysis Buffer)将其浓度调至20 μg/μl,按每孔10 μl体积加入电泳胶加样孔中,合上电极并用80 V恒定电压跑胶至浓缩胶与分离胶分界线时将电压调至100 V恒定电压后继续跑胶90 min。电泳完毕后取出电泳胶,将泡过10 s甲醇的聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜覆盖其上,将其放入电转系统中,采用湿性电转法,以250 mA恒定电流转移90 min。电转完毕后取出PVDF膜,以5%脱脂奶粉溶液浸泡并放置在水平摇床上封闭1 h后用磷酸盐缓冲液(phosphate buffered saline,PBS)洗净,将PVDF膜浸泡于含有1∶2500稀释的小鼠抗大鼠TLR4多克隆抗体(abcom公司,ab8376)的培养皿中并放置于4℃冰箱中摇动封闭过夜。过夜后将膜取出,以PBS洗膜3次,每次10 min,将膜取出后在盛有1∶5000稀释的山羊抗大鼠二抗(EarthOx公司,E030110-01)的平皿中在室温下脱色摇床上摇动孵育1 h后以PBS洗膜3次,每次10 min。PBS洗净后用ECL发光液(上海伟进生物科技有限公司)于G-Box凝胶成像系统中成像,图像运用Quantity One凝胶定量分析软件(Bio-Rad公司)分析灰度值,将样品与内参灰度值之比进行统计学分析。
1.5 免疫组化染色 每组各取3只大鼠用于免疫组化染色,术后4 d杀鼠取脑,观察大鼠大脑有无出血点并提取注射部位处大脑,取出后行OCT包埋并作冷冻切片,以13 μm厚度连续切片,每5张取1张贴片后37℃烘片过夜,烘片后3%H2O2室温孵育20 min,PBS漂洗3次每次3 min,滴加3%牛血清白蛋白(albumin from bovine serum,BSA)封闭30 min后滴加经1∶100稀释的小鼠抗大鼠TLR4多克隆抗体(abcom公司,ab8376)4℃过夜,PBS洗片3次,每次5 min,后滴加山羊抗兔鼠通用二抗(DAKO公司,二抗稀释比1∶500)室温孵育50 min。PBS漂洗3次,每次5 min,二氨基联苯胺(3,3’-diaminobenzidine,DAB)显色,显微镜下观察出现棕黄色颗粒时停止显色,蒸馏水冲洗后苏木精复染细胞核,乙醇梯度脱水,二甲苯透明,中性树胶封片,对切片编号以实现盲法观察,重点观察取样部位海马CA1区锥体细胞的细胞膜及细胞质阳性染色深度。运用Image Pro Plus软件(Media Cybernetic公司)对免疫组织化学图片进行平均光度值分析。常规进行HE染色和摄片。
1.6 统计分析 应用SPSS 19.0统计软件进行分析,计量资料符合正态分布采用(s)表示。多组间比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05差异具有显著性。
2 结果
实验中所有大鼠术后4 d内均未出现任何神经功能障碍,4组大鼠Berderson评分均为0分,且无任何大鼠死亡。
2.1 TLR4的蛋白表达情况 4组大鼠TLR抑制后的Western Blot的图像采用Quantity One凝胶定量分析软件(Bio-Rad公司)分析灰度值,发现质粒联合超声辐照组和质粒与SonoVue联合超声辐照组抑制效果明显(P+S+UTMD:0.223±0.009,P+UTMD:0.277±0.013,t1,3=4.900,P<0.01;t1,4=8.779,P<0.01),裸质粒组与空白对照组无明显差异(NS:0.351±0.030,P:0.339±0.034,t1,2=0.590;P>0.05),而质粒与SonoVue联合超声辐照组与质粒联合超声辐照组相比抑制效果更好(P+S+UTMD:0.223±0.009,P+UTMD:0.277±0.013,t3,4=7.006,P<0.05)(图1)。
2.2 TLR4抑制后的免疫组化结果 在海马CA1区,TLR4蛋白的阳性染色为棕黄色颗粒,主要表达在海马锥形细胞的细胞膜和细胞质(空白对照组TLR4阳性细胞数157.74±2.287;裸质粒组TLR4阳性细胞数147.50±6.461;质粒联合超声辐照组TLR4阳性细胞数81.50±5.041;质粒与SonoVue联合超声辐照组TLR4阳性细胞数67.75±2.016,每组n=3),平均光度值分析显示,质粒联合超声辐照组和质粒与SonoVue联合超声辐照组抑制效果明显(P+S+UTMD:0.026±0.0013,P+UTMD:0.058±0.0014,t1,3=8.334,P<0.01;t1,4=21.027,P<0.01),裸质粒组与空白对照组无明显差异(NS:0.079±0.0048,P:0.077±0.0012,t1,2=0.797;P>0.05),而质粒与SonoVue联合超声辐照组和质粒联合超声辐照组相比抑制效果更好(P+S+UTMD:0.026±0.0013,P+UTMD:0.058±0.0014,t3,4=33.254,P<0.05)(图2)。
3 结论
TLR4除特征性识别革兰阴性菌壁中的LPS外,还能识别机体的各种危险信号(内源性配体),主要的内源性配体是高迁移率族蛋白1(high mobility group box-1 protein,HMGB1)。Hyakkoku等[3]将敲除TLR3,TLR4,TLR9相关基因的3种小鼠短暂大脑中动脉缺血2 h,结果发现只有TLR4基因敲除小鼠的梗死面积缩小且神经功能损伤较小,而其他基因敲除小鼠均无上述表现。Moraga等[8]在敲除TLR4的小鼠大脑中动脉缺血后的第7天发现室管膜下区的神经干细胞数量少于野生型小鼠,但第14天时,神经干细胞数目多于野生型小鼠,可见抑制TLR4能促使神经干细胞数目增多。如果能抑制TLR4表达,将有助于改善脑梗死预后,本课题组曾采用超声介导载药微泡的方法成功促进急性脑梗死后的神经再生和血管新生[9],因此希望能通过超声介导微泡造影剂携带shRNA质粒可以更好地抑制TLR4表达,进一步为体内采用该法进行基因治疗打下基础。

图1 4组大鼠TRL抑制蛋白表达情况注:超声探头直径1.5 cm,超声频率2 MHz,深度38 mm,脉冲超声,辐照部位为前囟沿着中骨缝向后0.8 mm,照射5 min。图中可见质粒联合微泡超声辐照组TLR4蛋白表达明显比其他3组要少。而空白对照组和裸质粒组区别不大。TLR4:Toll样受体4,GAPDH:甘油醛-3-磷酸脱氧酶(内对照)
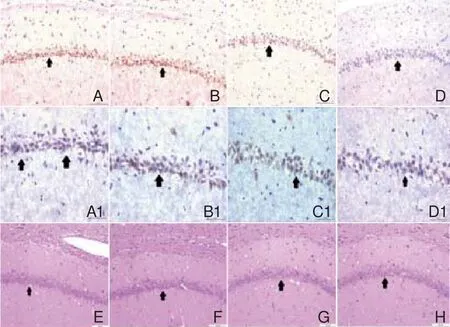
图2 大鼠大脑TLR4蛋白表达免疫组化图注:观察部位为海马CA1区。其中A、B、C、D分别为空白对照组、裸质粒组、质粒联合超声辐照组、质粒与SonoVue联合超声辐照组(x200)。A1、B1、C1、D1分别为空白对照组、裸质粒组、质粒联合超声辐照组、质粒与SonoVue联合超声辐照组(x400),E、F、G、H分别为空白对照组、裸质粒组、质粒联合超声辐照组、质粒与SonoVue联合超声福照组的海马CA1区的HE染色(x200)。图中箭头所指为海马CA1区细胞;HE:苏木精-伊红;TLR4:Toll样受体4
脑缺血可以选择性地损伤海马CA1区神经元,而其他亚区的神经元则不受损伤[10-11],因此,本实验重点观察CA1区的TLR4的抑制情况,结果显示,相较于对照组和裸质粒组,质粒联合超声辐照组和质粒与SonoVue联合超声辐照组的TLR4蛋白表达明显减少,因此超声靶向微泡破裂技术联合shRNA可能可以有效抑制CA1区锥形细胞的TLR4表达。
RNAi是指在进化过程中高度保守的、由dsRNA诱发的、同源mRNA高效特异性降解的现象。使用该技术可以特异性地结合细胞RNA,导致目的基因的mRNA分解,随后使相应蛋白质表达下调。当前,RNAi技术的主要两种类型为化学合成siRNA和shRNA[12-13]。siRNA载体易于转染到细胞中,在沉默靶基因中效果显著,但只能短期抑制基因表达[14]。然而,shRNA表达载体可用于体内转录并产生shRNA,并生成相应的siRNA,其干扰效果与siRNA相同,而且能够解决siRNA干扰时间短的缺点,其效果甚至能使靶基因表达减少并维持数周甚至数月[15]。在以往的研究中,shRNA对靶基因的抑制效果良好[16]。在将来的应用中,需要考虑到应尽量减少对患者的操作次数并保持稳定的抑制效率。Liu等[17]使用shRNA抑制Wnt2B2高表达的A549细胞、Hela细胞和PANC1细胞,发现抑制效果可以持续4 d以上。因此,本实验采用shRNA作为干扰载体,在4 d后提取蛋白发现对TLR4蛋白仍具有抑制作用,证明shRNA抑制效果可以持续4 d。
UTMD是指在特定部位使用特定频率的超声辐照,使到达该部位的微泡破裂产生微射流使血管壁或者细胞膜表面出现可逆性的小孔,增加通透性从而使外源性物质如药物基因载体等更容易进入靶器官或者细胞中从而达到靶向治疗目的[18-19]。UTMD技术有3大特点:①安全性,超声微泡造影剂是一种微气泡混悬液,可经过人体代谢时间短,可随着人体呼吸自然排出,毒副作用小;②靶向传输的特性,在靶向部位给予一定功率的超声辐照(包括较高机械指数的诊断超声),载药微泡可在特定位置破裂,释放所携带的药物或基因;③促渗透或转移的作用,微泡破裂可产生空化效应、微射流等使微血管或细胞出现可逆性的小孔使通透性一过性升高,以促进药物或基因的渗透[20]。在实验中,直接注射质粒而不进行超声辐照时,抑制效果和对照组差异无显著性,而在超声辐照的辅助下,质粒联合超声辐照组和质粒与SonoVue联合超声辐照组与对照组相比,TLR4的表达均有明显下降。Feichtinger[21]使用可表达骨形态发生蛋白(bone morphogenetic protein,BMP)的质粒并应用超声辐照成功使质粒转移至大鼠股骨缺损处,并使其稳定表达,而且观察到照射部位骨组织生长,但未经过超声照射部位则无这些表现,可见超声在基因转移中的重要性。我们对大鼠进行了超声辐照,大鼠术后4 d内神经功能评分正常,取脑时未见有出血点。Qiu等[22]在研究中使用2 MHz的低压超声联合质粒-微泡复合物在体外转染人乳腺癌细胞,乳腺癌细胞生长被抑制并观察到微泡在乳腺癌细胞上形成的小孔。Guo等[23]使用超声照射质粒-微泡复合物成功使报告基因在ECV304细胞中表达,说明了通过使用UTMD技术可使基因成功转染至细胞中并使其表达。陈智毅[24]通过超声辐照培养皿中的质粒-微泡复合物,结果表明超声辐照不会影响基因的完整性,照射后质粒结构完整,没有发生断裂。而本课题组也在实验中发现,质粒与SonoVue联合超声辐照组相对于质粒联合超声辐照组对TLR4有更明显的抑制作用,可见超声靶向微泡击破提高了基因转染率,可能的机制是通过超声的声孔作用以及微泡的空化效应,使胞膜上形成的瞬时孔从而穿透脑脊液-脑屏障[25]。另外,附着在细胞膜上的脂质体微泡与细胞膜亲和力较强,可能和细胞膜相互作用,使细胞信号级联放大[26]。因此,本实验中抑制效果得到显著提高。但相较于其他实验[23,27-28],本研究采用的侧脑室注射法,属于侵袭性操作,伤害较大,有可能导致脑部TLR4蛋白表达上调[29]。另外,本研究尚未在脑缺血模型中展开,对注射途径、质粒浓度、微泡浓度也未展开对比分析,观察时间相对较短,超声靶向微泡破裂联合shRNA的具体机制仍需进一步研究。
综上所述,超声微泡造影剂联合shRNA质粒可高效沉默TLR4基因,该技术有望应用于脑部基因治疗,并将为以后非侵袭性的脑部基因传输奠定基础。
1 Maroso M, Balosso S, Ravizza T, et al. Tolllike receptor 4 and high-mobility group box-1 are involved in ictogenesis and can be targeted to reduce seizures[J]. Nat Med, 2010,16:413-419.
2 Qiu J, Xu J, Zheng Y, et al. High-mobility group box 1 promotes metalloproteinase-9 upregulation through Toll-like receptor 4 after cerebral ischemia[J]. Stroke, 2010,41:2077-2082.
3 Hyakkoku K, Hamanaka J, Tsuruma K, et al.Toll-like receptor 4 (TLR4), but not TLR3 or TLR9, knock-out mice have neuroprotective effects against focal cerebral ischemia[J].Neuroscience, 2010, 171:258-267.
4 Liang Yl, Lei ZG, Zhang H, et al. Tolllike receptor 4 is associated with seizures following ischemia with hyperglycemia[J].Brain Res, 2014, 24:75-84.
5 刘思兰, 杨建平, 王丽娜, 等. 有效抑制小胶质细胞上TLR4表达的siRNA筛选及转染复合物细胞毒性的检测[J]. 中国药理学通报, 2010, 26:457-461.
6 陈智毅, 谢明星. 超声靶向破坏微泡技术的应用进展[J]. 中国医学影像技术, 2010, 26:1790-1792.
7 童林艳, 李晋芳, 胡长林, 等. 超声波介导微泡破裂促EGFP基因转染大鼠脑组织的实验研究[J]. 中国超声医学杂志, 2008, 24:1-3.
8 Moraga A, Pradillo JM, Cuartero MI, et al.Toll-like receptor 4 modulates cell migration and cortical neurogenesis after focal cerebral ischemia[J]. FASEB J, 2014, 28:4710-4718.
10 Zhang M, Li WB, Geng JX, et al. The upregulation of glial glutamate transporter-1 participates in the induction of brain ischemic tolerance in rats[J]. J Cereb Blood Flow Metab, 2007, 27:1352-1368.
11 Schmidt Kastner R, Freund TF. Selective vulnerability of the hippocampus in brain ischemia[J]. Neuroscience, 1991, 40:599-636.
12 Paddison PJ, Caudy AA, Bernstein E, et al.Short hairpin RNAs (shRNAs) induce sequence specific silencing in mammalian cells[J].Genes Dev, 2002, 16:948-958.
13 Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells[J].Science, 2002, 296:550-553.
14 Ling X, Li F. Silencing of antiapoptotic Survivin gene by multiple approaches of RNA interference technology[J]. Biotechniques,2004, 36:456-460.
15 Czauderna F, Fechtner M, Aygn H, et al.Functional studies of the PI (3)-kinase signal ling pathway employing synthetic and expressed siRNA[J]. Nucleic Acid Res, 2003,31:670-682.
16 Dai J, Zou S, Pei Y, et al. Polyethyleniminegrafted copolymer of poly (L-lysine) and poly (ethylene glycol) for gene delivery[J].Biomaterials, 2011, 32:1694-1705.
17 Liu D, Kadota K, Ueno M, et al. Adenoviral vector expressing short hairpin RNA targeting Wnt2B has an effective antitumour activity against Wnt2B2-overexpressing tumours[J]. Eur J Cancer, 2012, 48:1208-1218.
18 Yang X, Zhu B, Dong T, et al. Interactions between an anticancer drug and polymeric micelles based on biodegradable polyesters[J].Macromol Biosci, 2008, 8:1116-1125.
19 Geis NA, Katus HA, Bekeredjian R. Microbubbles as a vehicle for gene and drug delivery:current clinical implications and future perspectives[J]. Curr Pharm Des, 2012, 18:2166-2183.
20 Qiu Y, LuoY, Zhang Y, et al. The correlation between acoustic cavitation and sonoporation involved in ultrasound-mediated DNA transfection with polyethylenimine (PEI) in vitro[J]. J Control Release,2010, 145:40-48.
21 Feichtinger GA, Hofmann AT, SlezakP, et al.Sonoporation increases therapeutic efficacy of inducible and constitutive BMP2/7 in vivo gene delivery[J]. Hum Gene Ther Methods, 2014, 25:57-71.
22 Qiu Y, Zhang C, Tu J, et al. Microbubble-induced sonoporation involved in ultrasound-mediated DNA transfection in vitro at low acoustic pressures[J]. J Biomech, 2012, 45:1339-1345.
23 Guo DP, Li XY, Sun P, et al. Ultrasound/microbubble enhances foreign gene expression in ECV304 cells and murine myocardium[J]. Acta Biochim Biophys Sin(Shanghai), 2004, 36:824-831.
24 陈智毅, 谢明星, 王新房, 等. 超声靶向微泡破裂联合PEI增强小鼠EGFP基因心肌转染[J]. 中国医学影像技术, 2009,25:25-28.
25 Ye L, Husnain KH, Tan R, et al. Transplantation of nanoparticle transfected skeletal myoblasts overexpressing vascular endothelial growth factor-165 for cardiac repair[J]. Circulation, 2007, 116:I113-I120.
26 van Wamel A, Bouakaz A, Versluis M, et al.Micromanipulation of endothelial cells:ultrasoundmicrobubble-cell interaction[J]. Ultrasound Med Biol,2004, 30:1255-1258.
27 Lee JL, Lo CW, Ka SM, et al. Prolonging the expression duration of ultrasound-mediated gene transfection using PEI nanoparticles[J]. J Control Release, 2012, 160:64-71.
28 Duck FA. Hazards, risk and safety of diagnostic ultrasound[J]. Med Eng Phys, 2008, 30:1338-1348.
29 Iori V, Maroso M, Rizzi M, et al. Receptor for advanced glycation endproducts is upregulated in temporal lobe epilepsy and contributes to experimental seizures[J]. Neurobiol Dis, 2013, 58:102-114.
【点睛】
TLR4与脑梗死后痫性发作及预后相关,本研究应用超声靶向微泡破裂联合短发夹核糖核酸干扰技术沉默TLR4,有望应用于脑部基因治疗,并将为以后非侵袭性的脑部基因传输奠定基础。
