芬吗通和补佳乐在冻融胚胎移植周期中的应用比较
2015-01-21王佩玉赵军招金聪聪肖仕全林佳朱如如
王佩玉,赵军招,金聪聪,肖仕全,林佳,朱如如
(温州医科大学附属第一医院 生殖医学中心,浙江 温州 325000)
冻融胚胎移植(frozen-tharwed embryo transfer,FET)技术作为体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)新鲜周期失败或因各种原因放弃移植后的补充治疗,能明显提高累积妊娠率,降低患者费用,其作为辅助生殖技术,已经广泛应用于临床。如何增加FET的成功率已经成为生殖医学研究的重点之一。目前的研究表明,FET的成功率与胚胎质量、子宫内膜容受性、胚胎移植技术、治疗方案等相关[1-2]。临床上内膜的准备主要有自然周期、促排卵周期及激素替代周期。激素替代周期由于其时间可控性、效果良好等优点被大部分患者接受。本研究主要探讨阴道塞芬吗通片和口服补佳乐片在FET替代周期中的效果及其对妊娠结局的影响。
1 资料和方法
1.1 一般资料 选取2011年7月-2012年12月在本中心接受IVF-ET治疗后需要进行第5天(D5)囊胚移植的患者280例,年龄20~38岁,平均(29.96±4.31)岁,不孕年限1~20年,平均(5.42±3.07)年。排除因素:年龄>38周岁,输卵管积水,中、重度子宫内膜异位症,子宫畸形,高雄激素血症等内分泌异常患者。其中采用芬吗通加黄体酮替代方案107例(A组),补佳乐加黄体酮替代方案173例(B组),2组患者不孕年龄、不孕年限及基础卵泡刺激素(basal follicle stimulating hormone,bFSH)、基础黄体生成素(basal luteinizing hormone,bLH)、睾酮(testosterone,T)及雌二醇(estradiol,E2),差异均无统计学意义(P>0.05),见表1。2组病因构成:A组输卵管因素61例(占57.01%),男性因素26例(占22.43%),多囊卵巢综合征(polycystic ovary syndrome,PCOS)患者13例(占12.15%),其他因素7例(占6.5%);B组输卵管因素99例(占57.22%),男性因素37例(占21.38%),PCOS患者20例(占11.56%),其他因素17例(占9.82%)。2组病因构成比较差异无统计学意义(P>0.05)。
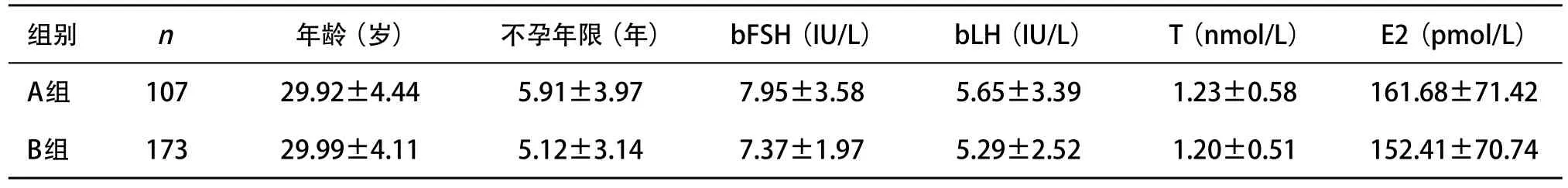
表1 2组患者一般情况比较( ±s)
1.2 方法
1.2.1 冻融胚胎及评价标准:按照本中心常规方法进行取卵、体外受精、胚胎培养、冷冻及解冻。观察受精后原核期、48 h、72 h、D5、第6天(D6)胚胎变化。在72 h进行胚胎评估,根据细胞数和碎片多少对胚胎进行分级。所有胚胎进行囊胚培养。在D5或者D6按Gardener标准进行评估[3],以数字1~6表示囊胚从开始扩张度和孵化中间的不同状态,以字母A、B、C对内细胞团及滋养外胚层细胞表示细胞数量和聚集程度。对发育至二级,内细胞团B级以上囊胚进行玻璃化冷冻。将优质囊胚定义为:囊胚扩张程度为完全扩张(3级或3级以上),滋养层和内细胞团均达B级以上且至少有一个达A级(>3B)。
胚胎冷冻:欲冷冻胚胎在平衡液(equilibration solution,ES)中平衡12 min左右至囊胚完全恢复到初始状态,然后将囊胚移入冷冻液(vitrification solution,VS)中,采用吹打方法迅速使胚胎再次皱缩。在1 min内将胚胎装载到载杆上并置入液氮中保存。
胚胎解冻:按标准准操作进行,即胚胎连同载杆离开液氮后迅速置入预热至37 ℃的解冻液(thawing solution,TS)中,在显微镜下可见胚胎慢慢从载杆上滑落至第一液TS液中。1 min内将胚胎移入第二液稀释液(diluent solution,DS),带入少许(约2 μ L)TS,放于室温3 min。然后用同样方法移入第三液洗液1(washing solution 1,WS1)中,5 min后移入第四液洗液2(washing solution 2,WS2)中,此时尽量少带WS1液。同时打开温台加热。5 min后移入预先平衡好的囊胚培养液中。1 h后评价囊胚恢复情况并行胚胎移植。冷冻、解冻所用的试剂盒均来自日本加藤公司。
1.2.2 子宫内膜的准备:芬吗通方案:月经周期第5~第7天开始用芬吗通片(白片,含E2 1 mg,雅培公司,荷兰)每天1片,塞阴道,每隔3~5 d予B超监测内膜厚度,当内膜厚度≥8 mm且血中E2水平≥650 pmol/L,孕酮(progesterone,P)<5 nmol/L时加用孕激素转化内膜,即黄体酮针60 mg每天1次肌注及芬吗通片(灰片,含E2 1 mg和地屈孕酮10 mg)早晚各1片口服,5 d后行冻融囊胚移植。补佳乐方案:月经周期第2~第5天开始口服补佳乐片(拜耳公司,德国)早晚各2片,每隔3~5 d予B超监测内膜厚度,根据内膜厚度逐渐增加补佳乐用量,直至早晚各4片,当内膜厚度≥8 mm且血中E2水平≥650 pmol/L,P<5 nmol/L时加用孕激素转化内膜,即黄体酮针60 mg每天1次肌注及地屈孕酮片(达芙通,雅培公司,荷兰)早晚各1片口服,5 d后行冻融囊胚移植。若使用芬吗通片或补佳乐片≥15 d后内膜厚度仍≤7 mm,放弃本周期移植。内膜厚度测量为两外层强回声线的最大垂直距离。
1.2.3 胚胎移植:将解冻后胚胎转移到移植管,置入宫腔,距离宫底约2 cm。所有患者胚胎移植后均正常生活,但需避免剧烈运动,胚胎移植后继续原剂量给芬吗通片或补佳乐片和黄体酮,连续2周。
1.2.4 妊娠确定及随访:胚胎移植术后12 d测晨尿人绒毛促性腺激素(human chorionic gonadotropin,hCG),若尿hCG呈阳性则测定血hCG,若血hCG>10 U/L,即诊断为妊娠。血hCG呈下降趋势或移植后4周经阴道超声检查未见孕囊,即诊断为生化妊娠。临床妊娠指移植后4周,经超声检查确认有孕囊存在,宫内见胎心搏动则为宫内妊娠;宫内未见孕囊但宫外见孕囊为异位妊娠。
1.3 统计学处理方法 采用SPSS 17.0统计软件进行统计学分析。计量资料用 ±s表示,若方差齐时采用两独立样本t检验,方差不齐时采用Cochran近似t检验。计数资料比较采用x2检验和Fisher’s精确检验。P<0.05为差异有统计学意义。
2 结果
2.1 临床及实验室结果 比较A、B 2组孕激素转化前雌激素的使用时间及使用剂量,B组均显著高于A组,差异有统计学意义(P<0.05)。而2组孕激素转化日子宫内膜厚度、D5囊胚解冻后优质胚胎率、胚胎移植个数差异均无统计学意义(P>0.05)。见表2。

表2 2组临床及实验室检查结果比较( ±s)
2.2 妊娠结局 A组移植周期107个,hCG阳性67例,临床妊娠62例,每移植周期的临床妊娠率为57.94%(62/107)。双胎妊娠12例,三胎妊娠1例(通过选择性减胎手术减为双胎妊娠,术后自然减胎为单胎妊娠)。多胎妊娠发生率为20.97%(13/62),自然流产率为19.35%(12/62),异位妊娠率为1.86%(2/107)。
B组移植周期173个,hCG阳性106例,临床妊娠96例,每移植周期的临床妊娠率为55.49%(96/173)。双胎妊娠21例,三胎妊娠1例(通过选择性减胎手术减为单胎妊娠)。多胎妊娠发生率为22.91%(22/96),自然流产率为16.67%(16/96),异位妊娠率为0.57%(1/173)。2组的hCG阳性率、临床妊娠率、异位妊娠率、自然流产率及多胎妊娠率差异均无统计学意义(P>0.05)。
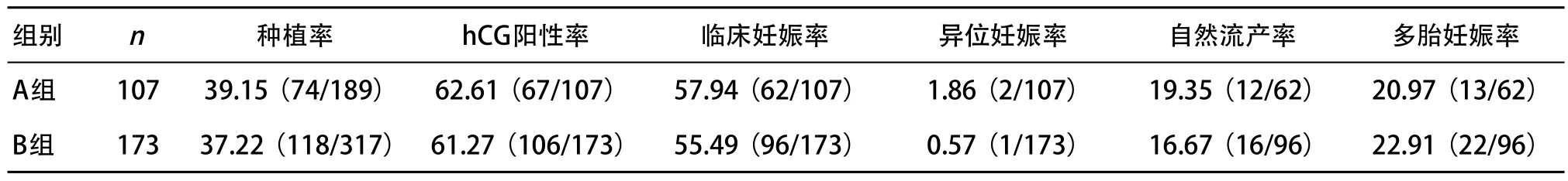
表3 2组的妊娠结局比较(%)
3 讨论
在辅助生殖技术中,FET主要用于以下几方面情况:移植新鲜胚胎未妊娠、降低或避免重度卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)发生行全胚冷冻[4]、自然周期或微刺激可移植胚胎数目少、新鲜周期子宫内膜过薄或子宫内膜病变不适合移植、反复新鲜早胚种植失败等。对于一些特殊病例,如高龄或卵巢储备功能下降的患者合并子宫腺肌症、子宫肌瘤、输卵管积水等影响胚胎种植,也可以先取卵和冷冻胚胎,并行手术治疗,术后合适的时间再行FET。所以,冻融胚胎移植技术已成为辅助生殖技术不可或缺的重要部分。FET的成功率与年龄、胚胎质量、子宫内膜的容受性、移植技术等有关。在同等年龄及胚胎质量的条件下,成功妊娠的关键是胚胎和子宫内膜的同步化。子宫内膜的准备是FET过程中重要的步骤,子宫内膜太厚或过薄都可能影响胚胎着床[5-6]。因此,如何准备冻融胚胎移植周期的子宫内膜,是生殖医学界需探讨的重要课题。
常用的子宫内膜准备方案包括:自然周期法、激素替代周期法和促排卵法。自然周期更接近生理过程,用药量少,但是排卵时间不可控,需密切监测B超,一般在排卵正常的患者中使用。促排卵周期可能造成人为体内高激素环境,种植窗开放可能提前,并且因多卵泡可能有发生OHSS风险。替代周期可适用于月经正常、有或无排卵、排卵障碍等患者,由于使用雌孕激素来控制子宫内膜的增长及转化,用药量较大,但可以更好地掌握和安排胚胎移植的时机。目前,每个生殖中心采用的方法及用量剂量各不相同,而哪种内膜准备方法有明显优势目前尚无定论[7]。Groenewoud等[8]对20篇文献的一项Mata分析提示,目前尚不能认为哪种内膜准备的方法优于另外一种。Page等[9]对199个FET周期进行了前瞻性的对照研究,认为激素替代周期与促排卵周期准备内膜在胚胎种植率上无显著差异。国内陈士岭等[10]通过研究认为不同内膜准备方案妊娠结局也无明显差异,应根据患者情况选择进行FET的个性化用药方案。
本研究主要探讨在激素替代周期FET中,单独使用芬吗通或补佳乐对子宫内膜的作用及其对妊娠结局的影响。补佳乐为口服雌激素,每片含1 mg戊酸雌二醇,需经肝脏脱除戊酸基才能变成有活性的17β-E2,其作为替代雌激素已在FET周期中应用多年,其对子宫内膜的作用较为稳定,血雌激素升高平稳,效果较好。但口服给药使部分患者因药物对胃黏膜刺激症状明显而无法耐受。另外临床中部分患者使用大剂量补佳乐仍无法达到理想厚度的内膜,尤其是部分子宫内膜薄、宫腔粘连史、多次流产史患者。已有报道对这部分患者使用芬吗通代替补佳乐,获得了良好的效果[11]。芬吗通是近几年来出现的雌孕激素复合药物,白片每片含有1 mg 17 β-E2,灰片每片含有1 mg 17 β-E2和10 mg地屈孕酮。17β-E2为微粒化E2,不需要转换就能直接作用于雌激素受体,可口服及阴道给药,并且阴道吸收效果优于口服。故本中心在子宫内膜增生期,单独应用白色片(17 β-E2)阴道给药,使用黄体酮转化为分泌期时开始加用灰色片口服给药。
本研究结果表明,与补佳乐片相比,使用阴道塞芬吗通片可以有效地增加子宫内膜厚度,给药时间较短,并且可以获得相似的临床妊娠率。但根据本中心用药经验,芬吗通阴道给药可在短时间内提高血E2水平,且E2水平波动较大,可控性较差。本研究也显示,E2的水平升高在不同的患者之间相差甚大,可能与用药天数和不同个体对药物的吸收率有关,所以需要通过更多的研究探讨芬吗通阴道给药的最佳剂量和持续时间。并且少部分患者长时间阴道给药后出现阴道分泌物增多、外阴瘙痒等刺激症状。但是本研究也表明,芬吗通应用于替代周期FET中都可以获得良好的临床妊娠率,芬吗通片可以替代补佳乐片在替代周期FET中使用,并且阴道给药可以直接促进内膜发育,用量少,效果良好。
综上所述,芬吗通作为一种较新的激素替代药物,可替代补佳乐在FET中单独使用,但其最有效给药剂量、用药天数及对子宫内膜容受性、血E2水平的影响等还有待大样本量的随机前瞻对照研究。
[1] V eleva Z, Orava M, Nuojua-Huttunen S, et al. Factors affecting the outcome of frozen-thawed embryo transfer[J].Hum Reprod, 2013, 28(9): 2425-2431.
[2] Ashra f M, Jahangiri N, Hassani F, et al. The factors affecting the outcome of frozen-thawed embryo transfer cycle[J].Taiwan J Obstet Gynecol, 2011, 50(2): 159-164.
[3] Gardner DK, Lane M, Stevens J, et al. Blastocyst score affects implantation and pregnancy outcome: towards a single blastocyst transfer[J]. Fertil Steril, 2000, 73(6): 1155-1158.
[4] Griesinger G, Schultz L, Bauer T, et al. Ovarian hyperstimulation syndrome prevention by gonadotrophin-releasing hormone agonist triggering of final oocyte maturation in a gonadotrophin-releasing hormone antagonist protocol in combination with a “freeze-all” strategy: a prospective multicentric study[J]. Fertil Steril, 2011, 95: 2029-2033.
[5] El-Toukhy T, Coomarasamy A, Khairy M, et al. The relationship between endometrial thickness and outcome of medicated frozen embryo replacement cycles[J]. Fertil Steril,2008, 89(4): 832-839.
[6] Y oeli R, Ashkenazi J, Orvieto R, et al. Significance of increased endometrial thickness in assisted reproduction technology treatments[J]. J Assist Reprod Genet, 2004, 21(8):285-289.
[7] W eissman A, Levin D, Ravhon A, et al. What is the preferred method for timing natural cycle frozen-thawed embryo transfer?[J]. Reprod Biomed Online, 2009, 19(1): 66-71.
[8] Groenewoud ER, Cantineau AE, Kollen BJ, et al. What is the optimal means of preparing the endometrium in frozenthawed embryo transfer cycles? A systematic review and meta-analysis[J]. Hum Reprod Update, 2013, 19(5): 458-470.
[9] Page KL, Guibert J, Weitzen S, et a1. A prospective random-ized trial evaluating endometrial preparation for implantation of frozen/thawed embryos using an arti f cial cycle versus a stimulated cycle[J]. Fertil Steril, 2005, 84(Suppl1):S171-S172.
[10] 陈士岭, 何锦霞, 宋华东, 等. 应用四种用药方案进行冻融胚胎移植的临床结局比较[J]. 南方医科大学学报, 2007,27(3): 303-306.
[11] 耿嘉瑄, 张翠莲, 张少娣, 等. 不同内膜准备方案在冻融胚胎移植中的应用[J]. 现代妇产科进展, 2012, 21(9): 706-708.
