富含缓释淀粉高单不饱和脂肪酸型肠内营养制剂对糖耐量异常患者糖脂代谢的影响
2015-01-05吴文俊项松英沈飞霞王毅陈雄谷雪梅
吴文俊,项松英,沈飞霞,王毅,陈雄,谷雪梅
(温州医科大学附属第一医院,浙江 温州 325015,1.内分泌科;2.妇科;3.营养科)
糖耐量异常(impaired glucose tolerance,IGT)是从正常血糖发展至糖尿病的中间阶段,是心血管疾病的一项独立危险因素。与血糖正常者相比,餐后高血糖者全因死亡风险增加[1-2]。控制好餐后高血糖对获得血糖达标、防治糖尿病大血管和微血管并发症均具有重要意义。医学营养治疗通过合理调配膳食纤维,延缓碳水化合物的消化和吸收,降低餐后血糖,并避免餐后血糖大幅度波动[3]。2型糖尿病患者应用缓释低碳水化合物单不饱和脂肪酸(monounsatu-rated fatty acids,MUFA)肠内营养(enteral nu-trition,EN)制剂后,其餐后血糖显著低于服用普通糖尿病膳食者,血脂异常亦得到相应的改善[4-6]。研究表明高膳食纤维饮食有利于预防2型糖尿病[7]。既往的膳食干预研究多针对糖尿病患者,对于IGT患者的研究很少。本研究旨在比较富含缓释淀粉高MUFA型EN制剂和同等热量普通膳食对IGT患者糖脂代谢的影响,探讨应用缓释淀粉高MUFA型EN制剂对糖尿病前期患者的干预作用。
1 资料和方法
1.1 一般资料 选取2013年5-12月我院内分泌科门诊IGT患者62例。入选标准:①经75 g口服葡萄糖耐量试验诊断为单纯IGT患者,符合1999年WHO的IGT诊断标准;②随机分组前进行饮食管理和运动治疗2个月以上但未开始应用任何降糖药物治疗;③年龄20~75岁;④签署知情同意书。排除标准:肝肾功能不全,甲状腺功能异常,肾上腺疾病,严重高脂血症[甘油三酯(TG)>5 mmol/L和/或低密度脂蛋白胆固醇(LDL-c)>4.14 mmol/L],合并有心脑血管疾病如冠心病、脑梗死、脑出血或血压控制不良(≥160/100 mmHg),3个月内应用过降糖药物以及不能按照研究既定方案执行EN制剂治疗的患者。将入组对象随机分为试验餐组(n=32)和普通餐组(n=30),进食等热量不同类别早餐。2组患者的年龄、性别、腰围、体质量、体质量指数(BMI)、空腹血糖(FPG)、餐后2 h血糖(PPG)、糖化血红蛋白(HbA1c)、空腹胰岛素(FINS)、餐后2 h胰岛素(PINS)、TG、总胆固醇(TC)、LDL-c和高密度脂蛋白胆固醇(HDL-c)差异均无统计学意义,具有可比性,见表1。
1.2 方法 在研究期间,均继续给予试验餐组和普通餐组患者除药物之外的综合性干预措施,保持饮食摄入和运动量稳定,提供健康生活理念指导。由营养师根据患者体质量计算每天需要的热量。试验餐组患者早餐服用富含缓释淀粉高MUFA型EN制剂(益力佳SR营养配方粉,美国雅培制药有限公司生产),100 g粉末配制成标准冲调液455 mL;普通餐组患者早餐服用等热量的普通膳食一份(纯牛奶250 mL+淡馒头一只),纯牛奶选用纽迪西亚(黑龙江)营养制品有限公司的荷兰乳牛即溶全脂奶粉标准冲调液,淡馒头由我院营养食堂用标准面粉(75g/只)称质量制作。除水可以自由摄入以外,不服用其他任何食物。两种早餐能量基本相当,主要营养成分构成见表2。发放日记本并每周回收营养配方粉和奶粉空罐以评估患者依从性。

表1 2组患者的一般资料比较
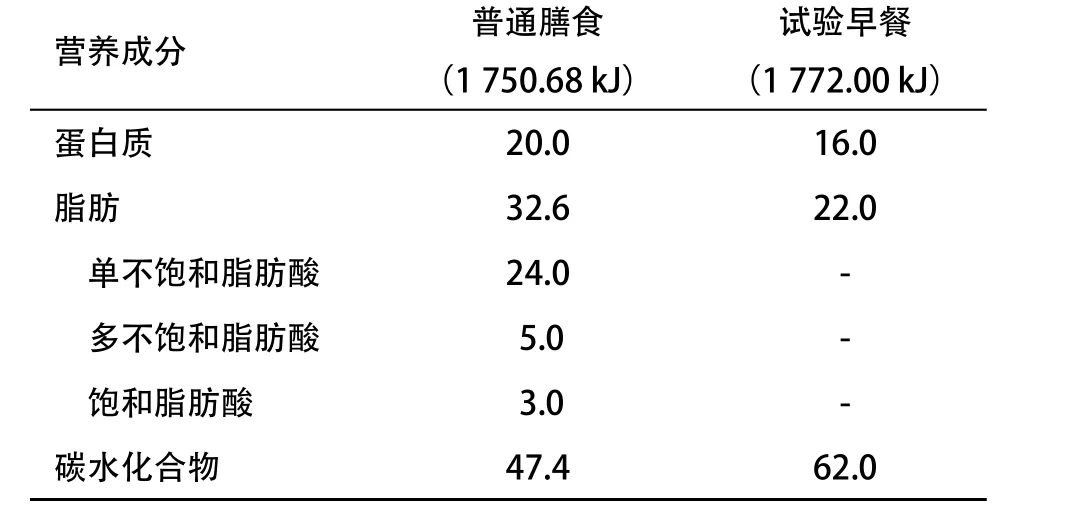
表2 2种早餐主要营养成分构成(占总热量的百分率)
1.3 观察指标 4周后,固定专人测定2组患者的身高、体质量、腰围、臀围,计算BMI、腰臀比,ARCHITECT Ci8200全自动生化仪测定FPG、PPG、TG、TC、LDL-c、HDL-c、FINS、PINS[试剂盒购自罗氏诊断产品(上海)有限公司],葡萄糖氧化酶法测定血糖,化学发光法测定血胰岛素,高效液相色谱法测定HbA1c。
1.4 统计学处理方法 数据输入SPSS19.0软件包进行统计分析。计量资料用 ±s描述,2组间比较采用独立样本t检验,组内比较采用配对t检验,计数资料采用x2检验。P<0.05(双侧)为差异有统计学意义。
2 结果
2.1 对糖脂代谢的影响 4周后,试验餐组患者血PPG、PINS水平明显低于普通餐组,差异有统计学意义(P<0.01),2组FINS和FPG比较差异均无统计学意义(P>0.05);试验餐组干预后血清PPG和PINS水平较干预前明显降低(P<0.01),普通餐组干预后PPG和PINS水平与干预前比较差异无统计学意义(P>0.05);干预后,试验餐组血清TG、LDL-c和TC浓度低于普通餐组(P<0.05或P<0.01),与干预前比较,试验餐组干预后血清TG、LDL-c、TC水平明显下降(P<0.05或P<0.01),普通餐组干预前后差异无统计学意义(P>0.05);2组间HDL-c水平比较,差异无统计学意义(P>0.05)。见表3。
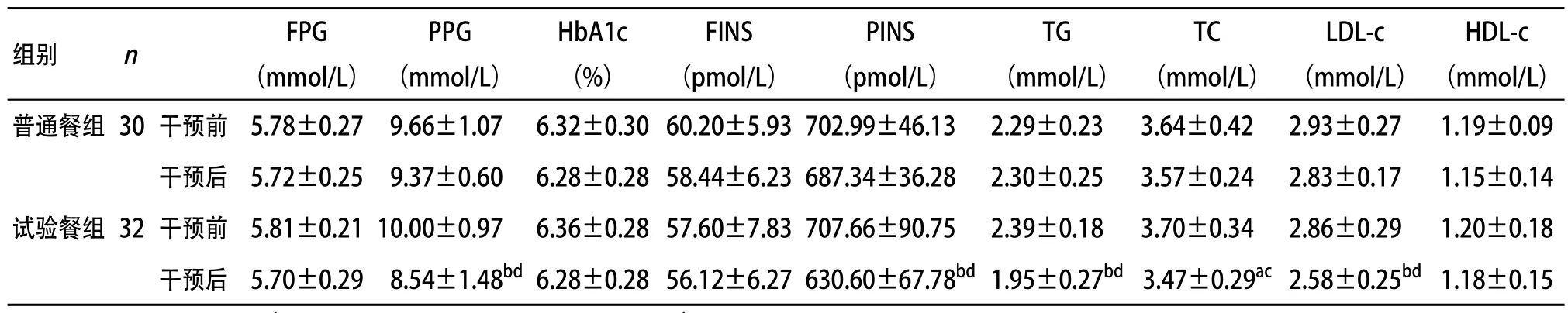
表3 干预4周后2组糖脂代谢各项指标比较( ±s)
2.2 对体质量和腰围的影响 试验餐组在干预4周后体质量较干预前减轻,BMI减小,差异有统计学意义(P<0.05),但2组间干预前后体质量和BMI差异均无统计学意义(P>0.05);2组干预前后腰围和腰臀比差异亦均无统计学意义(P>0.05)。见表4。
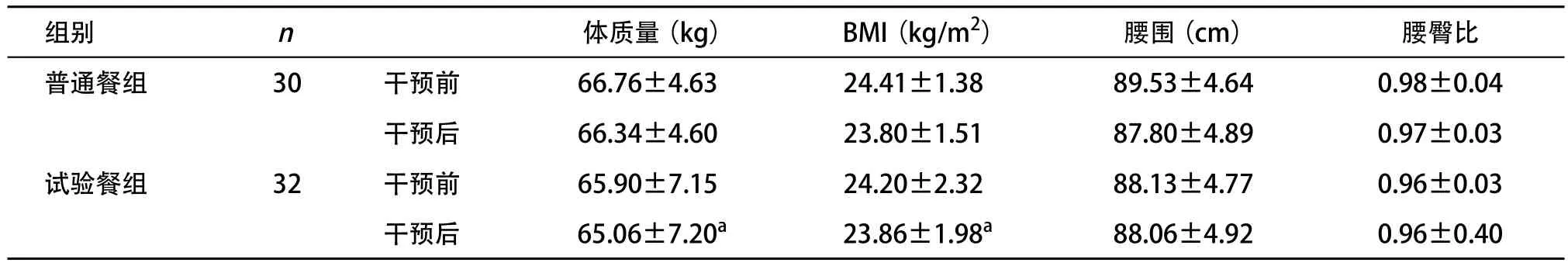
表4 医学营养干预对体重、腰围的影响( ±s)
2.3 不良反应 研究过程中患者对不同膳食均耐受良好,总体安全性高。试验餐组有1例患者出现腹胀、肠鸣,继续干预过程中自行好转,普通餐组患者均无不良反应发生。
3 讨论
最新流行病学调查显示,我国目前年龄标准化的糖尿病患病率已经达到9.7%,糖尿病前期的患病率高达15.5%,总计有接近9 240万的糖尿病患者和1.5亿的糖尿病前期人群,给社会经济带来沉重负担的同时,也给糖尿病的预防和治疗工作提出了极大的挑战[8]。IGT是发展为糖尿病的一个中间阶段,PPG升高也是引起糖尿病患者发生心血管事件的独立危险因素[9-11],糖调节受损常合并脂质代谢紊乱,加速动脉粥样硬化的进程。因此,早期对IGT患者进行有效干预是延缓糖尿病及其并发症发生、发展的重要手段。研究发现,富含缓释淀粉高MUFA型EN制剂添加了抗性淀粉、MUFA、膳食纤维等,可以对糖尿病患者的血糖、血脂产生有益的影响[4-5,12]。本研究结果显示,试验餐组患者在干预4周后PPG、PINS明显低于普通餐组,且较干预前明显降低,这可能与缓释碳水化合物系统减缓了糖类的吸收,降低了餐后胰岛素的应答有关。Yokoyama等[13]观察了高MUFA和高碳水化合物饮食对日本糖尿病患者和健康志愿者的血糖浓度和胰岛素分泌模式的影响,发现高MUFA饮食可以改善受试者餐后血糖而不增加胰岛素分泌。本研究中,试验餐组患者在干预4周后TG、TC、LDL-c也均明显下降,与普通餐组相比差异有统计学意义,其机制为膳食纤维在肠道吸附脂肪使脂肪吸收率下降,从而有效降低血清TG和TC水平,改善患者的脂质代谢。此外,本研究结果还显示,该EN制剂富含缓释淀粉和MUFA,在总热量基本平衡的条件下,能使患者体质量下降,更适合于超重或肥胖患者应用。有报道称MUFA饮食可以预防向心性脂肪堆积,而富含糖类饮食则引起餐后脂联素表达水平降低[14],与富含饱和脂肪酸(SFA)的饮食相比,MUFA饮食能显著增加胰高糖素样肽-1(GLP-1)的分泌,从而有利于餐后血糖的控制和保持体质量[15]。
本研究未发现富含缓释淀粉高MUFA型EN制剂对试验餐组患者的FPG和HbA1c产生明显的效应。HbA1c的高低主要受三餐前后血糖的长期影响,并不是仅仅由早餐后血糖波动所决定。此外,入选本研究对象均为PPG轻度升高的IGT患者,其FPG正常,HbA1c仅轻度升高,本身糖代谢异常程度轻;最后,也可能与干预时间短有关。本研究提示富含缓释淀粉高MUFA型EN制剂具有降低糖代谢异常患者TG、TC和LDL-c的作用,但不同研究发现其对血脂的影响并不一致,对于血脂不同组分的影响也未有一致的意见[16-17],还需开展更多的研究作进一步探讨。
我们认为,对于单纯IGT患者,为预防糖尿病的发生,防止和延缓相关并发症,在积极合理的运动的配合下,富含缓释淀粉和MUFA的EN制剂干预有利于改善IGT患者的糖脂代谢,将其作为医学营养治疗的策略不失为一种好的选择。
[1] Glucose tolerance and mortality: comparison of WHO and American Diabetes Association diagnostic criteria. The DECODE study group. European Diabetes Epidemiology Group. Diabetes Epidemiology: Collaborative analysis Of Diagnostic criteria in Europe[J]. Lancet, 1999, 354(9179):617-621.
[2] Barr EL, Zimmet PZ, Welborn TA, et al. Risk of cardiovascular and all-cause mortality in individuals with diabetes mellitus, impaired fasting glucose, and impaired glucose tolerance: the Australian Diabetes, Obesity, and Lifestyle Study(AusDiab)[J]. Circulation, 2007, 116(2): 151-157.
[3] 王卫庆, 宁光, 包玉倩, 等. 糖尿病医学营养治疗专家共识[J]. 中华内分泌代谢杂志, 2013, 29(5): 357-362.
[4] 陈永春, 陈小梅, 许桢, 等. 含缓释碳水化合物高单不饱和脂肪酸配方肠内营养制剂对2型糖尿病的影响研究[J]. 中国全科医学, 2012, 15(23): 2643-2645.
[5] 蔡颂文, 韩婷, 韩玉麒, 等. 富含缓释淀粉高单不饱和脂肪酸型肠内营养制剂对超重的2型糖尿病病人血糖和血脂的影响[J]. 肠外与肠内营养, 2014, 21(3): 138-141.
[6] 朱静芬, 戴斐, 谢庆文, 等. 膳食补充单不饱和脂肪酸对2型糖尿病的干预效果[J]. 上海交通大学学报(医学版),2009, 29(3): 296-298.
[7] 邢小燕, 张波, 刘玉耿, 等. 高膳食纤维饮食有利于预防2型糖尿病—新疆克拉玛依市和山西忻州农村饮食状况调查[J]. 中日友好医院学报, 2002, 16(3): 134-137.
[8] Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12):1090-1101.
[9] DECODE Study Group, the European Diabetes Epidemiology Group. Glucose tolerance and cardiovascular mortality:comparison of fasting and 2-hour diagnostic criteria[J]. Arch Intern Med, 2001, 161(3): 397-405.
[10] DECODE Study Group, European Diabetes Epidemiology Group. Is the current defi nition for diabetes relevant to mortality risk from all causes and cardiovascular and noncardiovascular diseases?[J]. Diabetes Care, 2003, 26(3):688-696.
[11] Ning F, Tuomilehto J, Pyorala K, et al. Cardiovascular disease mortality in Europeans in relation to fasting and 2-h plasma glucose levels within a normoglycemic range[J]. Diabetes Care, 2010, 33(10): 2211-2216.
[12] Stenvers DJ, Schouten LJ, Jurgens J, et al. Breakfast replacement with a low-glycaemic response liquid formula in patients with type 2 diabetes: a randomised clinical trial[J].Br J Nutr, 2014, 112(4): 504-512.
[13] Yokoyama J, Someya Y, Yoshihara R, et al. Effects of highmonounsaturated fatty acid enteral formula versus high-carbohydrate enteral formula on plasma glucose concentration and insulin secretion in healthy individuals and diabetic patients[J]. J Int Med Res, 2008, 36(1): 137-146.
[14] Paniagua JA, de la Sacristana AG, Romero I, et al. Monounsaturated fat-rich diet prevents central body fat distribution and decreases postprandial adiponectin expression induced by a carbohydrate-rich diet in insulin-resistant subjects[J]. Diabetes Care, 2007, 30(7): 1717-1723.
[15] Rocca AS, LaGreca J, Kalitsky J, et al. Monounsaturated fatty acid diets improve glycemic tolerance through increased secretion of glucagon-like peptide-1[J]. Endocrinology, 2001, 142(3): 1148-1155.
[16] Degirolamo C, Shelness GS, Rudel LL. LDL cholesteryl oleate as a predictor for atherosclerosis: evidence from human and animal studies on dietary fat[J]. J Lipid Res,2009, 50(Suppl): S434-439.
[17] Viveros A, Ortiz LT, Rodriguez ML, et al. Interaction of dietary high-oleic-acid sunfl ower hulls and different fat sources in broiler chickens[J]. Poult Sci, 2009, 88(1): 141-151.
