25-羟基维生素D与脑梗死的关系及干预治疗的临床研究
2015-01-21宋笑凯李淮玉任明山
宋笑凯,李淮玉,任明山
除了传统的危险因素以外,近年注意到维生素D缺乏可导致包括脑梗死在内的心脑血管疾病风险增大[1]。而25-羟基维生素D[25-hydroxyvitamin D,25(OH)D]是维生素D在体内的储存形式,是衡量血清维生素D状况的临床常用指标。有研究发现体内25(OH)D水平降低可能亦是卒中发病的潜在危险因素[2]。目前国内关于25(OH)D和脑梗死发病的相关性研究较少,尚不能确定血清25(OH)D水平是否与脑梗死风险及预后相关,以及维生素D干预治疗能否使脑梗死患者获益。本研究旨在对此进行初步探讨。
1 对象和方法
采用前瞻性平行对照研究设计方法,测定脑梗死患者血清25(OH)D水平并与对照组分析比较其临床资料的差异,随访观察维生素D干预治疗对脑梗死病情及预后的影响。
1.1 研究对象 连续入组2011年、2012年春季(3~6月)在安徽省立医院神经内科住院的脑梗死患者217例,其中男性119例,女性98例,平均年龄(61.21±10.36)岁。入选标准:①年龄>18岁的成人患者;②急性脑梗死发病24 h内入院;③符合2010年中国急性缺血性卒中诊治指南的脑梗死诊断标准[3],并有头颅计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)影像学验证。排除标准:①入院时美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)>22分的危重度脑梗死;②因病情原因无法口服药物;③合并有心、肝、肾功能不全;④合并慢性胃肠道炎症;⑤伴有严重感染;⑥伴有恶性肿瘤;⑦合并结缔组织病;⑧合并骨质疏松及其他骨代谢异常疾病;⑨近3个月内曾使用维生素D及其他影响骨代谢药物治疗。另同期在安徽省立医院卒中筛查门诊中选择无脑梗死的健康体检人群163例作为对照组,入选标准为临床无脑梗死症状,同时颅脑CT或MRI检查未发现病灶。本研究获得安徽省立医院伦理委员会批准,所有受试者均自愿参加本研究,患者本人或其指定授权人签署知情同意书。
1.2 研究方法
1.2.1 基线评估 所有入选患者均仔细询问病史,记录其常见卒中危险因素,如年龄、高血压病、糖尿病、高血脂、冠状动脉粥样硬化性心脏病、体重指数[body mass index(BMI),BMI=体重(千克)/身高(米)2]等,并与对照组比较。
1.2.2 血清25(OH)D水平测定 所有患者入院24 h内清晨空腹静脉采血3 ml,对照组门诊预约空腹静脉采血,血清低温离心分离后-80℃保存。采用化学发光免疫分析法检测血清25(OH)D水平,试剂盒使用美国DiaSorin公司提供的25-羟基总维生素D定量测定试剂盒(LIAISON 25-OH Vitamin D TOTAL Assay)。同时抽取静脉血测定血生化指标,包括血糖、血脂、纤维蛋白原等。
1.2.3 分组和比较指标 比较急性脑梗死组和正常对照组基线资料及血清25(OH)D水平差异,以及两组维生素D缺乏、维生素D不足及维生素D充足者的比例分布。其中,维生素D缺乏、不足和充足的定义根据国际标准为:25(OH)D<20 ng/ml为维生素D缺乏,20~29 ng/ml为维生素D不足,≥30 ng/ml为维生素D充足[4]。
国内外有文献认为实际人群中血清25(OH)D水平达20 ng/ml对健康可能已足够[5],故以该数值为分界将所有急性脑梗死患者分为25(OH)D<20 ng/ml和≥20 ng/ml两组,分析两组的临床资料特征。进一步将血清25(OH)D<20 ng/ml的维生素D缺乏患者随机分为两组,一组给予口服阿法骨化醇0.5g/d治疗持续1年,另一组不予干预治疗,除此之外两组均按2010年中国缺血性卒中和短暂性脑缺血发作(transient ischemic attack,TIA)二级预防指南的要求给予正规二级预防治疗[6]。两组患者采用电话、电邮、门诊及再入院检查等方式平行随访1年,分别记录6个月和1年的血清25(OH)D水平,同时记录患者有无TIA或脑梗死、冠状动脉粥样硬化性心脏病等复合终点事件,并对两组患者改良Rankin量表(modified Rankin Scale,mRS)进行评估比较。
1.3 统计学方法 采用SPSS 19.0统计软件对数据进行统计学分析。计数资料用频数和百分比表示,组间比较采用方差分析或χ2检验。计量资料符合正态分布的采用表示,组间比较采用t检验;非正态分布的计量资料以中位数和四分位数表示,组间比较采用独立样本的Mann-Whitney U检验。多因素分析采用多元Logistic逐步回归分析,相关性分析采用Pearson相关检验,P<0.05为差异有显著性。
2 结果
2.1 脑梗死患者和对照组的基线资料情况比较研究共入组脑梗死患者217例,年龄49~78岁;健康对照组163例,年龄52~77岁。两组在年龄、性别组成、BMI、总胆固醇、甘油三酯、低密度脂蛋白胆固醇、纤维蛋白原等方面无显著差异。脑梗死组合并高血压病、糖尿病和冠状动脉粥样硬化性心脏病史比例高于对照组,而平均血清25(OH)D水平明显低于对照组。将上述变量键入多元Logistic回归模型进行分析,校正两组间的不均衡因素,提示血清25(OH)D水平降低与脑梗死发病独立相关[比值比(odds ratio,OR)1.72,95%可信区间(confidence interval,CI)1.04~2.81,P=0.001,(表1)]。
2.2 脑梗死组和对照组不同水平25(OH)D分布情况 脑梗死组维生素D缺乏比例明显高于对照组(88.02%vs63.80%);维生素D不足和充足的比例显著低于对照组(表2)。
2.3 不同血清维生素D水平脑梗死患者临床资料分析 以血清25(OH)D值20 ng/ml为界,将脑梗死患者分为25(OH)D<20 ng/ml(191例)与25(OH)D≥20 ng/ml(26例)两组,发现两组患者在性别、年龄、高脂血症、吸烟史、体重指数等方面无显著差异;25(OH)D<20 ng/ml的脑梗死患者年龄较大,更多合并高血压病、糖尿病及冠状动脉粥样硬化性心脏病病史,而平均入院时NIHSS评分较高,差异有显著性。Pearson相关分析发现,血清25(OH)D水平与平均入院时NIHSS评分呈负相关(r=-0.720,P=0.001)(表3)。
2.4 维生素D干预组和未干预组结局比较 维生素D干预组96例,年龄范围55~78岁,未干预组95例,年龄范围54~76岁。两组的基线资料比较,在年龄、性别、高血压病、糖尿病、高脂血症、冠状动脉粥样硬化性心脏病、入院时NIHSS评分和基线25(OH)D水平等方面无显著差异(表4)。观察补充维生素D干预治疗1年对脑梗死复发风险及预后的影响,发现干预组患者随访6个月时和1年时血清25(OH)D水平较基线水平分别升高4.21 ng/ml和9.40 ng/ml,与未干预组比较差异有显著性;TIA或脑梗死终点事件复发率及平均mRS评分值均低于未干预组,但差异无显著性(表5)。随访期间两组均无失访及死亡病例,亦未观察到继发冠状动脉粥样硬化性心脏病等其他复合终点事件。

表1 脑梗死组与健康对照组基线资料

表2 脑梗死组与对照组25(OH)D水平分布情况
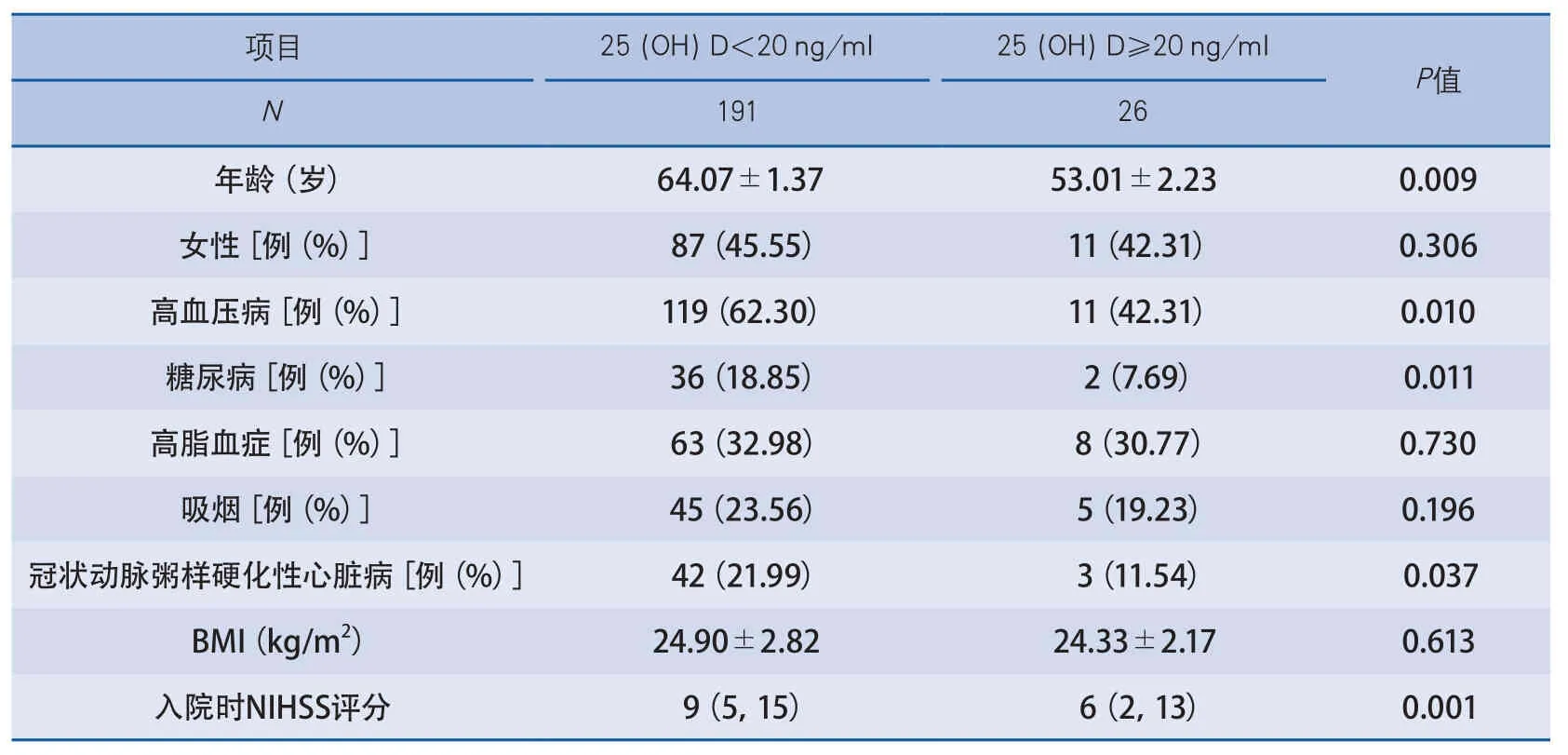
表3 不同水平25(OH)D脑梗死患者临床资料
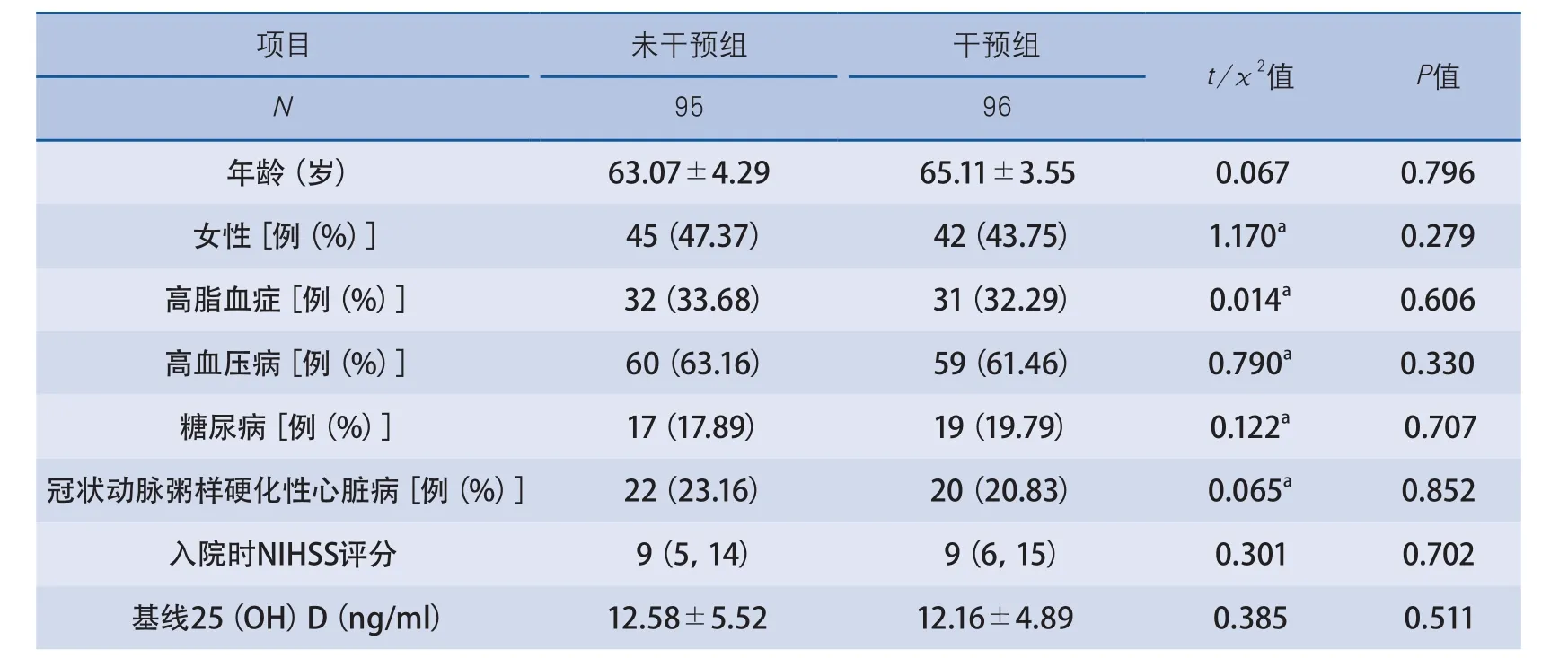
表4 干预组和未干预组基线资料

表5 干预组和未干预组1年内随访比较
3 讨论
人类获取维生素D的主要来源是阳光照射和食物摄取,维生素D不足和缺乏已经是一个日益严重的全球性问题,原因可能与户外活动减少、防紫外线用品的增加和BMI的增加有关[7]。一般认为可以通过测定血清25(OH)D浓度来评估体内维生素D状况[8]。维生素D水平有地域及季节性差异,本研究进行背景设定为合肥地区的春季,结果发现本研究中健康组人群平均血清25(OH)D水平为(20.11±2.05)ng/ml,远低于国外相关数据[9],原因可能是25(OH)D值的测定受到人种以及饮食、地域、季节等因素的影响,但也反映本地区维生素D不足更为普遍。
传统上认为维生素D主要在骨钙磷代谢中起主要作用,近年逐渐认识到维生素D在心脑血管疾病中的作用。目前国内外对25(OH)D的研究结果不一,越来越多的研究发现较低的25(OH)D水平可能与心血管疾病致死性事件风险增加[10-11]。25(OH)D与卒中的关系也引起学者的研究兴趣。一项大规模前瞻性研究发现,降低血浆维生素D水平可致脑梗死风险上升[12]。Michos等[13]报道也发现,低25(OH)D水平与发生卒中的风险增加相关,降低25(OH)D水平是卒中的易于控制的危险因素。本研究显示脑梗死组平均血清25(OH)D水平为(13.67±1.16)ng/ml,明显低于对照组。本研究还发现,脑梗死患者中25(OH)D水平不足和充足的患者所占比例远低于对照组,提示脑梗死患者25(OH)D水平的下降与卒中风险可能存在相关性,多元Logistic回归分析结果提示,血清低25(OH)D水平可能是脑梗死的独立危险因素,与国外研究结果类似[14]。
国内对25(OH)D水平正常范围的界定尚无定论,一般认为中国人群普遍低于国外标准[15]。在本研究结果中,脑梗死患者和健康对照人群血清25(OH)D水平≥30 ng/ml的比例极低,分别仅占1.84%和11.66%,而25(OH)D<20 ng/ml的人群分别多达88.02%和63.80%,与国外相关数据差异较大,国人血清25(OH)D水平的正常标准如何拟定值得关注。
本研究以血清25(OH)D水平20 ng/ml为分界将脑梗死患者分为两组比较其临床资料,结果提示25(OH)D<20 ng/ml患者同时合并高血压病、糖尿病、冠状动脉粥样硬化性心脏病病史的比例显著增高。与此类似,近年已有研究发现维生素D缺乏与高血压、糖尿病、冠状动脉粥样硬化性心脏病等密切相关。研究认为,维生素D可能通过抑制肾素血管紧张素醛固酮系统、预防甲状旁腺功能亢进、抗炎及血管保护等机制参与调节血压平衡[16];另外,由于维生素D可促进胰岛细胞分泌,减少胰岛素抵抗,大多2型糖尿病患者普遍存在25(OH)D水平低下[17]。因此,维生素D缺乏亦可能作为一个间接影响因素,通过促进动脉粥样硬化的发展以及高血压病、糖尿病的发病而增加了脑梗死的风险。
Daubail等[9]研究认为,维生素D下降水平可预示卒中病情严重程度,血清25(OH)D<25.7 ng/ml即有卒中高危风险。本研究观察到血清25(OH)D<20 ng/ml的患者入院时NIHSS评分相对较高,25(OH)D水平与入院时NIHSS评分呈负相关,提示25(OH)D水平对预测入院时脑梗死严重程度可能有一定临床意义。
补充维生素D干预治疗能否使卒中患者获益尚缺乏循证医学证据。Vacek等[18]研究发现,对于维生素D缺乏的患者,补充活性维生素D可以明显改善预后,减少全因病死率。本研究也观察了补充维生素D对脑梗死预后的影响。活性维生素D每天的最佳摄取剂量还没有明确研究,多数研究推荐每天阿法骨化醇合适剂量为0.25~0.5 μg/d[19],本研究以阿法骨化醇0.5 μg/d的剂量干预治疗,观察到随访期间干预组血清维生素D水平有明显升高,治疗1年后干预组已纠正血清维生素D缺乏状态,且未出现明显不良反应。另外,相对于未治疗组,干预组随访期间TIA或缺血性卒中复发率及mRS评分有一定下降,且随着随访时间延长,两组间差异趋于明显。但无论是6个月还是1年的随访期,数据均无显著差异,未能证明补充维生素D对改善脑梗死患者预后及降低脑梗死复发风险方面可以获益,这可能与本研究样本量过小及随访时间受限有关。另外,本研究中补充维生素D治疗的剂量,以及干预后血清25(OH)D的目标水平是否未达标也可能与最终结果相关,值得继续探讨。补充维生素D药物干预治疗的安全摄入剂量、治疗时间以及干预后血清25(OH)D达标水平还没有共识,能否大规模应用于临床治疗,能否在卒中高危人群中预防性应用,尚需要大规模的临床研究进一步验证。
1 Gunta SS, Thadhani RI, Mak RH, et al. The effect of vitamin D status on risk factors for cardiovascular disease[J]. Nat Rev Nephrol, 2013, 9:337-347.
2 De Silva DA, Talabucon LP, Nq EY, et al. Vitamin D deficiency and its relation to underlying stroke etiology in ethnic Asian ischemic stroke patients[J].Int J Stroke, 2013, 8:E18.
3 中华医学会神经病学分会脑血管病学组急性缺血性卒中诊治指南撰写组. 中国急性缺血性卒中诊治指南2010[J]. 中华神经科杂志, 2010, 43:146-153.
4 Holick MF, Binkley NC, Bischoff-Ferrari HA, et al.Evaluation, treatment and prevention of vitamin D deficiency[J]. J Clin Endocrinol Metab, 2011, 96:1911-1930.
5 Ross AC, Manson JE, Abrams SA, et al. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine:what clinicians need to know[J]. J Clin Endocrinol Metab,2011, 96:53-58.
6 中华医学会神经病学分会脑血管病学组缺血性脑卒中二级预防指南撰写组. 中国缺血性脑卒中和短暂性脑缺血发作二级预防指南2010[J]. 中华神经科杂志,2010, 43:154-160.
7 Adams JS, Hewison M. Update in vitamin D[J]. J Clin Endocrinol Metab, 2010, 95:471-478.
8 Matthias W, Holick MF. Sunlight and vitamin D:A global perspective for health[J]. Dermatoendocrinol,2013, 5:51-108.
9 Daubail B, Jacquin A, Guilland JC, et al. Serum 25-hydroxyvitamin D predicts severity and prognosis in stroke patients[J]. Eur J Neurol, 2013, 20:57-61.
10 Jaydip RC, Rukmini MK, Suvarna A, et al. Serum 25-Hydroxyvitamin D deficency in ischemic stroke and subtypes in Indian patients[J]. J Stroke, 2014,16:44-50.
11 Akin F, Ayca B, Kose N, et al. Serum vitamin D levels are independently associated with severity of coronary artery disease[J]. J Investig Med, 2012, 60:869-873.
12 Brondum-Jacobsen P, Nordestqaard BG, Schnohr P, et al. 25-hydroxyvitamin D and symptomatic ischemic stroke:an orginal study and meta-analysis[J]. Ann Neurol, 2013, 73:38-47.
13 Michos ED, Gottesman RF. Vitamin D for the prevention of stroke incidence and disability:promising but too early for prime[J]. Eur J Neurol, 2013, 20:3-4.
14 Kienreich K, Grubler M, Tomaschitz A, et al. Vitamin D, arterial hypertension & cerebrovascular disease[J].Indian J Med Res, 2013, 137:669-679.
15 Lu L, Yu Z, Pan A, et al. Plasma 25-hydroxyvitamin D concentration and metabolic syndrome among middleage and elderly Chinese individuals[J]. Diabetes Care,2009, 32:1278-1283.
16 Federico C, Francois M, Nicolas V, et al. Potential pathophysiological role for the vitamin D deficiency in essential hypertension[J]. World J Cardiol, 2014,6:260-276.
17 Shaban LH, Zarini GG, Exebio JC, et al. Serum vitamin D insufficiency and diabetes status in three ethnic minority groups[J]. J Immigr Minor Health,2012, 14:926-932.
18 Vacek JL, Vanga SR, Good M, et al. Vitamin D deficiency and supplementation and relation to cardiovascular health[J]. Am J Cardiol, 2012, 109:359-363.
19 Janssens W, Lehouck A, Carremans C, et al. Vitamin D beyond bones in chronic obstructive pulmonary disease:time to act[J]. Am J Respir Crit Care Med,2009, 179:630-636.
