高分化胰腺神经内分泌肿瘤的CT表现及与病理对照分析
2015-01-20敖炜群胡金文曾蒙苏徐良根王培军
敖炜群 胡金文 曾蒙苏 吴 东 孙 静 徐良根 王培军
2 上海市普陀区人民医院放射科
3 复旦大学附属中山医院放射科
4 同济大学附属同济医院放射科
胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumors,PNETs)少见,约占所有胰腺肿瘤的1%~2%,由于其发病率低、临床表现多样容易误诊。研究[1]显示约50%的神经内分泌肿瘤患者在确诊时就已经是局部晚期或出现转移,因此早期诊断和治疗是提高疗效、改善预后的关键。近年来胰腺神经内分泌肿瘤的影像表现有一些报道[2-4],但对于高分化胰腺神经内分泌肿瘤的CT特征研究较少。本文回顾性分析经病理证实有完整资料的18例高分化胰腺神经内分泌肿瘤病例,分析其CT征象,以期提高对该病的术前诊断水平及分期。
方 法
1.一般资料
搜集从2008年1月至2013年9月共18例经手术病理证实为高分化胰腺神经内分泌肿瘤(2010年WHO分类:病理分期为G1期,核分裂象≤2/10HPF,Ki-67增殖指数≤2%)的患者资料,其中男性8例,女性10例,年龄18~75岁,平均53.3±16.6岁。6例因无诱因中上腹持续疼痛或不适就诊,4例无症状偶然体检发现,8例有反复发作低血糖病史,口服糖块后迅速缓解。所有患者甲胎蛋白(AFP)、癌胚抗原(CEA)和糖类抗原(Ca19-9)均为正常范围。
2.影像学检查及设备参数
18例患者均行CT增强检查,采用Siemens Emotion 16层螺旋CT和Siemens Definition AS 128层螺旋CT扫描,扫描参数:管电压120~130kV,管电流160~200mAs,螺距0.8:1,重建层厚5mm。行上腹部扫描,扫描范围自膈顶至肾脏下极,扫描分三期,为平扫、动脉期和门脉期,对比剂为碘佛醇(320mg I/ml)80~100ml,速率3.0ml/s,手背静脉穿刺建立注药通道,注入对比剂后,靶血管达到100HU后自动触发扫描获得动脉期图像,之后延迟约30~35s进行门脉期扫描。
3.影像及病理分析
图像由两名经验丰富影像医师独立阅片,对18例患者的CT资料进行综合分析,评价肿瘤形态、大小、位置、有无包膜、囊变或坏死、有无胰管扩张、增强后强化幅度及方式、周围血管改变、有无淋巴结肿大及远处组织器官转移等进行分析。动脉期强化程度分为明显强化、中度强化和轻度强化:明显强化为强化程度类似于主动脉强化,中等强化为强化程度类似门静脉期肝脏强化,轻度强化为强化程度低于门脉期肝脏强化[4]。
18例患者均行外科手术治疗,切除的组织送病理诊断。取材肿瘤实质部分行常规HE染色和免疫组化染色。病理分级按2010年WHO制定的GEP-NEN分级标准进行分级。
4.统计学处理
结 果
1.手术及病理结果
18例均为单发病灶,肿块最大直径从0.8~4.9cm不等,平均值为1.8±0.9cm。胰头十二指肠切除7例,部分胰腺切除5例,胰尾脾脏切除6例。肿块切除标本11个为灰红色肿块,7个为灰黄白肿块,肿块质软、有包膜境界清楚。12个肿块为实性;6个肿块为囊实性,其中3个肿块囊变,2个肿块内出血坏死,1个病灶内为凝固性坏死组织,边缘见反应增生的纤维组织。9例证实为胰岛素瘤,1例为胰高血糖素瘤,1例为舒血管肠肽瘤,1例为类癌,6例无内分泌异常。免疫组织化学显示触突素(Syn)、嗜铬蛋白颗粒A(CgA)、神经元特异性烯醇化酶(NSE)、CD56为阳性染色(表1)。
2.病灶位置、大小和数目
CT发现18个病灶,与手术病理一致,7例发生于胰头部(38.9%),4例发生于胰颈部(22.2%),1例发生于胰体部(5.6%),6例发生于胰尾部(33.3%),本组病例肿瘤好发于胰头部和胰尾部。≤2cm病灶14个(77.8%),>2cm病灶4个(22.2%)。
3.CT表现
18例病人(18个病灶)均行三期CT增强扫描(平扫+动脉期+门脉期),18个病灶均有完整的包膜、边界清楚;实性肿瘤12个,平扫6个为低密度,2个为等密度,4个为稍高密度,增强后动脉期明显强化(图1),门脉期4个持续强化,7个门脉期强化程度减低,仍高于胰腺实质(图2),1个为等密度。囊实性肿瘤6个(3个实性为主,3个囊性为主),平扫为1个为等密度,5个为低密度,3个病灶增强后不均匀强化,1个病灶增强后分隔不均匀强化(图3),1个囊性为主型病灶环形强化,囊变区无强化(图4),1个病灶薄壁明显环形强化(图5)。2个病灶内见钙化灶,1个病灶胰管轻度扩张,所有病例均未见胰周浸润、无腹膜后肿大淋巴结及远处转移(表2)。CT值的比较见表3(图6)。
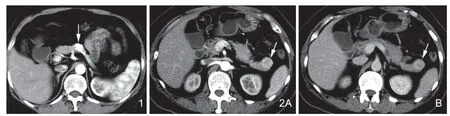
图1 男,65岁,胰体部胰岛素瘤。增强后动脉期肿瘤显著强化(白箭),边界清楚。图2 女,58岁,胰尾胰岛素瘤。A.增强后动脉期胰尾见一高密度结节(白箭),不均匀强化,边界清楚,胰管无扩张,对临近结构无侵犯;B.门脉期病灶强化程度减低,仍高于胰腺实质(白箭)。
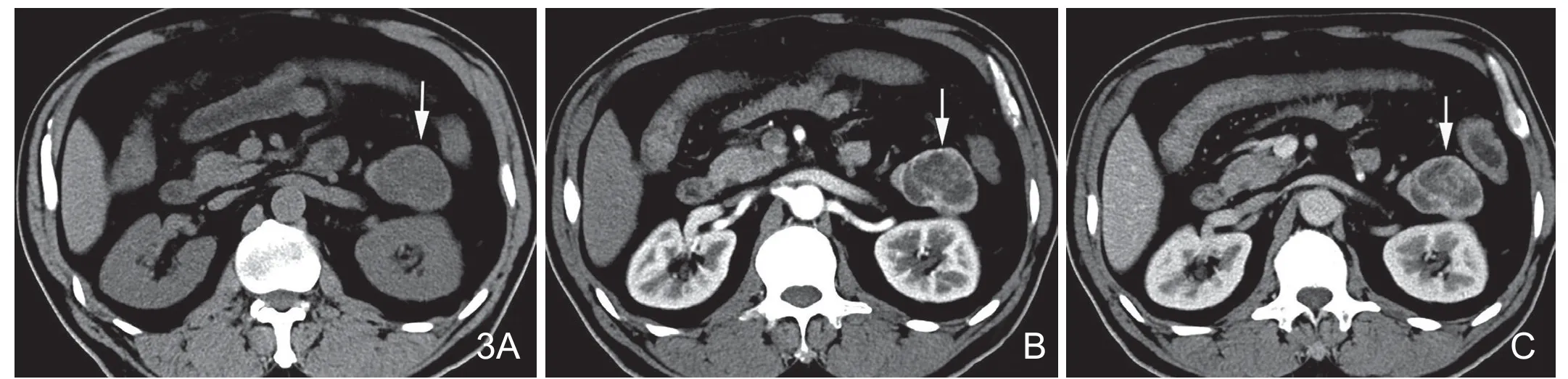
图3 男,65岁,胰尾胰岛素瘤。A.胰尾见大小约4.9cm×4.1cm囊实性肿块(白箭),平扫为低密度,边界清楚;B.增强后动脉期肿瘤强化不均匀,壁及分隔明显强化(白箭);C.门脉期囊实性肿块持续不均匀强化,为高低混杂密度(白箭),病理证实病灶内部有出血坏死。
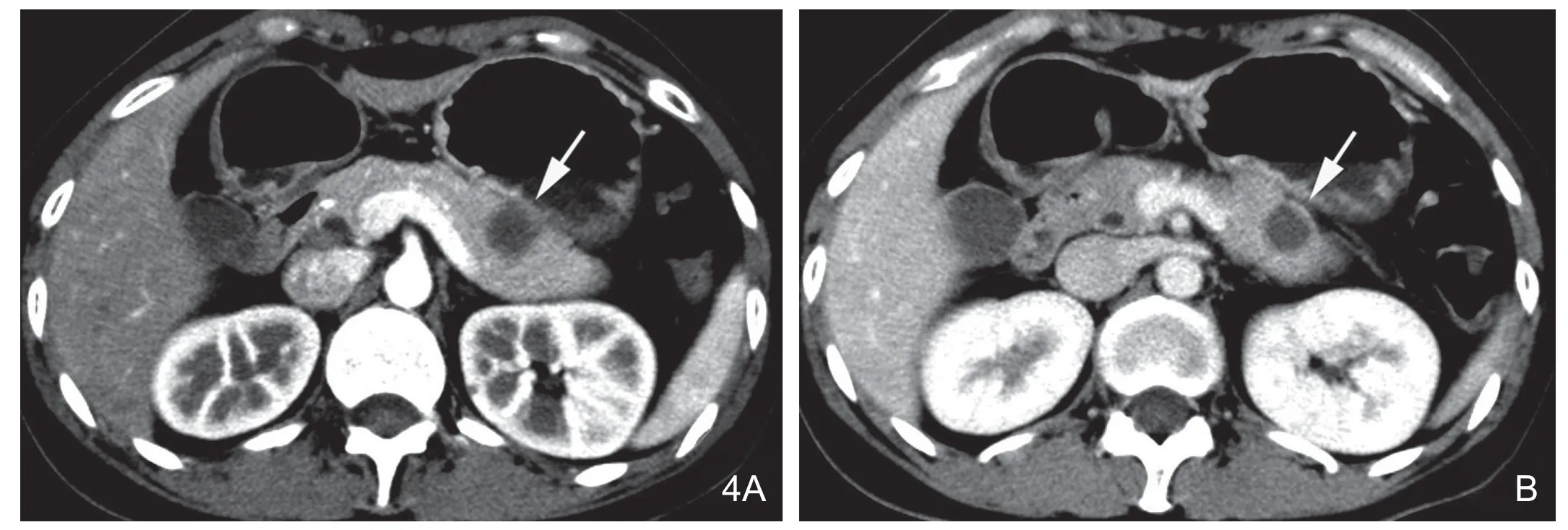
图4 女,32岁,胰体尾部类癌。A.增强后动脉期病灶边缘轻度环形强化,病灶内部未见强化为明显低密度,与胰腺实质分界清楚(白箭);B.门脉期病灶仍为低密度(白箭),病理证实病灶内部为凝固性坏死组织伴边缘反应增生纤维组织。
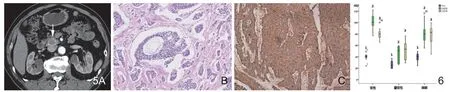
图5 男,75岁,胰头胰高血糖素瘤。A.增强后动脉期肿瘤薄壁明显环形强化,病灶内部轻度强化;B.肿瘤细胞呈巢状排列,圆形或卵圆形的细胞核浓染(HE×200);C.免疫组化检查CgA为阳性染色(HE×20)。图6 实性、囊实性肿瘤和正常胰腺实质各期CT值比较(1-平扫,2-动脉期,3-门脉期)。
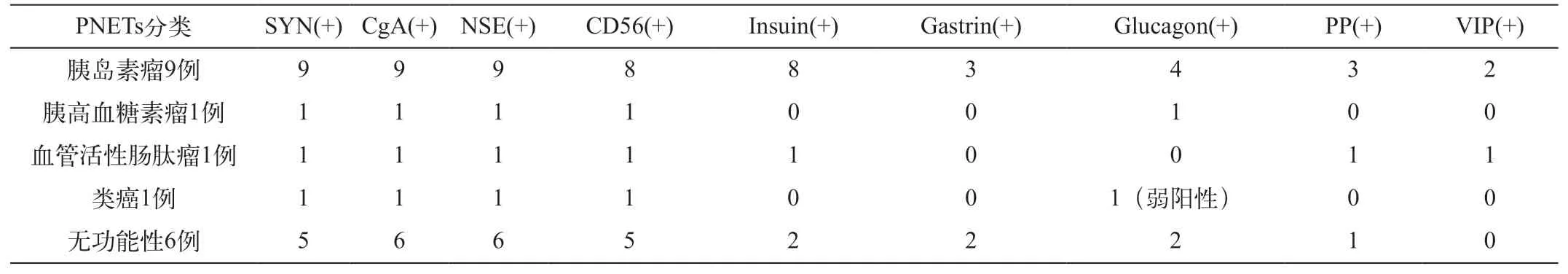
表1 高分化PNETs免疫组化(例)

表2 实性和囊实性PNETs动脉期强化形式的比较
表3 实性、囊实性肿瘤和正常胰腺实质平均CT值的比较(±s)
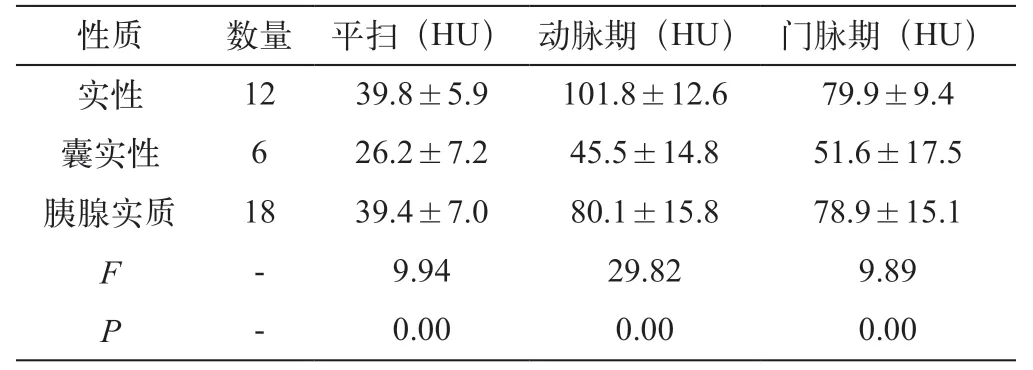
表3 实性、囊实性肿瘤和正常胰腺实质平均CT值的比较(±s)
*三期扫描实性、囊实性肿瘤和正常胰腺实质CT值差异有显著统计学意义(P<0.01)。
讨 论
1.高分化PNETs的临床与病理学特征
PNETs少见,为潜在恶性肿瘤,起源于胰腺多能神经内分泌干细胞的一类肿瘤,属于胃肠胰神经内分泌肿瘤之一。2000年WHO将胰腺神经内分泌肿瘤分为3类:高分化神经内分泌肿瘤、高分化神经内分泌癌、低分化神经内分泌癌。2010年WHO根据核分裂像和Ki-67增殖指数分为3类[5]:①神经内分泌肿瘤(含类癌),低度恶性(G1),核分裂象<2个/10HPF,Ki-67增殖指数<3%。②神经内分泌肿瘤,中度恶性(G2),核分裂象为2~20个/10HPF,或Ki-67增殖指数为3%~20%。③小细胞或大细胞神经内分泌癌,高度恶性(G3)核分裂象>20个/10HPF,或Ki-67增殖指数>20%。Ki-67阳性指数决定胰腺神经内分泌肿瘤的增殖活性,分化好的PNETs Ki-67阳性指数为1~5%,更高的指数提示为低分化胰腺神经内分泌肿瘤或神经内分泌癌,该分类与预后密切相关。
PNETs发病年龄广泛,儿童罕见,高峰年龄是40~60岁[6],无性别差异,与本组资料相仿。PNETs分为无功能性神经内分泌肿瘤和功能性神经内分泌肿瘤,其中功能性胰腺神经内分泌肿瘤包括:胰岛素瘤、胃泌素瘤、胰高血糖素瘤、血管活性肠肽瘤、生长抑素瘤、胰多肽瘤、神经降压素瘤、胰腺类癌等。因其类型多种多样,早期PNETs临床表现具有多样性、延迟性,甚至无临床症状,如偶然的稀便、间断的面部潮红或间歇性的腹痛,常被误诊为胃肠炎或应激性肠道疾病等其他问题而未引起重视,这可能是PNETs间断分泌生物活性产物导致患者症状的间歇性出现。所以,大多数的PNETs患者发现较晚,已经出现局部扩散和(或)远处转移,而这时根治性手术已经不可能[7],因此诊断早期PNETs有重要意义。
高分化PNETs组织学多由相对一致的立方细胞组成,胞质嗜酸性,细颗粒状,核圆形或卵圆形,位于中心,常有显著的核仁,核分裂象罕见;可见缎带样,脑回状和腺体结构在内的小梁状结构,以及实性髓样结构;在同一个肿瘤内可以出现混合形态,小梁状肿瘤核有极性,而伴有实性生长方式的肿瘤则没有。肿瘤边缘可见诸如胰岛和导管等正常胰腺成分陷入肿瘤组织[6],提示肿瘤分化良好。免疫组化显示Syn、CgA、CD56、NSE为阳性染色,这是特异性较高的神经内分泌标记物,对该病的诊断有很高的价值。
2.高分化PNETs的CT检查特点和表现及病理学基础
CT检查对高分化PNETs检出有重要意义,CT检查具有简单、可重复性和稳定性强等特点,特别是多排螺旋CT扫描速度快,能够克服部分容积效应和消除呼吸运动伪影等,有利于发现小的肿瘤(<2cm),CT扫描能很好地显示肿瘤的生长方式,确定肿瘤的发生部位,清楚显示肿瘤的形态、大小、范围及肿瘤内部的钙化、坏死、囊变、出血等情况,增强后的强化幅度及方式能明确与周围组织器官的关系,周围血管改变、有无区域淋巴结肿大、远处组织器官转移等情况,对肿瘤的定位、定性作出评估。增强CT动脉期、门脉期扫描结合螺旋CT血管造影,对PNETs的分期和手术可切除性判断准确性十分理想[8]。
结合本组病例及复习文献高分化PNETs影像学表现具有以下特征:①大小、形态和位置:肿瘤多≤2cm为实性或囊实性,好发于胰头、胰尾部,圆形或卵圆形,形态规则,边缘光滑,有完整的包膜;囊实性肿瘤的囊壁或分隔规则、厚度较均匀。②CT平扫:多为等或稍低密度,病灶内出现囊变或坏死时CT表现为更低密度。③增强扫描:实性肿瘤病理血供丰富,大多数病灶动脉期强化显著,门脉期增强程度下降,但仍高于胰腺实质[8]。囊实性肿瘤强化方式变化较大,实性为主时肿瘤增强后表现为明显不均匀强化。囊性比例大或以囊性为主时,动脉期病灶分隔明显强化或包膜环形强化,病灶主体轻或中度不均匀强化,完全囊变或坏死区无强化,门脉期病灶主体持续强化或增强程度下降,总体强化程度远低于实性肿瘤,甚至低于胰腺实质为低密度。④继发改变:肿瘤与邻近结构分界清楚,对周边组织及血管无浸润,远端胰管无明显扩张,胰管壁显示光滑,无肿大淋巴结及周边脏器转移。本组病例实性肿瘤占66.7%,囊实性占33.3%,实性肿瘤和囊实性肿瘤强化形成差异有统计学意义(P<0.05),实性肿瘤强化要显著高于囊实性肿瘤。12例实性肿瘤病理血供丰富,增强后强化明显。6例囊实性肿瘤强化方式变化多样,当囊性比例增多或以囊性为主时,肿瘤不均匀强化,强化程度较实性肿瘤减低,甚至为低密度。1例病灶囊性成分较多,动态增强后不均匀分隔样强化,病理证实为病灶内部有出血坏死;1例病灶囊性为主,增强后轻度环形强化,囊变区无强化,病理证实为凝固性坏死组织伴边缘纤维组织反应增生。
Grözinger等[9]用64层螺旋CT灌注扫描发现,相对于胰腺实质PNETs有更高的血流量和血容量,肝脏转移病灶和PNETs有相同血供特点。肿瘤的血流量取决于肿瘤的毛细血管分布和组织学分级,高分化PNETs(WHO I级)的血流量要显著高于中低分化肿瘤。周延等[10]对20例病人行双期增强CT扫描,结果表明高分化PNETs较中、低分化肿瘤病理血供更为丰富,分化越差、病理分级越高的肿瘤血供可能越差,影像所见其强化程度越低,即CT双期增强扫描高分化PNETs强化程度高于中、低分化肿瘤。中、低分化PNETs肿块常>2cm,>5cm亦常见,肿瘤多呈分叶状团块或结节,边界多不清楚,内密度欠均匀,坏死、钙化常见,囊实性肿瘤内壁及分隔往往不规整、厚薄不一,壁结节多见;胰管及周边胰腺实质常受累及,位于胰头部的肿瘤常引起胰管扩张,肿瘤对周围组织有不同程度的侵犯,肝脏及胰腺被膜转移多见,腹膜后肿大淋巴结常见,这与肿瘤的恶性倾向相吻合,而高分化PNETs这些征象罕见。本组实性肿瘤及囊实性肿瘤的实性部分、肿瘤壁及分隔均有明显强化,笔者认为肿瘤囊壁及分隔均匀、规则及增强后分隔强化和薄壁环形强化对诊断高分化囊实性PNETs有一定特征性,这与病理所见囊实性肿瘤中实性部分的血供丰富和纤维构成有关系。
本组病例实性、囊实性肿瘤和正常胰腺实质的三期扫描平均CT值差异有统计学意义。囊实性肿瘤的CT平扫及增强后扫描的CT平均值低于正常胰腺实质和实性肿瘤,以动脉期差异最为明显(P<0.01),较实性肿瘤与正常胰腺实质强化差值分别为56.3HU和34.6HU,这与本组部分病例囊实性肿瘤含囊性成分较多有关。门脉期实性、囊实性肿瘤和胰腺实质平均CT值差值较动脉期减少。
3.影像学误诊分析
由于高分化PNETs临床表现多样,对其缺乏足够的认识,且大多肿瘤无明显异常激素分泌的临床症状,而使诊断相对较难。本组病例13例结合影像学表现及临床资料考虑为PNETs,5例误诊。误诊病例中多数因肿瘤含囊性成分较多,影像学上以囊性为主病灶和囊性病灶的强化特征不典型,造成误诊。本组2例病灶为胰尾囊实性占位,增强后动脉期不均匀分隔样强化,门脉期持续强化,增强后与胰腺实性-假乳头状瘤的特征类似,造成误诊;2例为胰尾和胰头类圆形囊性低密度病灶,增强后薄壁环形强化,中央为囊性低密度区,误诊为囊腺瘤;1例位于胰颈部,动脉期为略低密度,门脉期为等密度,内见小囊状低密度似与胰管相通,与胰腺导管内乳头状黏液瘤混淆造成误诊。故高分化PNETs要与上述疾病鉴别。
4.鉴别诊断
①胰腺神经内分泌癌:中老年男性居多,好发于胰头,大部分病人可有类癌综合症的临床表现,肿块常>2cm,增强后病灶呈中度或明显强化,对周围组织有不同程度的侵犯,肝脏及胰腺被膜转移多见,腹膜后肿大淋巴结常见,而高分化PNETs多无对临近组织侵犯及转移征象。②胰腺囊腺瘤:好发于老年女性,囊壁常厚薄不均,可见壁结节,多成分房状改变,与囊实性PNETs不易鉴别,但增强后其强化程度低于PNETs;③胰腺实性-假乳头状瘤:多为囊实性肿块,有完整包膜,可见钙化,增强扫描动脉期实质部分中等强化,门静脉期呈渐进性强化;部分病灶囊实性相间分布,增强后呈特征性的“浮云征”强化[11],可作鉴别诊断;④胰腺导管内乳头状黏液性肿瘤:好发于老年男性,病变呈分叶状通常由单个或多个囊性低密度占位组成,可伴有主胰管或分支胰管扩张,有厚的分隔及壁结节为其特征性表现,MRCP可清晰地显示病变与胰管相通。
综上所述,高分化PNETs的CT表现多为单发、≤2cm、形态规则、包膜完整、无明显壁结节形成、对临近组织多无侵犯的实性或囊实性肿块,增强后实性肿瘤明显强化;囊实性肿瘤中囊变或囊实性混合部分轻中度强化,囊壁及分隔规则、均匀,其分隔或薄壁环形强化对诊断囊实性高分化PNETs有一定特征性,CT在术前诊断中发挥重要作用,对判断肿瘤分期有较大的帮助。因此,提高该病的影像学特点认识有助于其术前诊断及分期。
[1]Reidy DL,Tang LH,et al.Treatment of advanced disease in patients with well-differentiated neuroendocrine tumors.Nat Clin Pratt Oncol,2009,6:143-152.
[2]Kawamoto S,Johnson PT,Shi C,et al.Pancreatic neuroendocrinetumor with cystlike changes:evaluation with MDCT.AJR,2013,200:283-290.
[3]Gallotti A,Johnston RP,Bonaffini PA,et al.Incidental neuroendocrine tumors of the pancreas:MDCT findings and features of malignancy.AJR,2013,200:355-362.
[4]张 蓓,汪登斌,宋 琦,等.胰腺无功能性内分泌肿瘤的螺旋CT诊断与鉴别诊断.中国医学计算机成像杂志,2006,12:179-183.
[5]Bosman F,Carneiro F,Hruban R,et al.WHO classification of tumors of the digestive system.Lyon:IARC Press,2010:100-155.
[6]Hamilton SR,Alatonon LA著,虞积耀,崔全才译.消化系统肿瘤病理学和遗传学/WHO世界卫生组织肿瘤分类及诊断标准.北京,人民卫生出版社,2006:1125-1127.
[7]徐建明.重视对胃肠胰腺神经内分泌肿瘤的认识.中华肿瘤杂志,2012,34:158-160.
[8]周康荣,严福华,曾蒙苏.腹部CT诊断学.上海:复旦大学出版社,2011:349-375.
[9]Grözinger G,Grözinger A,Horger M.The role of volume perfusion CT in the diagnosis of pathologies of the pancreas.Rofo,2014,186:1082-1093.
[10]周 延,刘剑羽,朱 翔.胰腺神经内分泌肿瘤多层螺旋CT双期增强扫描特征.中华放射学杂志,2013,47:225-230.
[11]金国峰,陈克敏,张宝元.胰腺实性-假乳头状瘤的多层螺旋CT诊断.中国医学计算机成像杂志,2012,18:133-138.
