饲用蛋白酶体外评价方法的建立
2015-01-19高爱琴梁争文邹林源张铁鹰
■白 燕 高爱琴 梁争文 邹林源 张铁鹰
(1.内蒙古农业大学动物科学院,内蒙古呼和浩特 010000;2.中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室,北京 100193)
饲用酶制剂在畜禽饲粮中的应用十分普遍,产品 种类较多,如何科学、快捷的对饲用酶制剂产品进行筛选和评价愈显重要。近年来,单胃动物的体外消化模拟技术在饲料营养价值的评价方面已得到广泛应用,其能否直接用于评价酶制剂尚存争议。大多体外消化模拟方法各消化参数确定以饲料养分体外消化率为参照,黄瑞林等、刘雨田等将体外养分消化率达到最大时的参数作为体外消化方法的最适参数,Bedford等以食糜黏度降低幅度达到最大时的参数作为最适参数。虽然这两种确定最佳消化参数的方法较为简便,但用于评价饲用酶制剂尚存不足。首先,畜禽对饲料的消化是一个动态过程,饲料养分消化率受饲料类型、畜禽日龄阶段和环境等多种因素的影响。同时,饲用酶制剂作为一种蛋白类催化剂,其活性也易受消化道内环境条件(pH值和金属离子)的影响。因此,如何科学获得动物真实的消化道内环境参数是体外评价饲用酶的关键。通过屠宰试验动物可直接得到畜禽消化道参数。张铁鹰通过屠宰不同日龄肉仔鸡得到肉仔鸡日龄与消化酶水平、消化时间、pH值、胆汁水平之间的关系,由此可以确定任意日龄肉仔鸡的体外消化法中的参数水平。王宁娟、郑卫宽、梅学文等同样根据测定试验畜禽消化道真实参数,确定体外消化法中的参数,通过该方法所得参数更接近待研究畜禽在特定日龄和生长阶段消化道的真实情况。
目前,利用体外法评价饲用酶制剂,其种类主要集中在植酸酶和非淀粉多糖酶等,且检测指标主要以磷、还原糖、总能及营养物质的消化率为主,而针对评价蛋白酶制剂的研究相对较少。另外,简单、快捷也是衡量体外评价方法实用性的一个重要方面。现有体外方法中消化产物分离方式主要有透析、过滤和真空抽滤,这些产物分离方法均需花费较长时间,每批次评价样品数量较有限。离心处理的方式可以方便、快捷的同时处理多个样品,而该法目前在运用时操作较为随意,有直接离心处理样品,有加三氯乙酸处理,也有加磺基水杨酸处理消化产物,究竟哪种处理方式更适合于蛋白酶的评价还未见报道。此外,体外消化体系中抗生素的应用也较随意,究竟是否需要使用抗生素来抑制微生物的生长还需要研究证实。因此,本文将以31日龄肉仔鸡消化道内参数(水分、pH值和消化酶)实际测定值为基础,并通过对体外消化法相关参数进行优化,旨在建立一套适合于评价蛋白酶制剂在肉仔鸡作用效果的准确、快捷的一套体外评价方法,为简单快速评价饲用蛋白酶制剂提供方法。
1 材料与方法
1.1 试验动物及日粮
采用单因子随机区组试验设计。选用240只1日龄艾维茵商品肉仔鸡公雏,随机分为4组,每组6个重复,每个重复10只鸡。采用3层笼养,自由采食和饮水,饲养管理和免疫程序按常规程序进行。饲粮参照美国NRC(1994)营养需要配制的粉状配合饲粮,基础日粮组成及营养水平见表1。

表1 基础日粮组成和营养水平(风干基础)
1.2 试验方法
1.2.1 样品采集及pH值的测定
各重复试鸡在自由采食和饮水的条件下,于31日龄09:00 、12:00、15:00、18:00分4个时间点,每个时间点从每个重复中随机抓取2只,麻醉,打开腹腔,取嗉囊、肌胃与腺胃、十二指肠内的全部食糜,空肠、回肠中间段食糜,将食糜样品混匀后,用pH计测定各段pH值后,迅速放入-20℃冰箱中保存,备用。
1.2.2 消化酶水平的测定
将不同消化道部位的各个时间段食糜解冻后,分别充分混匀,准确称取15 g(精确至0.000 1 g),按1∶1的比例加入去离子水,置于冰浴中匀浆,转速6 000 r/min,匀浆15 s,每隔15 s匀浆1次。匀浆后的食糜在4℃、6 000 r/min的条件下离心10 min。取上清液,分别测定胃蛋白酶、胰蛋白酶、糜蛋白酶、淀粉酶活性。
胃蛋白酶活定义:1个胃蛋白酶单位(PE)相当于在规定条件下用以下速度分解血红蛋白时所需的酶量:每分钟生产可溶于三氯乙酸溶于的分解物在佛氏指示剂作用下所产生的吸光度与1 mmol酪氨酸所产生的吸光度相等。
胰蛋白酶活定义:在pH值为7.8,温度为40℃下,每分钟分解底物产生0.1μmol对硝基苯胺为1个胰蛋白酶和糜蛋白酶活力单位。
淀粉酶活定义:1个α-淀粉酶单位相当于在40℃和pH值6.9的条件下,从可溶性淀粉中释放出1 mmol还原物质(以麦芽糖计算)时所需酶量。
1.2.3 食糜含水量的测定
肉仔鸡各段消化道食糜含水量的测定,采用GB/T 6435-2006。鉴于肉仔鸡消化道内食糜实际含水量不利于在体外将消化酶与饲料混合均匀,进而影响体外养分消化率。特别是小肠段的含水量尤为重要。水分含量过低时,会出现随消化产物积累抑制饲料养分酶解进程。通过对小肠段食糜含水量(89%、91%、93%、95%和97%)对粗蛋白体外消化率影响的研究,确定小肠段食糜最适含水量。
1.2.4 体外消化法中样品重量、粒度与食糜停留时间的确定
体外消化法评价饲用酶制剂时,样品重量为1 g、粉碎粒度为过60目筛。31日龄肉仔鸡食糜,嗉囊、胃和肠阶段内停留时间分别为50、61、163 min。
1.2.5 消化产物分离方式的优化
鉴于体外消化法中透析、过滤和抽滤等产物分离方法存在的不足,并针对评价蛋白酶这一特殊的饲料添加剂,本研究将分别就直接离心、三氯乙酸或磺基水杨酸沉淀处理后再离心的消化产物分离方式,对粗蛋白体外消化率的影响进行研究,试验分别用豆粕和玉米做底物,根据体外消化率变异情况确定适宜的产物分离方法。
体外消化结束后,经过3种产物分离方式,具体操作为:直接8 000 r/min离心处理10 min后测定粗蛋白体外消化率;加5 ml三氯乙酸(20%)沉淀蛋白,静置10 min,8 000 r/min离心处理10 min后测定;加5 ml磺基水杨酸(20%)沉淀蛋白后,静置30 min,同样8 000 r/min离心处理10 min后测定粗蛋白体外消化率。
1.2.6 抗生素使用的确定
体外消化法建立时,不少学者为了防止微生物的生长,会在消化体系加一定量的抗生素,如Saunders等;Liu等;Simbaya;Stein等,但有些学者并没有使用抗生素,如李伟;Narasimha等;刘东霞等。为了研究本体外法是否需要加抗生素,本试验将在实际消化时间(163 min)的基础上以2 h为间隔延长肠段消化时间,消化结束后,用磺基水杨酸沉淀蛋白,离心取上清液,通过平板菌落计数法研究体外法中微生物的生长情况。
1.3 数据处理
试验数据采用SAS 9.1.3统计软件中的ANOVA过程进行单因子方差分析。
2 结果与分析
2.1 31日龄肉仔鸡消化道各段pH值(见表2)

表2 31日龄肉仔鸡消化道各段pH值
表2可见,体外消化法的嗉囊、胃和小肠阶段pH值水平可以分别设定为:4.91、3.37、6.20。
2.2 31日龄肉仔鸡消化道食糜中各消化酶水平的测定

表3 31日龄肉仔鸡消化道中的各酶活水平
由表3可见,31日龄肉仔鸡肌胃和腺胃内胃蛋白酶水平为0.56 U/g食糜鲜重;十二指肠、空肠和回肠中胰蛋白酶分别为0.31、10.21、9.81 U/g食糜鲜重,糜蛋白酶分别为0.065、0.76、0.34 U/g食糜鲜重,淀粉酶活性分别为 971.86、2 381.36、1 041.28 U/g食糜鲜重。空肠胰蛋白酶活性较回肠高(P>0.05),极显著高于十二指肠(P<0.01)。糜蛋白酶和淀粉酶活性均是空肠内最高(P<0.05)。
2.3 31日龄肉仔鸡消化道各段食糜含水量的确定

表4 31日龄肉仔鸡嗉囊、胃和肠段食糜的含水量(%)
由表4可见,31日龄肉仔鸡嗉囊、胃(肌胃和腺胃食糜)和空肠食糜含水量分别为62.26%,、67.70%和83.72%。

表5 小肠阶段不同含水量对豆粕粗蛋白体外消化率的影响(%)
由表5可见,粗蛋白体外消化率随肠段含水量的增加而提高,含水量为97%较其它组差异显著(P<0.05),含水量为95%较含水量低的91%、89%组差异显著(P<0.05),含水量为93%组较含水量为89%组差异显著(P<0.05),两组低含水量组间差异不显著(P>0.05)。可见,肠阶段含水量是运用体外法评价酶制剂时需要考虑的一个重要参数。
2.4 消化产物适宜分离方式的确定

表6 不同消化产物分离方式对豆粕粗蛋白体外消化率的影响(%)
由表6可知,直接离心、三氯乙酸或磺基水杨酸沉淀处理后再离心三种产物分离方式对豆粕粗蛋白体外消化率产生一定影响。采用直接离心法豆粕的粗蛋白体外消化率显著高于沉淀后再离心法(P<0.05)。经三氯乙酸和磺基水杨酸沉淀蛋白后,得到的粗蛋白体外消化率二者间无显著差异(P>0.05)。单纯从粗蛋白体外消化率来看,直接离心获得了较高的消化率,变异系数较小,但直接离心法不能将消化液中的全部蛋白都沉淀,使得在溶液中的小分子蛋白不能经离心分离,因此,该法并不科学。磺基水杨酸沉淀后离心法的变异系数较小,说明该方法精确度较高,较适合于评价作用效果较为微弱的饲用酶制剂产品。
三种消化产物分离方式同样对玉米粗蛋白体外消化率有一定影响,见表7。直接离心法得到的粗蛋白体外消化率最高,其次是三氯乙酸沉淀,磺基水杨酸沉淀后得到的体外消化率最低。但三者间差异不显著(P>0.05)。由于玉米自身的蛋白含量较低,体外法评价玉米粗蛋白体外消化率时的称样量相对较少,使得测定结果的变异系数较大。因此,在用体外法评价蛋白酶作用效果时,不适合用玉米做底物。

表7 不同消化产物分离方式对玉米粗蛋白体外消化率的影响
2.5 体外消化食糜中的总菌数观测(见表8)
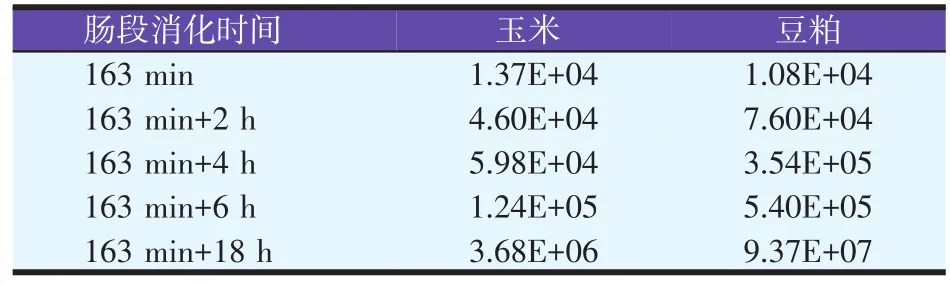
表8 肠段不同消化时间消化液中总菌数目(个/ml)
根据表8试验结果显示,体外消化时消化液中总菌数随着消化时间的升高而增加。肠段消化时间为31日龄肉仔鸡实际消化时间163 min时,玉米和豆粕消化液中的菌数以高达1.37E+04个/ml和1.08E+04个/ml,随着消化时间的延长,菌落数目迅速增多,当消化时间约20 h时,菌落数目已达到3.68E+06个/ml和9.37E+07个/ml。由于细菌本身含蛋白质,当菌落数目较多时,会影响对蛋白酶制剂的评价。显然,体外消化时抗生素的运用十分必要。
3 讨论
3.1 消化酶水平对体外消化的影响
31日龄肉仔鸡肌胃和腺胃内胃蛋白酶水平为0.56 U/g食糜鲜重,较张铁鹰的测定值偏低,这可能与试验日粮的不同有关。31日龄肉仔鸡胰蛋白酶、糜蛋白酶和淀粉酶3种酶活性在十二指肠、空肠和回肠均是空肠内最高,这与张铁鹰测定的35日龄肉仔鸡结果相一致。刘雨田测定饲喂玉米-豆粕型和玉米-豆粕-棉粕型饲粮蛋鸡十二指肠和空肠酶活时,胰蛋白酶、糜蛋白酶、淀粉酶活性均是空肠高于十二指肠,仅有玉米-豆粕-棉粕型饲粮的糜蛋白酶水平是十二指肠高于回肠。可见,饲粮类型可能是影响到消化道酶活水平的主要因素之一。由于食糜在十二指肠内的停留时间较短,十二指肠并非食糜营养成分消化吸收的主要场所。鉴于空肠内消化酶活性最高,食糜在其中的停留时间最长,因此,空肠是营养物质消化和吸收的主要场所。在体外消化法中,小肠段的消化参数主要参考空肠的消化参数。因此,本试验将31日龄肉仔鸡体外消化法小肠段胰蛋白酶、糜蛋白酶、淀粉酶活性水平分别采用肉仔鸡空肠的实测值,分别为10.21、0.76和2 381.36 U/g食糜鲜重。
3.2 含水量对体外消化的影响
张铁鹰、梅学文建立的体外消化法中含水量是以所研究对象消化道的实际含水量来确定的。在本试验中测得31日龄肉仔鸡嗉囊和胃内实际含水量均较低(66.1%和67.7%),在体外条件下,食糜无法被完全浸润,且通过恒温振摇无法实现模拟胃肠运动使胃蛋白酶与食糜混合均匀的物理消化过程,进而影响了饲料养分体外消化率。因此,将体外消化法中的嗉囊含水量以恰好能将食糜浸润,并能通过震摇将食糜充分混匀为宜。通过对体外消化不同时间的食糜总好氧菌数的培养发现,微生物繁殖较快,需要添加抗生素抑制微生物生长。综合考虑嗉囊消化期水量为:称取1 g底物,加3.5 ml一定浓度盐酸溶液(调节嗉囊内pH值),再加0.5 ml氯霉素液,最终液体占80%。胃内食糜含水量则以既能满足调节pH值,又可节省胃蛋白酶的用量为原则。具体操作为嗉囊消化期结束后,加0.5 ml一定浓度的盐酸液(调节到胃内pH值),再加0.5 ml盐酸-胃蛋白酶液,最终胃消化期液体占83%。小肠是养分消化和吸收的主要场所,时间较长,消化产物多。为消除消化产物积累对酶促反应的抑制作用,适度增加小肠段含水量。由本试验结果可见,当小肠含水量为97%时,豆粕的粗蛋白消化率最高(P<0.05)。因此,本体外消化的方法小肠段食糜含水量97%为宜。这与侯晓峰、赵锋等建立的方法一致。在胃消化结束后,加1 ml一定浓度的碳酸氢钠液调节空肠段pH,再加26 ml“模拟肠液”,即含有胰蛋白酶、糜蛋白酶和淀粉酶等消化酶的缓冲液,最终小肠消化期液体占97%。
3.3 产物分离方式对体外消化的影响
如何界定已消化蛋白和未消化蛋白是利用体外法评价饲料蛋白质消化率的关键。不同消化产物分离方式,蛋白体外消化率也存在差异。与评价饲料蛋白质消化率相比,评价饲用蛋白酶对体外法方法的精确度和准确度要求会更高,确定科学的产物分离方式是体外法评价饲用蛋白酶的核心。
直接离心法操作简便、快捷,但其仅将大分子蛋白和未消化的残渣沉淀下来,一些未彻底消化小分子蛋白及肽段则无法分离。这往往导致蛋白质体外消化率高于其真实值。本试验中,直接离心法测得豆粕粗蛋白体外消化率为89.2%,已明显高于肉仔鸡对豆粕的实际消化率。这说明直接离心的消化产物分离方式不适宜评价蛋白酶。利用磺基水杨酸和三氯乙酸将消化后食糜沉淀后再离心也是一种常用的消化产物分离方式,但二者沉淀蛋白的分子量不同。本试验结果表明,经磺基水杨酸和三氯乙酸沉淀蛋白后测得豆粕粗蛋白体外消化率无显著差异(P>0.05)。这表明二者均可作为体外消化法测定粗蛋白消化率时的沉淀剂。经多次重复测定发现,磺基水杨酸较三氯乙酸豆粕粗蛋白体外消化率变异系数更小。这说明用磺基水杨酸沉淀蛋白法精确度更高,较为适合于评价较为灵敏的影响因素。因此,本研究所建立的体外消化法采用磺基水杨酸沉淀后再离心的消化产物分离方式。这与Bioson等的方法一致。
4 结论
在张铁鹰和Boisen建立的肉仔鸡和猪体外消化方法的基础上,结合本研究所得研究结果,建立了一套可用评价饲用蛋白酶的肉仔鸡(31日龄)体外消化模拟方法。具体操作如下,嗉囊消化期:准确称取过60目筛的1 g(精确到0.000 1 g)饲料(豆粕等)样品,置于50 ml离心管中,加3.5 ml适宜浓度盐酸溶液,加0.5 ml氯霉素(30 μg/ml),将 pH调至4.91,拧紧盖子,将离心管水平固定于40℃全温振荡培养箱内,保证其无倾斜,并不断振荡(120次/min),5 min后开始计时,消化50 min。胃消化期:取出离心管,冰浴,加入0.5 ml适宜浓度的盐酸溶液,调节pH到3.3,再加入0.5 ml胃蛋白酶盐酸(0.015 M)溶液,盖好瓶盖,混合均匀后(该过程设定15 min加样时间),将离心管固定于40℃的全温振荡培养箱内,不断振荡(120次/min)。放入5 min后开始计时,继续消化61 min。肠消化期:胃消化结束后,加1 ml适宜浓度的NaHCO3溶液调节pH值到6.20,再加入26 ml pH值为6.20的“小肠液”(该过程设定15 min加样时间),摇匀,放回40℃的恒温振荡培养箱内,振荡频率120次/min。5 min后开始计时,消化163 min。消化结束后,加5 ml磺基水杨酸(20%)沉淀蛋白,静置30 min后8 000 r/min离心10 min,取上清液用凯氏定氮法测定蛋白含量,计算粗蛋白体外消化率。
