帕瑞昔布钠联合芬太尼镇痛对胃癌患者术后T 细胞亚群和NK 细胞的免疫保护作用*
2015-01-19温秀连李道兵骆华连
温秀连,李道兵,骆华连
(广东省河源市人民医院,广东 河源 517000)
胃肠道肿瘤通常要进行外科手术治疗,而围术期的手术刺激及术后疼痛常导致一定程度的免疫功能降低,而细胞免疫抑制影响着术后肿瘤转移和扩散[1]。临床术后镇痛以使用阿片类药物为主,但大剂量的阿片类药物会带来较多的不良反应,甚至会发生免疫抑制。联合使用帕瑞昔布镇痛的免疫抑制较轻,能减少阿片类用量,有利于免疫功能的早期恢复[2]。围术期T 淋巴细胞和NK细胞活性可反映患者的免疫功能[3]。为了更有效地指导临床用药,笔者研究了帕瑞昔布钠联合芬太尼镇痛对胃癌患者术后T 细胞亚群和NK 细胞的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2014 年1 月至10 月我院择期行胃癌根治术的患者124 例,其中男74 例,女50 例;美国麻醉医师协会(ASA)病情分级Ⅰ级65 例,Ⅱ级59 例;心电图检查无严重异常,心功能分级Ⅰ~Ⅱ级,无严重心脑血管疾病及肝肾疾病等,既往无麻醉镇痛药耐受或成瘾史,8 h 内未服用其他镇痛药或镇静催眠药。排除标准:急性胃肠出血或急性胃十二指肠溃疡病史;严重肝肾及血液系统功能障碍;充血性心力衰竭(纽约心脏病协会心功能分级2 ~4级);凝血时间异常(国际标准化比值大于1.5);有哮喘病史;术前3 d 使用非甾体类抗炎药和喹诺酮类抗菌药物;对帕瑞昔布钠有过敏史。本研究内容经我院伦理委员会批准,患者或其家属签署知情同意书。将124 例患者随机分为治疗组和对照组,各62例。两组患者的一般资料比较,差异无统计学意义(P >0.05),具有可比性,见表1。

表1 两组患者一般资料比较
1.2 治疗方法
术前准备:所有患者均禁食10 h 以上,禁饮4 h,无术前用药。患者入室后开放一侧上肢静脉,16 G 穿刺输液,给予乳酸钠林格液500 mL(20 ~25 min 滴完),同时行右颈内静脉、左桡动脉穿刺置管并测压。采用迈瑞BENEVEW 监护仪监测心电图(ECG)、中心静脉压(CVP)、平均动脉压(MAP)、心率(HR)、血氧饱和度(SpO2),呼气末二氧化碳分压(PETCO2)。
麻醉方法:麻醉诱导给予咪达唑仑注射液(江苏恩华药业股份有限公司,国药准字H10980025,规格为2 mL ∶10 mg)0.05 mg/kg、舒芬太尼注射液(齐鲁制药有限公司,批号为080504,规格为每支50 μg)0.5 μg/kg、丙泊酚注射液(AstraZeneca 公司,批号为EB704,规格为每支200 mg ∶20 mL)1mg/kg 和维库溴铵注射液(Organon 公司,批号为901120,规格为每支4 mg)0.1 mg/kg,插入气管内导管后行机械通气,术中维持潮气量8 ~10 mL/kg,呼吸频率每分钟10 ~12 次,PETCO230 ~40 mmHg(1 mmHg=0.133 kPa)。术中麻醉维持给予丙泊酚40 ~50 μg/(kg·min),瑞芬太尼(宜昌人福药业有限公司,批号为040401,规格为每支1 mg)0.2 ~0.3 μg/(kg·min),持续泵注,根据术中肌松情况间断推注维库溴铵,每次1 ~2 mg。
镇痛方法:治疗组分别于术前15 min 及术毕缝合皮肤前分别给予帕瑞昔布钠(辉瑞制药有限公司,国药准字J20130044,规格为40 mg)40 mg 稀释于0.9%氯化钠注射液5 mL 静脉注射;对照组于术前15 min 及术毕缝合皮肤前给予0.9%氯化钠注射液5 mL 静脉注射。手术结束开始缝合皮肤时接静脉自控镇痛泵(PCIA),治疗组PCIA 泵内药物为0.8 mg 芬太尼注射液(宜昌人福药业公司,国药准字H42022076,规格为2 mL ∶10 mg)及12 mg昂丹司琼(齐鲁制药有限责任公司,国药准字H10970065,规格为每支4 mg)加入0.9%氯化钠注射液至100 mL,对照组PCIA 泵药物为1.0 mg 芬太尼及昂丹司琼12 mg 加入0.9%氯化钠注射液100 mL。PCIA 泵背景剂量为2 mL/h,单次镇痛剂量为1 mL,锁定时间15 min,镇痛时间48 h。
1.3 观察指标及疗效判定标准[4]
观察并记录术后不同时间点(术后4,8,12,24,48 h)患者疼痛视觉模拟评分(VAS),采用流式细胞荧光分选技术(FACS)流式细胞仪(美国BD 公司)检测术前30 min(T0)、手术开始2 h(T1)、术后24 h(T2)、术后96 h(T3)的T 淋巴细胞亚群(CD3+,CD4+,CD8+)及NK 细胞(CD56+)的水平;记录围术期不良反应发生情况。VAS 评分标准:0 分,无痛;0 ~3 分,轻度疼痛;4 ~6 分,重度疼痛;7 ~10 分,重度疼痛;10 分,剧痛。
1.4 统计学处理
2 结果
结果见表2 至表4。治疗组患者不良发生率明显低于对照组(P <0.05),两组患者发生的不良反应均为轻度,停药后自行缓解,且均未发生呼吸抑制,未影响研究进程。
表2 两组患者术后各时间点VAS 评分比较( ± s,分)
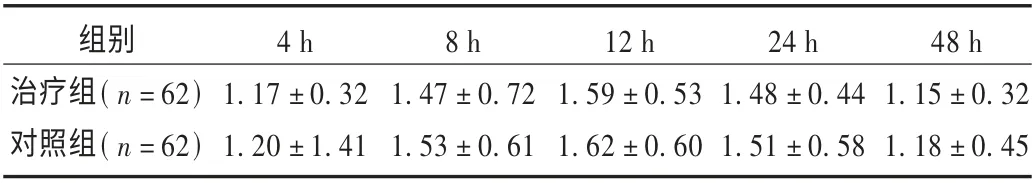
表2 两组患者术后各时间点VAS 评分比较( ± s,分)
组别治疗组( n=62)对照组( n=62)48 h 1.15±0.32 1.18±0.45 4 h 1.17±0.32 1.20±1.41 8 h 1.47±0.72 1.53±0.61 12 h 1.59±0.53 1.62±0.60 24 h 1.48±0.44 1.51±0.58
表3 两组患者T 淋巴细胞亚群及NK 细胞水平比较( ± s,%)

表3 两组患者T 淋巴细胞亚群及NK 细胞水平比较( ± s,%)
注:与对照组同时点相比,#P <0.05;与本组T0 相比,*P <0.05。

表4 两组患者不良反应发生情况比较[例(%)]
3 讨论
围术期的细胞免疫抑制往往是导致术后肿瘤转移和扩散的主要原因[5]。细胞免疫应答主要是T 细胞介导的特异性细胞免疫,因此T 淋巴细胞亚群在机体抗肿瘤的免疫反应中起着重要作用[6]。CD3+代表细胞免疫的总体水平,成熟T 淋巴细胞可分为CD4+和CD8+2 个亚群,CD4+为辅助T 淋巴细胞,可协助B 细胞产生抗体并辅助参与其他细胞的免疫应答,而CD8+T 淋巴细胞则主要起相反的免疫抑制作用,以CD4+/CD8+细胞比值为中心的免疫调节细胞是机体免疫状态的中心环节,CD4+/CD8+降低提示免疫功能低下,是疾病恶化和预后不良的重要标志;NK 细胞是重要的免疫调节细胞,对T 细胞、B 细胞、骨髓干细胞均有调节作用,具有广泛的抗肿瘤作用,其水平下降表示机体免疫功能受到了抑制。
虽然手术创伤和术后疼痛刺激对机体免疫功能的影响不容忽视,但围术期对疼痛的处理也是预防手术导致患者抗肿瘤转移能力下降的关键因素之一[7]。目前,临床术后镇痛以阿片类药物为主,但不良反应很多,包括恶心呕吐、呼吸抑制、尿潴留、肠梗阻、便秘及药物依赖性,故单独使用存在一定局限性[8]。
帕瑞昔布是高选择性环氧合酶-2(COX-2)抑制剂伐地昔布前体的氨基酸化合物,静脉注射后迅速转化成伐地昔布,而伐地昔布可高选择性地抑制COX-2,在发挥镇痛抗炎作用的同时却不会出现如其他非甾体类抗炎药物的严重不良反应。帕瑞昔布钠的超前使用可通过阻止COX-2 的上调来减少手术操作过程中炎症介质的释放,对围术期免疫抑制具有一定的改善作用[9]。帕瑞昔布钠与阿片类药物合用可减少后者的不良反应,并减少其使用剂量。已有研究证实,应用选择性COX-2 抑制剂能有效地抑制胃癌细胞增殖,促进胃癌细胞凋亡[10]。
本研究结果表明,两组患者术后各时间点VAS 评分均较低,镇痛满意,组间无明显差异;两组患者CD3+,CD4+,CD4+/CD8+及NK 细胞(CD56+)水平在手术开始2 h(T1)较术前30 min(T0)下降( P <0.05),且治疗组下降幅度低于对照组;两组CD3+,CD4+,CD4+/CD8+及NK 细胞(CD56+)水平在术后24 h(T2)仍低于T0(P <0.05),但治疗组回升幅度优于对照组( P <0.05);两组患者CD3+,CD4+,CD4+/CD8+及NK 细胞(CD56+)水平术后96 h(T3)仍继续回升,且治疗组回升幅度优于对照组,并接近术前水平(P <0.05);治疗组患者不良反应发生率明显低于对照组(P <0.05)。
综上所述,帕瑞昔布钠联合芬太尼在胃癌患者术后镇痛中镇痛效果可靠,且能减少芬太尼的用量,对T 细胞亚群和NK 细胞具有免疫保护作用,值得临床推广。
[1] 王润洁,胡 红,黄 芳,等. 胃癌患者外周血淋巴细胞免疫功能的变化及临床意义[J]. 临床医学工程,2009,16(9):26 -28.
[2] 季淑娟,黄礼兵,杨 光,等. 帕瑞昔布钠对肿瘤术后T 细胞亚群的影响[J]. 临床麻醉学杂志,2011,27(10):959 -961.
[3] 王忠云,顾海军,金文杰,等. 吗啡和曲马多术后镇痛对胃癌患者T 淋巴细胞亚群及NK 细胞的影响[J]. 临床麻醉学杂志,2007,23(10):800 -802.
[4] 陈忠华,蒋宗明,楼静芝,等. 帕瑞昔布钠超前镇痛对胃癌根治术患者围术期Th1 /Th2 平衡的影响[J]. 中国临床药理学与治疗学,2010,15(6):686 -690.
[5] 刘利利. 外科治疗对胃癌患者抗肿瘤免疫功能及血清细胞因子的影响[D]. 北京:军医进修学院,2011.
[6] 李 明,陈 健,刘国富,等. 胃癌患者外周血T 淋巴细胞亚群的测定及临床意义[J]. 现代肿瘤医学,2004,12(6):534 -535.
[7] Page GG,Blakely WP,Ben-Eliyahu S.Evidence that posto perative pain is a mediator of the tumor-promoting effects of surgery in rats[J].Pain,2001,90(1 -2):191 -199
[8] 吴 跃,裘卫东. 帕瑞昔布钠对胃癌根治术后镇痛与机体应激反应的影响[J]. 医药导报,2009,28(12):1 558 -1 561.
[9] Reuben SS,Bhopathar S,Maciolek H,et al.The preemptive analgesic effort of rofecoxib after ambulatory arthroscopic knee surgery[J]. Analg,2002,94(1):55 -59.
[10] Li JY,Wang XZ,Chen FL,et al.Nimesulide inhibits proliferation via induction of apoptosis and cell cycle srrest in human gastric adenocarcinoma cell line[J].World J Gastroenterol,2003,9(5):915 -920.
