胃癌全胃切除患者围术期两种免疫营养支持治疗的临床比较
2015-01-19谢琦金慧成贾忠居同法单毓强
谢琦 金慧成 贾忠 居同法 单毓强
●临床研究
胃癌全胃切除患者围术期两种免疫营养支持治疗的临床比较
谢琦 金慧成 贾忠 居同法 单毓强
目的 比较胃癌全胃切除患者围术期两种免疫营养支持治疗的效果。方法 将接受全胃切除的胃癌患者随机分为围术期免疫营养(PIN)组60例,术前5d给予肠外免疫营养支持治疗,术后早期给予肠内免疫营养支持治疗1周;术后早期肠内免疫营养(EIN)组60例,仅在术后早期给予肠内免疫营养支持治疗1周。比较两组患者术前及术后第1、7、10天营养指标(总蛋白、白蛋白、前清蛋白、转铁蛋白、氮平衡)、免疫功能指标(IgG、IgA、IgM、CD3+、CD4+、CD4+/CD8+)的情况及术后感染性并发症(包括肺部感染、尿路感染、切口感染)的发生率。结果 PIN组患者术前及术后第1天在提高患者营养指标,纠正免疫功能指标等方面较EIN组有效,差异均有统计学意义(均P<0.05),且PIN组术后感染性并发症的发生率低于EIN组(P<0.05)。结论 胃癌全胃切除患者围术期应用免疫营养支持治疗较单纯术后早期应用,更能改善患者的营养状况,纠正免疫功能,减少术后并发症的发生。
胃癌 全胃切除 免疫营养 围术期
胃癌患者普遍存在不同程度的营养不良及免疫功能的下降[1]。全胃切除手术的创伤打击,进一步加重了患者的营养不良和免疫抑制。有研究证实,术后早期肠内免疫营养对胃癌患者的免疫系统和术后恢复有益[2]。但也有学者认为,按照药理学作用原理,一种物质必须达到一定的组织和血浆浓度才能发挥作用,手术后机体免疫防御机制的损害迅即发生,术后即使早期给予肠内免疫营养,这些营养底物量十分有限,不足以迅速扭转机体的营养状况和免疫功能低下[3-4]。因此,有研究者提出在术前即开始营养支持干预,试图进一步改善消化道肿瘤患者的营养状况和免疫功能。本研究选择行全胃切除手术的胃癌患者进行前瞻性随机对照研究,比较围术期两种免疫营养支持治疗的效果。
1 对象和方法
1.1 对象 纳入标准:(1)术前病理检查明确诊断为胃癌;(2)预计选用全胃切除,食管空肠Rou-en-Y吻合的手术方式;(3)营养风险筛查指数(NRS2002)≥3;(4)同意进入本研究并能配合者。排除标准:(1)有严重心、肺、肝、肾等器官功能障碍者;(2)近期使用干扰研究的激素、蛋白、免疫制剂等药物者;(3)过敏体质或对研究中任何一种成分过敏者。剔除标准:(1)未选用全胃切除的手术方式;(2)不能耐受肠内营养者;(3)未按时检测或失访者;(4)由于发生药物不良反应须停药者。2012年1月至2014年6月共计入组135例,因各种原因剔除15例,实际入组120例。按随机数字表法分为围术期免疫营养(PIN)组60例,术后早期肠内免疫营养(EIN)组60例。两组患者一般资料比较差异均无统计学意义(均P>0.05),见表1。本研究经医院伦理委员会批准,所有入组患者均签署知情同意书。
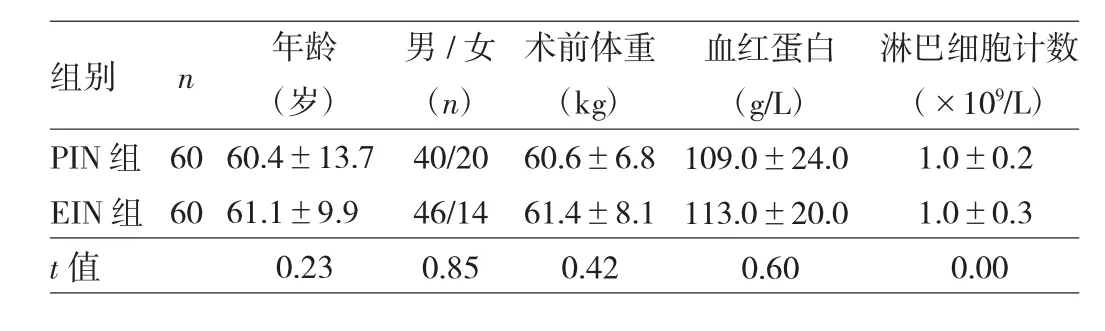
表1 两组患者一般资料比较
1.2 方法 PIN组术前5d通过中心静脉进行肠外免疫营养支持治疗,给予1 440ml的由脂肪乳氨基酸(17)葡萄糖(11%)注射液(卡文)、8.5%复方氨基酸注射液18AAⅡ(乐凡命)、20%脂肪乳注射液(英脱利匹特)、注射用水溶性维生素(水乐维他)、脂溶性维生素注射液维(他利匹特)、多种微量元素注射液(安达美)、甘油磷酸钠注射液(格利福斯)、50%葡萄糖、10%氯化钾、10%氯化钠、谷氨酰胺、ω-3脂肪酸等组成的肠外免疫营养配方支持治疗,按照热量25kcal/kg、氨基酸1.5g/kg、谷氨酰胺20g、ω-3脂肪酸10g,胰岛素用量按胰岛素:葡萄糖=1U∶6g的标准,同时监测血糖及水电解质平衡,术后早期再给予肠内免疫营养支持治疗1周。EIN组仅在术后早期给予肠内免疫营养支持治疗1周。两组患者术后均用肠内营养乳剂TPF-T(瑞能,每100ml含能量130kcal、碳水化合物10.4g、蛋白质5.85g、脂肪7.2g、精氨酸0.23g、ω-3脂肪酸0.3g、核苷酸0.13g、膳食纤维1.3g及各种矿物质、微量元素和维生素,华瑞制药公司)作为肠内免疫营养制剂,均予术中放置鼻肠营养管至最末一个吻合口以远15~20cm的空肠内,用喂食泵控制输注速度和剂量,术后24h起给予肠内免疫营养支持1周。按25kcal/kg计算所需瑞能用量,在每天上午9:00开始输注,并于20h内匀速输注完毕。术后第1天开始自鼻肠营养管灌注全量1/3,第2天灌注全量2/3,第3天起灌注全量直至术后第8天。
1.3 观察指标 观察两组患者术前及术后第1、7、10天营养指标(总蛋白、白蛋白、前清蛋白、转铁蛋白、氮平衡)、免疫功能指标(IgG、IgA、IgM、CD3+、CD4+、CD4+/ CD8+)的情况,观察术后感染性并发症(包括肺部感染、尿路感染、切口感染)的发生率。
1.4 统计学处理 采用SPSS 13.0统计软件,计量资料以表示,组间及组内前比较采用t检验,计数资料组间比较采用χ2检验。
2 结果
2.1 两组患者手术前后营养指标比较 见表2。
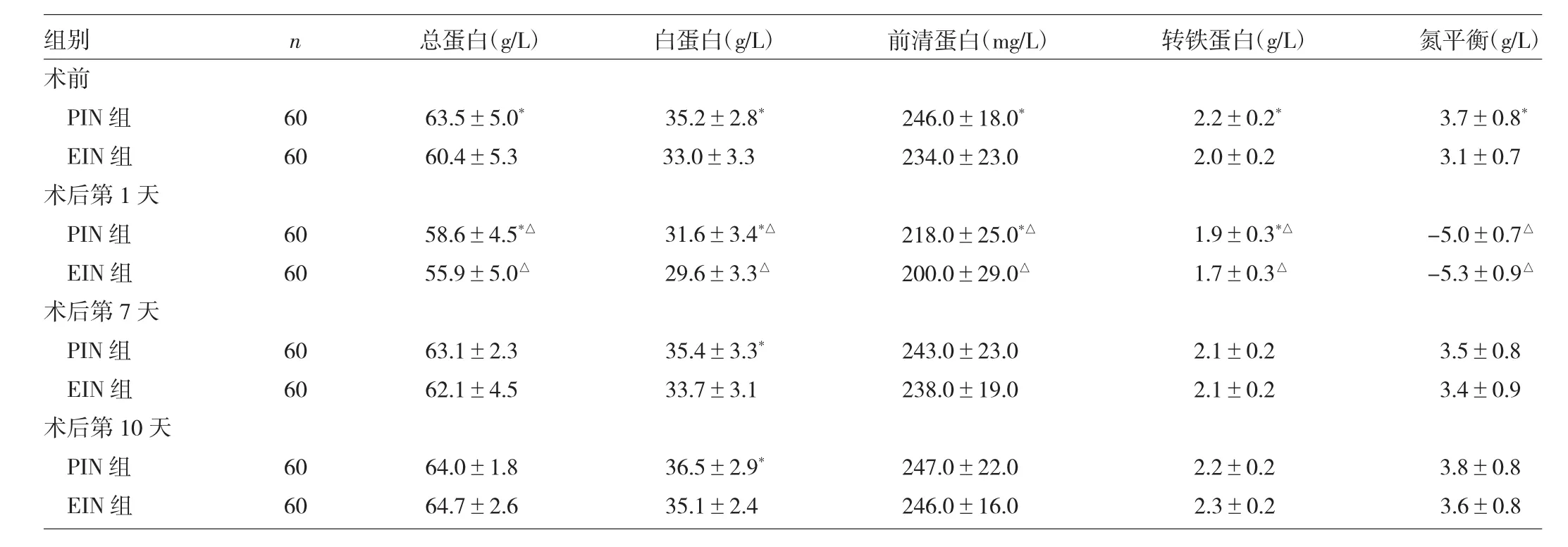
表2 两组患者手术前后营养指标比较
由表2可见,术前经5d的肠外免疫营养治疗后,PIN组各营养指标均高于EIN组(均P<0.05);术后第1天,两组各营养指标均较术前下降(均P<0.05),但PIN组各蛋白指标仍高于EIN组(均P<0.05),而氮平衡指标比较,两组差异无统计学意义(P>0.05);术后第7、10天,除白蛋白外,两组各营养指标差异均无统计学意义(均P>0.05)。
2.2 两组患者手术前后免疫功能指标比较 见表3。

表3 两组患者手术前后免疫功能指标比较
由表3可见,术前经5d的肠外免疫营养后,PIN组各免疫功能指标均高于EIN组(均P<0.05);术后第1天,两组各免疫功能指标均较术前下降(均P<0.05),但PIN组各免疫功能指标仍高于EIN组(均P<0.05);术后第7天,除IgG、CD3+外,两组间各免疫功能指标比较差异无统计学意义(均P>0.05);术后第10天,除IgG外,两组间免疫功能指标比较差异无统计学意义(均P>0.05)。
2.3 两组患者术后感染性并发症发生情况比较 见表4。
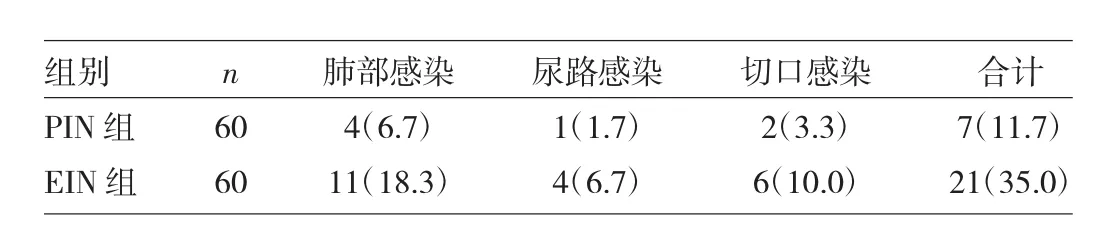
表4 两组患者术后感染性并发症发生情况比较[例(%)]
由表4可见,PIN组术后感染性并发症发生率低于EIN组,差异有统计学意义(P<0.05)。
3 讨论
胃癌全胃切除患者术前多伴有蛋白质、热量缺乏及免疫抑制,部分患者因幽门梗阻不能进食。术前饮食的限制、术中麻醉和手术的影响,又可加重患者的营养不良和免疫抑制。因此,围术期如何合理有效地提供营养支持,尤其对伴有营养不良及免疫抑制的胃癌患者有着积极意义[5]。近年来,有不少学者对胃癌手术患者不论其基础的营养状况如何,在围术期均给予免疫营养[6-7]。常用的免疫营养物质有谷氨酰胺、精氨酸、ω-3多不饱和脂肪酸和核苷酸等。它们不仅提供热量,而且还能调控患者的免疫功能,调节炎症反应,从而降低术后感染性并发症的发生率,缩短术后住院时间。不少学者都主张在术前或术后5~7d给予免疫营养,更有主张在入院前即开始使用免疫营养制剂[8]。
现代医学的发展,提出了加速康复外科理念[9],对术前的营养支持有了新的认识。在胃癌全胃切除的患者中,营养支持是一项重要的措施,涉及到手术创伤的愈合、术后感染性并发症的预防、免疫功能的调控、住院时间的缩短等。但要使围术期营养支持达到预期目的,必须认真了解每一例患者的具体情况,给予个性化的营养支持[10]。本研究针对胃癌需行全胃切除手术的特殊患者,采用肠外营养及肠内营养并用的方式,术前针对其进食困难甚至不能进食的特点采用肠外免疫营养,术后早期利用其肠道功能采用肠内免疫营养。经过术前5d的肠外免疫营养支持治疗,PIN组各营养和免疫功能指标均优于EIN组。术后第1天,两组的营养和免疫功能指标均较术前下降,但除氮平衡指标外,PIN组各营养和免疫功能指标均优于EIN组;且PIN组术后感染性并发症发生率明显低于EIN组,证明仅在术后早期应用肠内免疫营养,不能彻底纠正患者的营养不良及免疫抑制,对改善患者术后感染性并发症的发生作用有限。而术前加用肠外免疫增强营养,并连续使用5d可明显改善胃癌患者术前的营养状态和免疫功能,增强患者抵抗手术打击能力,减少术后感染性并发症的发生,促进患者术后的恢复。
当然本研究的PIN支持治疗也有一定局限性,术前的肠外免疫营养容易耐受,但对某些能正常进食的胃癌患者难以接受,同时需密切关注血糖及水电解质平衡,4次/d监测血糖,随时根据血糖调整胰岛素用量,每2d监测电解质1次。术后EIN支持治疗最常见的问题是腹胀和腹泻,严重者被迫停止肠内营养改用肠外营养而退出研究,本研究中有9例患者因严重的腹胀或腹泻而剔除入组。在今后的研究中应更加注重患者的具体情况,做到个体化的PIN支持治疗。
对行全胃切除术的胃癌患者,围术期联合使用含谷氨酰胺、ω-3多不饱和脂肪酸、精氨酸、核苷酸等免疫营养物质的肠外和肠内营养,可减轻术后创伤和炎性反应,改善机体免疫功能,防止感染性并发症的发生,促进术后恢复,值得临床推广应用。
[1]于康,周晓容,郭亚芳.恶性肿瘤住院患者营养风险和营养不足发生率及营养支持应用状况调查[J].肿瘤学杂志,2011,17(6):408-411.
[2]Shrikhande S V,Shetty G S,Singh K,et al.Is early feeding after major gastrointestinal surgery a fashion or an advance?Evidence-based review of literature[J].J Cancer Res Ther,2009,5 (4):232-239.
[3]Mizock B A,Sriram K.Perioperative immunonutrition[J].Expert Rev Clin Immunol,2011,7(1):1-3.
[4]尹勇,许军,卢麒丞,等.围手术期肠内免疫营养对胃癌病人术后免疫功能预后影响[J].肠外与肠内营养,2008,15(3):221-224.
[5]吴国豪.恶性肿瘤患者营养不良的原因及防治对策[J].中华胃肠外科杂志,2010,13(3):170-172.
[6]Marco B.Perioperative immunitrition and gut function[J].Curt Opin Clin Nutr Metab Care,2012,15(3):485-488.
[7]Cerantola Y,Hubner M,Grass F,et al.Immunonutrition in gastrointestinal surgery[J].Br J Surg,2011,98(11):37-48.
[8]Marik P E,Zaloga G P.Immunonutrition in high-risk surgical patients:a systematic review and an alysis of the literature[J].JPEN, 2010,34(7):378-386.
[9]Gustafsson U O,Scott M J,Schwenk W,et al.Guidelines for perioperative care in elective colonic surgery:Enhanced Recovery After Surgery (ERAS)Society recommendations[J].Clinical Nutrition, 2012,31(6):783-800.
[10]黎介寿.胃肠手术的“围手术期营养处理”[J].肠外与肠内营养, 2013,20(2):65-67.
Perioperative immunonutrition for patients with gastric carcinoma undergoing total gastrectomy
XIE Qi,JIN Huicheng,JIA Zhong,et al.
Department of Gastrointestinal Surgery,Hangzhou First People's Hospital,Hangzhou 310006,China
Objective To investigate the clinic effect of perioperative immunonutrition(PIN)for patients with gastric carcinoma undergoing total gastrectomy. Methods One hundred and twenty patients with gastric carcinoma who underwent total gastrectomy during January 2012 and June 2014 in Hangzhou First People's Hospital were randomly divided into 2 groups:60 patients in PIN group received parenteral immunonutrition support for 5d before operation and then enteral immunonutrition treatment for 1w after surgery;60 patients in EIN(early enteral immunonutrition)group received enteral immunonutirtion treatment for 1w after surgery only.Nutrient status and immune function of these two groups were examined on the preoperative d1,postoperative d1,7 and 10.The rate of postoperative infective complications were also documented. Results The indexes of nutrient status,immune function and nitrogen balance in PIN group were better than those in EIN group on preoperative d1 and postoperative d1(P<0.05).The rate of postoperative infective complication in PIN group was lower than that in EIN group(P<0.05). Conclusion Perioperative immunonutrition is safe and effective for patients with gastric carcinoma undergoing gastrectomy,with better nutritional status and immune function,and less postoperative infective complications.
Gastric carcinoma Total gastrectomy Immunonutrition Perioperative
2014-07-21)
(本文编辑:李媚)
浙江省医学会临床科研资金项目(2011ZYC-A28)
310006 杭州市第一人民医院胃肠外科
谢琦,E-mail:5447710@qq.com
