桑叶功能基因表达水平与多酚类成分积累的关联分析
2015-01-18王阿娜万德光
刘 薇, 王阿娜, 万德光, 裴 瑾*
(1.成都中医药大学 中药资源系统化研究与开发利用省部共建国家重点实验室培育基地,四川 成都611137;2.成都康美药业有限公司,四川成都610041)
桑叶功能基因表达水平与多酚类成分积累的关联分析
刘 薇1, 王阿娜2, 万德光1, 裴 瑾1*
(1.成都中医药大学 中药资源系统化研究与开发利用省部共建国家重点实验室培育基地,四川 成都611137;2.成都康美药业有限公司,四川成都610041)
目的对不同生长发育阶段桑叶的功能基因表达水平与多酚类成分的动态积累进行关联分析,寻找桑叶质量差异的分子机制。方法HPLC法测定四川省成都市温江区4月至11月期间桑叶中绿原酸、芦丁和紫云英苷的含有量,然后实时荧光定量PCR法测定pal、chs和f3h 3种功能基因的表达量,计算其水平与多酚类成分含有量之间的相关性。结果芦丁、紫云英苷和绿原酸的含有量在6月达到峰值,而且与pal和f3h基因表达水平相关性明显,但与chs基因表达水平相关性较低。结论桑叶多酚类成分积累受pal和f3h基因调控作用较明显,说明这两个基因及其表达可用于研究桑叶品质差异的分子机制。
桑叶;功能基因;pal;chs;f3h;多酚;实时荧光定量PCR
桑叶始载于 《神农本草经》,被列为中品。《中国药典》2010年版一部规定,桑叶为桑科植物桑Morus alba L.的干燥叶,其味甘、苦,性寒,归肺、肝经,具有清肺润燥、清肝明目、疏散风热的功效[1-2]。它含有丰富的多酚类成分,如黄酮、单宁、酚酸以及花色苷类等,具有抗菌、抗炎、抗病毒、抗氧化、降血压、降血糖等生物活性,而绿原酸、芦丁和紫云英苷等是其主要有效成分。前期研究发现[3-4],不同生长发育阶段的桑叶,其多酚类成分的含有量存在差异,而其中黄酮类成分的药理活性被认为与该植物传统功效有一定关联。
目前,对药用植物有效成分代谢调控的研究主要是利用现代生物技术来考察其代谢途径,以及对其遗传特性进行改造,进而改变植物的次生代谢产物,提高有效成分含有量。在研究植物次生代谢途径时发现,大部分物质次生代谢的共有途径之一为苯丙氨酸解氨酶(PAL)途径。PAL在绿原酸和黄酮类物质的合成途径中都是位于起始点的一个关键酶[5-13],而查耳酮合成酶 (CHS)位于黄酮类物质合成途径的上游位置,另外二氢黄酮-3-羟化酶(FHT或F3H,f1avanone-3-hydroxy1ase)与其他关键酶共同协调负责黄酮类的羟基化反应[14-19]。
本实验采用实时荧光定量PCR技术以分析pal、chs和f3h 3种功能基因的表达水平,并采用数理统计分析法来研究这3种功能基因表达水平与绿原酸、芦丁和紫云英苷动态积累之间的相关性,初步探讨其对有效成分动态积累在次生代谢途径中的影响,为在分子水平上深入揭示桑叶药材质量差异的形成奠定了基础。
1 材料、试剂与仪器
桑叶采自于四川省成都市温江区,为保证取样科学性、数据可靠性以及足够样本量,故选取有一定代表性的两个居群桑树 (A和B)各3棵,由成都中医药大学万德光教授鉴定为桑科植物桑Morus alba L.的干燥叶。于2011年4月—11月中旬,每月采摘一次,现采现提RNA后,反转录成cDNA,保存于-20℃冰箱中。
绿原酸、芦丁对照品 (中国药品生物制品检定所);紫云英苷 (南京泽朗医药科技有限公司,纯度98%)。甲醇为色谱纯 (美国Fisher公司);磷酸为分析纯 (国药集团化学试剂有限公司);超纯水 (自制)。Taq酶、普通琼脂糖凝胶DNA回收试剂盒(天根生化科技有限公司);SYBR Green实时荧光定量PCR(东洋纺上海生物科技有限公司);Agarose G-10琼脂糖(香港基因有限公司)。Agi1ent 1200高效液相色谱仪 (包括化学工作站)、Agi1ent1260 DAD紫外检测器(美国Agi1ent Techno1ogies公司);电子天平(瑞士Mett1er To1edo公司);超声波清洗器 (昆山超声仪器有限公司);iCyc1er iQ荧光定量PCR仪(美国Bio-Rad公司)。
2 方法
2.1 不同生长发育时期桑叶中绿原酸、芦丁和紫云英苷的动态积累
2.1.1 对照品和供试品溶液制备 根据文献[20]报道的方法,制备这两种溶液。
2.1.2 色谱条件 Diamonsi1 C18色谱柱(250 mm×4.6 mm,5μm);流动相为甲醇-0.5%磷酸水溶液,梯度洗脱 (0~5 min,5%~25.5%甲醇;5~45 min,25.5%~48%甲醇;45~75 min,48%~64%甲醇;75~85 min,64%~80%甲醇;85~90 min,80%~90%甲醇;90~95 min,90%~95%甲醇;95~110 min,95%~100%甲醇);检测波长320 nm;柱温30℃;体积流量1.0 m L/min;进样量20μL。
2.1.3 线性关系和方法学考察 根据文献 [20]报道的方法,对两者进行考察。
2.2 不同生长发育时期桑叶功能基因表达量测定
2.2.1 总RNA的提取 采用TRNzo1法提取,具体操作方法见文献 [21]。
2.2.2 cDNA第一链的合成 在冰块上解冻模板RNA及Quant Reverse Transcriptase;在室温(15~25℃)下解冻引物、10×RTmix、dNTPRNase-freeddH2O、混合液等,迅速置于冰上,涡旋振荡,短暂离心后配制逆转录体系混合液,简短涡旋振荡(不超过5 s),短暂离心后置于冰上。之后,加入模板RNA 5μL,充分混匀后短暂离心,37℃下孵育60 min,置于-20℃冰箱中保存。
2.2.3 引物设计 根据桑叶3个功能基因pal、chs、f3h的序列,设计特异引物[22-23],并以β-actin基因为内参,引物序列为pal F 5-GCCAGCAGTGATTGGGTTAT-3',R 5'-CCTTGCTTGGTCCTCCTGT-3';pal F 5'-AACATGTCGAGTGCGTGTGT-3',R 5'-GTCTTGAGCCCATCTTCAGC-3';f3h F 5'-CGTGCTGAGATTTGCAAGAA-3',R 5'-AACGCCATGATCAACAACCT-3';β-actin F 5'-AGGGGAAGCTGGCTTATGTT-3',R 5'-CGGGCAGCTCATAGTTCTTC-3'。
2.2.4 实时荧光定量PCR扩增 取已制备好的4个基因对照品,稀释10倍,用于制作标准曲线。在PCR板 (96孔)每孔中加入体系反应液20μL,配方为正反游引物各1μL、THUNDERBIRD SYBR qPCR Mix 10μL、ddH2O 6μL、cDNA模板2μL。然后,阴性对照管中加入灭菌水20μL,扩增条件为95℃下3 min后扩增循环30个→95℃下变性30 s→pal基因58℃下退火30 s(chs和f3h基因56℃下退火30 s)→72℃下延伸20 s→相同温度下再延伸2 min,4℃下保存。每份样品均平行检测3次,备用。
将4种基因的标准曲线和与检测各样品后得到的Ct相结合,计算每个样品的定量结果,数据分析采用2-△△Ct法[19],对照样本选择4月份的A样品,待测样本为剩余样本,通过计算来比较各样品间的相对表达水平差异,计算公式为相对表达量= 2-△△Ct。其中,ΔΔCt=ΔCt(剩余的待测样本)-ΔCt(对照样本);ΔCt(对照样本)=pal/chs/f3h(Mean Ct)4月1-参照基因β-actin(Mean Ct)4月1;ΔCt(待测样本)=pal/chs/f3h(Mean Ct)n月-参照基因β-actin(Mean Ct)n月。
结合本实验所得的pal、chs和f3h基因,以及β-actin等4种基因的Ct值,分别计算居群A和B生长发育时期各基因的表达差异。然后,利用SPSS 19.0统计学软件进行分析,考察基因表达水平和有效成分动态积累之间的相关性。
3 结果
3.1 不同生长发育时期桑叶有效成分含有量分析
计算不同生长发育时期桑叶中绿原酸、芦丁和紫云英苷的含有量情况,结果见表1。

表1 不同生长发育时期桑叶有效成分含有量(%,n=3)Tab.1 Active ingredient contents ofmulberry leaves from different grow th stages(%,n=3)
由表可知,在不同生长期的两个居群桑叶中,芦丁、紫云英苷和绿原酸的含有量均处于动态变化中。例如,两个居群中绿原酸的含有量均在5月为最低点,6月达峰值,之后呈整体下降趋势;芦丁的含有量在4月至6月均呈整体上升趋势,6月至8月均呈下降趋势,9月较高,之后呈整体下降趋势,说明当物种和生长环境相同时,虽然有效成分在相同生长期内存在一定差异,但整体变化趋势一致。
3.2 不同生长发育时期桑叶功能基因表达量分析
计算不同生长发育时期桑叶3个功能基因的相对表达量,结果见表2。

表2 不同生长发育时期桑叶pal、chs和f3h基因的相对表达量(n=3)Tab.2 Relative expressions of pal,chs and f3h in m ulberry leaves from different grow th stages(n=3)
由表可知,相同物种的桑叶虽然在相同时期的基因表达水平有所差异,但其整体变化趋势是基本一致的。而且,在同一生长发育阶段,居群A和B的基因相对表达量也有所不同,说明遗传物质相同(即来源相同)的中药材的基因相对表达量不同,但整体动态趋势一致。
3.3 不同生长发育时期桑叶功能基因表达量与有效成分含有量的关系 本实验通过研究pal、chs和f3h基因在桑叶中的表达水平,发现在不同生长发育阶段的桑叶中,这3个基因存在一定的相对表达差异。通过SPSS 19.0软件,分析出两种居群桑叶中pal、chs、f3h基因的相对表达量和芦丁、紫云英苷、绿原酸含有量的相关性,结果见表3。
由表可知,3种基因的表达水平与两个居群桑叶中绿原酸、芦丁、紫云英苷以及其总含有量的动态变化趋势基本一致。pal、f3h基因均分别与桑叶中芦丁、绿原酸、紫云英苷含有量以及其总含有量之间存在一定的正相关,如居群A的相关系数 (r)在0.20~0.70之间,居群B的r在0.40~0.75之间。其中,pal基因的表达水平与3种成分的含有量变化趋势更为接近,上升趋势均在4月—6月和8月—9月,下降趋势均在6月—8月和9月—11月。另外,pal基因与居群B的3种多酚类成分总含有量显著相关,并与居群A也有一定相关趋势,r为0.656,而f3h基因与多酚类成分相关度较小,相关系数r在0.003~0.55之间。但chs基因和多酚类成分之间存在低度正相关,甚至不相关,如居群A的相关系数r仅在-0.20~0.46之间,而居群B的相关系数r仅在-0.55~-0.06之间。
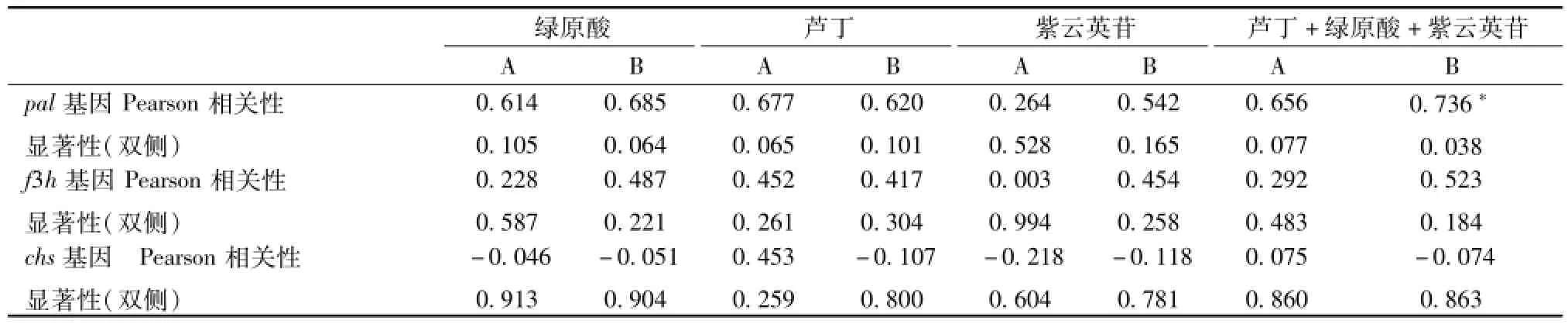
表3 居群A、B多酚类成分与pal、chs、f3h基因表达水平的相关性(n=3)Tab.3 Cor relation between polyphenolic constituents and the expression levels of pal,chs and f3h in populations A and B(n=3)
4 讨论
4.1 桑叶多酚类成分生物合成途径中关键酶基因的调控作用 多酚类成分的生物合成能被植物不同发育时期和数种环境因子所调控和诱导,而且具有明显的组织特异性。黄酮和绿原酸的生物合成途径均属于多酚类成分类型,并且均需在数个关键酶的催化下完成。在所选取的3个关键酶中,pal和chs均为前期酶,而f3h属于中期酶,对次生代谢产物的积累有一定影响。本实验以未经过人工调控的两个居群桑叶为研究对象,将多酚类成分的动态积累与3个关键酶的基因表达水平进行相关性分析,从而证实关键酶的催化作用,为研究桑叶品质差异形成的分子机制奠定了基础。
4.2 pal、chs和f3h基因与桑叶多酚类成分动态变化的相关性分析 本实验研究两个居群桑叶的原因有两个,一是要保证取样科学性、数据可靠性以及足够样本量,二是经研究发现,两个居群桑叶的化学成分和基因相对表达量在相同时期虽有一定差异,但是这3种基因与多酚类成分的动态积累变化趋势基本一致。其中,相关性最大的是pal基因与多酚类成分,其次是f3h,而chs最小,推测可能是因为pal基因处于合成途径的首要位置,与其相关的代谢产物多于f3h和chs基因,即表明3种基因对多酚类成分均有一定调控作用,其中作用最大的是pal基因。另外,本实验也发现,关键酶基因能有效调控桑叶次生代谢产物的合成,同时也为桑叶品质形成的分子机制研究提供了可靠的依据。
[1]国家药典委员会.中华人民共和国药典:2005年版一部[S].北京:中国医药科技出版社,2005:18,209.
[2]江苏新医学院.中药大辞典:下册[M].上海:上海科学技术出版社,2006:223.
[3]游元元,万德光,杨文宇,等.HPLC法比较不同产地桑叶药材品质差异[J].中国药房,2010,21(35):3314-3316.
[4]刘学铭,肖更生,陈卫东.桑叶的研究与开发进展[J].中药材,2001,24(2):144-147.
[5]杨致荣,毛 雪,李润植.植物次生代谢基因工程研究进展[J].植物生理与分子生物学学报,2005,31(1):11-18.
[6]Chen X Y.Liu P.Mo1ecu1ar bio1ogy and genetic engineering of p1ant secondary metabo1ism[J].Life Sci,1996,2(8):8-11.
[7]He SL,Zheng JG,Wang X F,etal.P1ant secondarymetabo1ism:function,reconci1e,contro1and genetic enginering[J]. App Environ Biol,2002,8(5):558-563.
[8]杜丽娜,张存莉,朱 玮,等.植物次生代谢合成途径及生物学意义[J].西北林学院学报,2005,20(3):150-155.
[9]罗永明,刘爱华,李 琴,等.植物萜类化合物的生物合成途径及其关键酶的研究进展[J].江西中医学院学报,2003,15(1):45-51.
[10]陈晓亚.植物生理与分子生物学[M].北京:科学出版社,1998:390-399.
[11]邓 良,袁 华,喻宗沅.绿原酸的研究进展[J].化学与生物工程,2005,22(7):4-6.
[12]Stockigt J,Zenk M H.Enzymatic synthesis of ch1orogenic acid from caffeoy1coenzymeand quinic acid[J].FEBSLett,1974,42(2):131-134.
[13]张鞍灵,马 琼,高锦明,等.绿原酸及其类似物与生物活性[J].中草药,2001,32(2):173-176.
[14]诸 姮.盐度和基质对老鼠簕生长及总黄酮含量的影响[D].厦门:厦门大学,2008.
[15]谷希达.基于光酶诱导的桑叶次生代谢产物及其差异蛋白质组学研究[D].杭州:浙江大学,2010.
[16]孙梓健.红叶芥花青素合成途径结构基因的克隆及表达分析[D].重庆:西南大学,2010.
[17]朱灿灿.银杏叶次生代谢产物的环境诱导机制及其调控[D].南京:南京林业大学,2010.
[18]张华峰,王 瑛,黄宏文.黄酮类化合物生物合成途径的进化及其在淫羊藿中的研究展望[J].中草药,2006,37(11):1745-1751.
[19]李贝宁,周晓丽,黄璐琦,等.不同产地丹参功能基因表达水平对丹参酮类成分积累的影响[J].中国中药杂志,2011,36(24):3406-3409.
[20]刘 薇,裴 瑾,王阿娜,等.两个桑叶栽培品种化学成分的动态变化研究[J].华西药学杂志,2012,27(6):607-610.
[21]王阿娜,裴 瑾,刘 薇,等.桑叶片总RNA提取方法的比较研究[J].中成药,2012,34(7):1377-1380.
[22]刘 薇.桑叶化学成分的动态变化与PAL、F3H基因的表达水平研究[D].成都:成都中医药大学,2012.
[23]王阿娜.桑查尔酮合成酶基因的克隆表达及桑枝酚类成分表征分析[D].成都:成都中医药大学,2012.
Correlation between expression level of functional genes and polyphenols'accumulation in mulberry leaves
LIUWei1, WANG A-na2, WAN De-guang1, PEI Jin1*
(1.Pharmacy College,Chengdu University of Traditional ChineseMedicine;TheMinistry of Education Key Laboratory of Standardization of Chinese Herbal Medicine;SystematicResearch,Developmentand Utilization ofChineseMedicineResources in Sichuan Province,Key Laboratory Breeding BaseofCo-founted by Sichuan Province and Ministry of Education,Chengdu 611137,China;2.Chengdu Kangmei Pharmaceuitical Co.,Ltd,Chengdu 610041,China)
AIMTo study the corre1ation between expression 1eve1of functiona1genes and po1ypheno1s'accumu1ation inmu1berry 1eaveswith different growth stages for investigating themo1ecu1armechanisms of action of this p1ant.METHODSThe HPLCmethod was app1ied to determining ch1orogenic acid,rutin and astraga1in in mu1-berry 1eaves co11ected from Wenjiang County(Chengdu City,Sichuan Province)from Apri1 to November in 2011.Then the expression 1eve1s of three functiona1genes(pal,chs and f3h)were investigated by quantitative rea1-time PCR method,whose corre1ation was ca1cu1ated.RESULTSThe contents of rutin,astraga1in and ch1orogenic acid reached the highest peak in June,showing high corre1ation with the expression of pal and f3h,but 1ow corre1ation with chs.CONCLUSIONThe expression 1eve1s of pal and f3h have c1ose re1ationships with po1ypheno1s'accumu1ation in mu1berry 1eaves,which can be used to study themo1ecu1armechanisms of the difference of qua1ity of mu1berry 1eaves.
mu1berry 1eaves;functiona1gene;pal;chs;f3h;po1ypheno1;quantitative rea1-time PCR
R284.1
A
1001-1528(2015)08-1747-05
10.3969/j.issn.1001-1528.2015.08.025
2014-09-05
四川省科技厅项目 (2015TD0028)
刘 薇 (1979—),女,博士,讲师,从事中药品质评价及资源研究。Te1:13880898225,E-mai1:1wiu@163.com
*通信作者:裴 瑾 (1970—),女,博士,教授,硕士生导师,从事中药品质评价与资源研究。Te1:13880369322,E-mai1:peixjin@ 163.com
