鳀鱼鱼浆的酶解过程与营养成分的变化
2015-01-17吴代武税典章蔡春芳叶元土罗其刚林秀秀
■吴代武 税典章 蔡春芳 吴 萍 叶元土 彭 侃 罗其刚 林秀秀
(苏州大学基础医学与生物科学学院江苏省水产动物营养重点实验室,江苏苏州 215123)
鳀鱼(Engraulis japonicus)是鳀属鱼类的统称,鳀 属鱼类产量占世界水产品产量的10%~20%,在我国主要分布在黄海、东海海域[1],是中国近海鱼类中最大的鱼类种群资源[2]。鳀鱼营养价值较高,蛋白质含量约为15%~20%,必需氨基酸含量丰富[3],具有较高的开发价值。
在鱼粉资源日益紧张的情况下,开发新的饲用产品提高资源的利用效率也是对资源的一种节约。以新鲜的海水低值鱼类为原料生产鱼浆用于饲料,在实际生产中表现出很好的效果,主要特点是维护了原料鱼的蛋白质和油脂新鲜度、保持了海水鱼类原料对养殖动物生长的优势,同时也增加了饲料的诱食效果、增加了饲料生产过程中的水分含量。传统的鱼粉生产工艺中,原料鱼在蒸煮、烘干等生产环节经一定的高温处理,使一些有害成分含量升高[4]。鳀鱼体内肝胰脏、肠道和细胞溶酶体中含有丰富的内源蛋白酶[5-6],能将自身蛋白质酶解成多肽和氨基酸。有研究表明,鲜杂鱼[7]、水解蛋白[8]能有效地促进水产动物的生长。如果以冰冻鳀鱼为原料,经过打浆后酶解而得到鱼浆直接用于水产饲料中,避免鱼粉生产的高温对油脂、蛋白质的不利影响,可以很好地保持鱼浆新鲜度和鱼体特殊营养物质,同时具有强烈的诱食性。这在部分海水鱼类饲料、尤其是肉食性鱼类饲料中得到初步的应用,取得很好的养殖效果。但是,对酶解过程中生化成分变化的研究还不多。
本试验在55℃条件下,通过外源木瓜蛋白酶促进酶解反应、抗生素抑制微生物繁殖对鳀鱼进行酶解。将鱼浆冷冻干燥,测定游离氨基酸、挥发性盐基氮、生物胺、脂肪酸、丙二醛、过氧化值和酸价,对酶解过程中的生化变化规律进行研究,为鳀鱼内源蛋白酶类的利用提供科学依据。
1 材料和方法
1.1 试验设计
本试验分为4个处理,分别用C、E、A、E+A表示。C:对照组。E:添加外源木瓜蛋白酶5 500 U/g。A:添加抗生素抑制微生物的生长,抗生素的用量为青霉素150 IU/g、链霉素150 μg/g,0、5 h各添加1次[9]。E+A:E、A处理中所用的抗生素及木瓜蛋白酶。然后对4个处理鳀鱼在酶解过程中的营养成分变化进行分析,与商业鱼粉比较。
1.2 试验鳀鱼
鳀鱼由山东海圣饲料有限公司提供,为冰冻保存的鳀鱼;商业鱼粉由山东海圣饲料有限公司提供;木瓜蛋白酶为广州鸿易食品添加剂有限公司产品。
选取完整的冰冻鳀鱼,用绞肉机在鳀鱼为冰冻状态下绞碎,取一定量的鱼浆于2 000 ml烧杯中,在55℃水浴锅恒温酶解。于0、3、5、7、9、12、24 h分别取样,迅速于-20℃冷冻保存。真空冷冻干燥后备用。
1.3 主要成分的测定
水分测定采用真空冷冻干燥方法;粗蛋白测定采用凯氏定氮方法(GB/T 5009.5—2010);粗脂肪测定采用索氏抽提方法(GB/T14772—2008);灰分测定按照(GB/T 5009.4—2010)标准测定。
1.4 营养指标的测定
游离氨基氮测定采用茚三酮比色法;菌落总数测定采用GB/T 4789.2—2010方法;游离氨基酸测定采用SYKAM S—433D氨基酸分析仪;挥发性盐基氮测定采用SC/T 3032—2007方法;生物胺测定采用液相色谱-串联质谱法;丙二醛测定采用TBA比色法;过氧化值测定采用比色法(GB/T 5009.37—2003);酸价测定采用GB/T 5009.37—2003方法;脂肪酸测定采用GB/T 17277—2008方法。
2 结果
2.1 鳀鱼主要成分
鳀鱼主要营养成分见表1。由表1可知,鳀鱼的水分含量为76.08%,干物质为23.92%,含有丰富的蛋白质,具有较高的开发价值。将其水解成多肽、游离氨基酸,将更有利于鱼类的吸收,提高鳀鱼的利用率。

表1 鳀鱼主要成分(%)
2.2 鳀鱼酶解效果的分析
2.2.1 鳀鱼酶解过程中游离氨基氮含量的变化
以自溶组(C组)鱼浆为样本,测定酶解样品中游离氨基氮含量,结果见图1。从图1可知,在55℃条件下,酶解液中氨基氮的含量随时间不断增加,酶解前9 h氨基氮增加较快,9 h后增加缓慢,确定酶解时间为9 h。

图1 鳀鱼酶解过程中游离氨基氮含量的变化(湿重)
2.2.2 鳀鱼酶解过程中细菌总数的变化
为探讨酶解过程中细菌的生长、防止细菌对蛋白质类物质的腐败作用和油脂的氧化作用,试验A、E+A组添加抗生素,抗生素对鳀鱼鱼浆的抑菌效果见图2。从图2可知,C组、E组(无抗生素)鱼浆中细菌总数随时间的变化为∶7 h以前鱼浆中细菌总数小于4×104CFU/g,而9 h细菌总数就超过了1×105CFU/g。添加了抗生素的A组、E+A组添加抗生素有效地抑制了微生物的繁殖,9 h细菌总数也没有超过4×104CFU/g。因此,如果在实际生产中,为了避免鱼浆中加入抗生素,在55℃自溶条件下,可以将酶解时间控制在7 h左右。

图2 鳀鱼酶解过程中细菌总数的变化
2.2.3 鳀鱼酶解过程中蛋白质水解、腐败产物的变化
2.2.3.1 氨基酸的变化(见表2)
表2中显示了鳀鱼酶解过程中游离氨基酸含量(FAA)的变化。从表2中可以看出,酶解9 h,FAA含量显著升高,C组达到了14.97 g/100 g,C、A、E和E+A四个处理分别增加158.9%、168.1%、139.3%、145.8%。E组FAA含量比C组高532.20 mg/g,但与氨基酸含量相比,这一差异非常微小。C组FAA含量与A、E+A组差异同样较小,仅为A、E+A组的1.08~1.09倍,而微生物约为600倍,表明FAA的生成主要受鳀鱼蛋白酶作用,微生物的作用较弱。
2.2.3.2 挥发性盐基氮的变化
鱼浆酶解过程中挥发性盐基氮(VBN)含量的变化见表3。从表3可知,VBN在酶解前3 h升高最快,5 h后A组VBN生成量显著高于C组(P<0.05),微生物对VBN生成影响显著(P<0.05)。酶解9 h后,C组盐基氮水平与加抗生素组(A组)挥发性盐基氮差异显著(P<0.05)。酶解完成后,VBN分别升高了127.38%~135.96%。
2.2.3.3 生物胺的变化
鳀鱼酶解过程中生物胺含量的变化见表4。由表4可知,酶解完成后,对照组组胺含量与原料鱼差异不大,4个试验组腐胺、精胺、亚精胺含量降低;试验组尸胺含量升高86.9、98.5、190.2、104.7 mg/kg,A组比其它组高出34.47%~44.85%。

表2 鳀鱼鱼浆游离氨基酸含量的变化(干重)(mg/100 g)

表3 鳀鱼酶解过程中挥发性盐基氮的变化(干重)(mg/100 g)

表4 鳀鱼鱼浆生物胺含量的变化(干重)(mg/kg)
2.2.4 鳀鱼酶解过程中油脂氧化的变化
2.2.4.1 脂肪酸组成的变化
鳀鱼极易腐烂,不饱和脂肪酸含量较高,因此在酶解期间常出现脂肪氧化现象。鳀鱼酶解后脂肪酸含量的变化见表5。从表5中可知,鳀鱼不饱和脂肪酸(UFA)占脂肪总量的42.29%,酶解后UFA含量降低8.1%~10.4%,饱和脂肪酸(SFA)含量升高4.4%~6.4%,UFA酶解过程中部分转化为SFA。A、E+A组UFA含量高于C、E组,微生物对UFA的转化有一定影响。
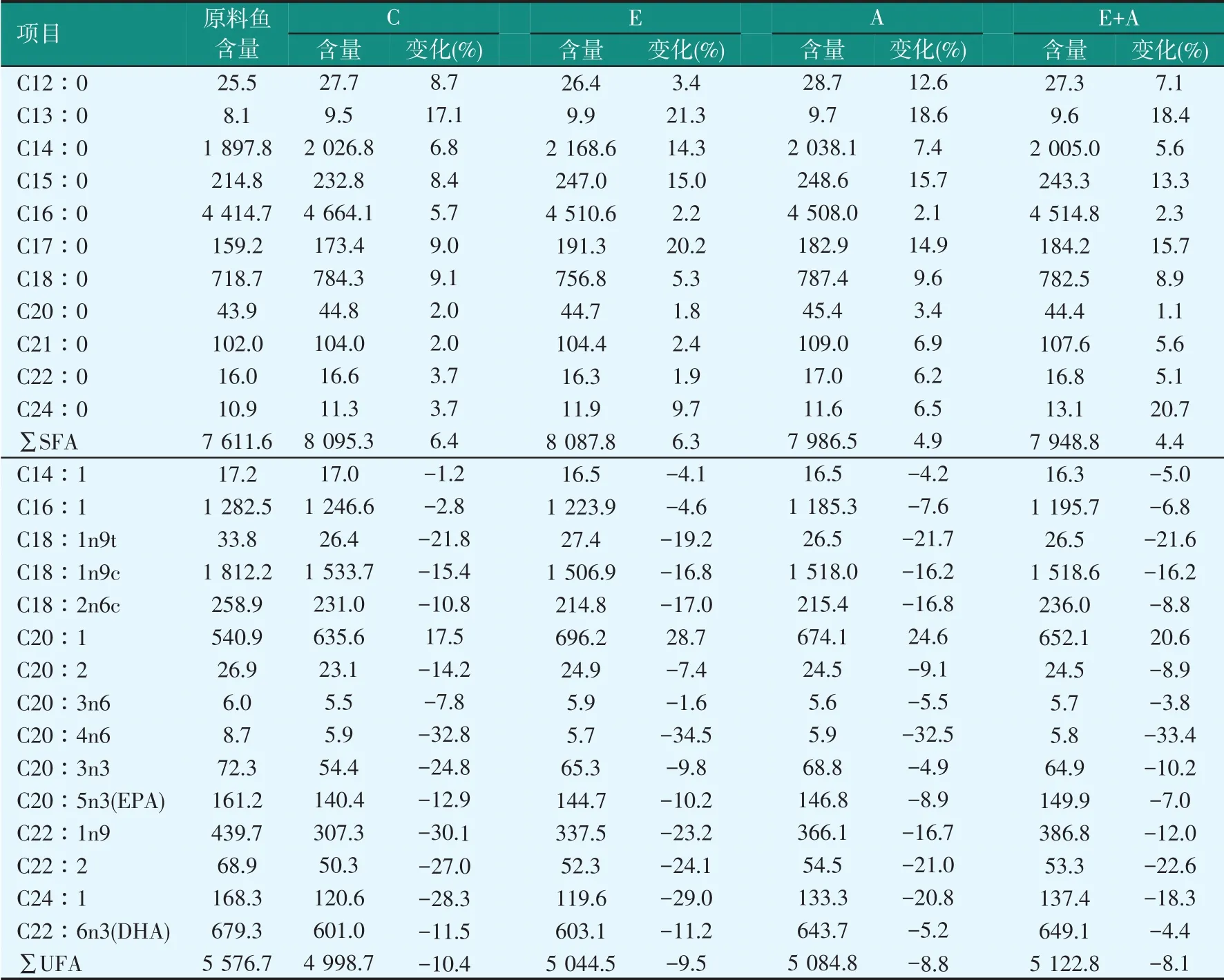
表5 鳀鱼酶解过程中脂肪酸的变化(干重)(mg/100 g)
2.2.4.2 脂肪酸氧化指标的变化
鳀鱼酶解过程中丙二醛(MDA)、过氧化值(POV)、酸价(AV)的变化见表6。由表6可知,酶解过程中C组POV最高,A组最低,结束后A组比C组低41.71%、E组比C组低31.71%,差异显著(P<0.05),木瓜蛋白酶和抗生素都可降低POV,但抗生素效果更好。
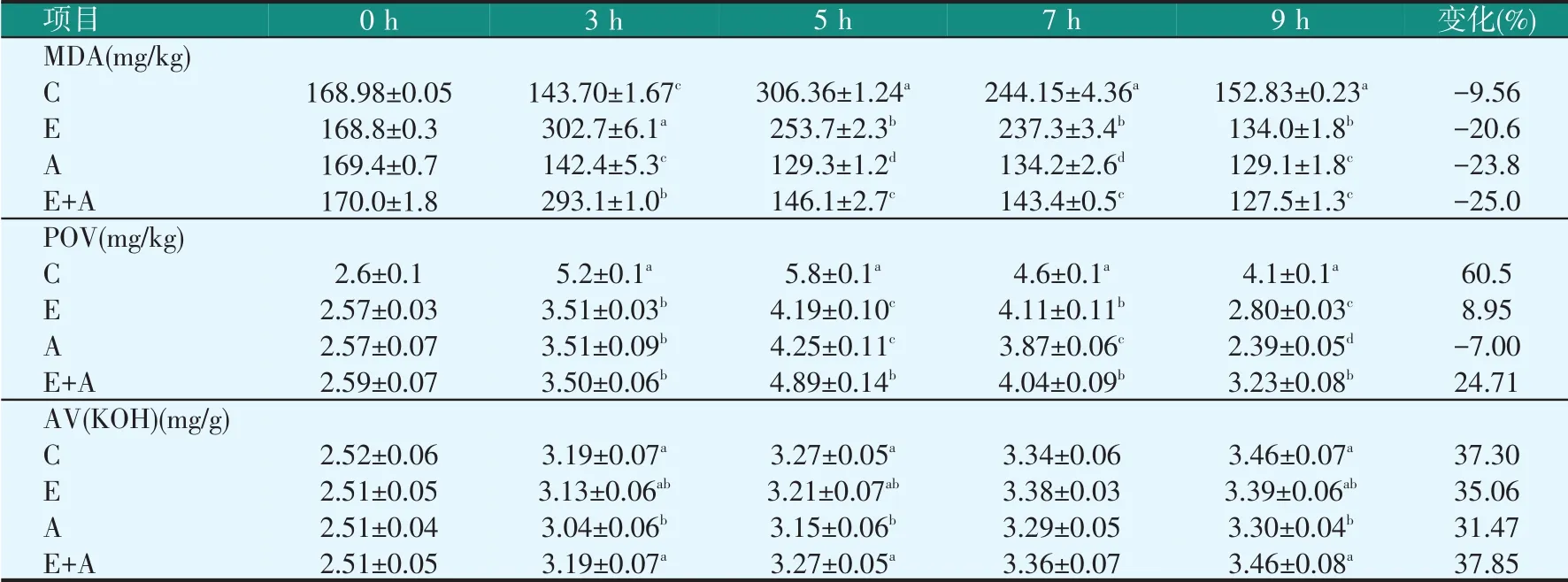
表6 鳀鱼酶解过程中MDA、POV、AV的变化(干重)
酶解过程中MDA含量也呈现先升高后降低的趋势,各试验组MDA峰值均在300 mg/kg左右(A组除外),C组峰值在5 h,E、E+A组在3 h,E+A组3 h后MDA含量迅速降低,而A组波动较小,酶解结束后MDA含量均低于初始阶段。
各处理组的AV在前3 h迅速升高,3 h后升高速率降低,7 h后基本稳定,酶解完成后AV在3.30~3.46 mg/g之间。酶解过程中A组AV低于其它试验组,与C组差异显著,但A组酸价只比C组低0.16。E+A组AV高于A组,但E组与C组无显著性差异,说明木瓜蛋白酶的作用被微生物抑制。
2.3 鱼浆与商业鱼粉的比较
以对照组鱼浆与商业鱼粉理化指标进行比较,结果见表7。由表7可知,试验鱼浆与鱼粉理化指标差异较大,粗蛋白、粗脂肪、FAA、VBN含量分别比鱼粉高出5.85%、84.29%、750.57%、1 154.20%,粗灰分、组胺、AV比鱼粉低35.73%、19.35%、60%。
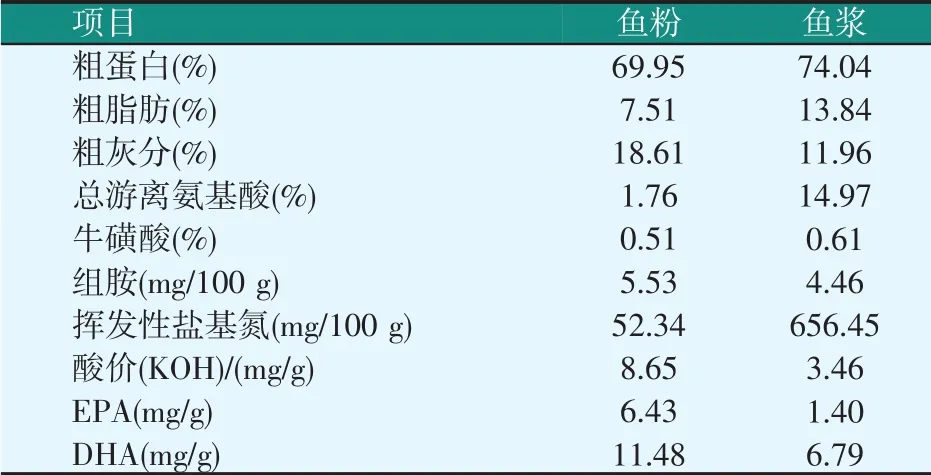
表7 鱼浆与商业鱼粉部分理化指标实测值(干重)
3 讨论
3.1 酶解鱼浆的营养指标
鳀鱼蛋白质在内源蛋白酶作用下水解成多肽、游离氨基酸,均属于氨基氮。55℃下酶解24 h游离氨基氮含量显著升高,表明鳀鱼鱼浆酶解程度较高,后期游离氨基氮升高缓慢,水解反应降低。可能是酶解初期鳀鱼内源蛋白酶活力较强,催化速率较快,随着反应进行,蛋白酶活性降低,催化速率减慢;随着酶解进行,反应底物减少,产物增加,抑制酶解反应进行。崔春在研究蓝园鯵的自溶机制时提到,鱼体自溶主要是钙激活蛋白酶和胰蛋白酶发挥作用,高温使蛋白酶迅速失活[10]。
外源木瓜蛋白酶、微生物对游离氨基酸含量影响较小,内源蛋白酶是主要作用,这与李平兰等[11]在发酵香肠的研究结果相似。VBN含量的变化与水产品的腐败程度存在明显的对应关系,有研究表明,低温贮存下细菌总数升高与VBN变化一致[12]。本研究中,VBN在酶解前3 h升高最快,此时微生物未进入繁殖期,表明在55℃下酶解9 h,微生物不是VBN变化的主要原因。生物胺由脱羧酶生成、胺氧化酶降解[13],保存期内微生物种类变化大[14],不同的微生物生成[15]、降解[16]生物胺能力不同。本试验表明,在55℃酶解过程中微生物对组胺、腐胺、精胺、亚精胺主要表现为降解作用,对尸胺表现为生成作用。
鳀鱼不饱和脂肪酸含量较高,这与蒋定文的研究结果相似[17],但部分脂肪酸组成与之差异较大,可能与我们采用真空冷冻干燥而文献报道的是60℃干燥样品有关。MDA、AV、POV是评价油脂氧化的重要指标,抗生素能有效降低MDA、POV、AV,可能是降低了微生物的代谢活动产生的酸性物质,酶解完成后MDA低于原料鱼,POV、AV水平低,表明鱼浆油脂氧化程度不高。
鱼浆酶解不经过脱脂处理,粗脂肪含量比商业鱼粉高出84.29%,高于鱼粉标准规定的11%(特级品)[18]。鱼浆FAA含量比鱼粉高1 154.2%,而FAA含量对鱼类生长可能有重要作用。鱼浆VBN含量为656.45 mg/kg,原因可能是酶解过程不经高温,VBN挥发量减少。鱼浆与商业鱼粉理化指标差异较大,其对鱼类生长的作用还有待进一步研究。
3.2 酶解条件的分析
周明明[1]在对鳀鱼酶解的研究中发现催化水解反应的最适温度为55℃左右,温度较低时腐败菌繁殖加快,会增加鱼浆发生腐败的危险。本试验以抗生素防止细菌对蛋白质的腐败作用和油脂的氧化作用。结果发现,在实际生产中,在55℃自溶条件下,不必添加抗菌剂,微生物对鳀鱼鱼浆营养成分变化影响较小,如需控制微生物数量可以将酶解时间控制在7~9 h。在对外源蛋白酶的研究中发现,外源木瓜蛋白酶对鳀鱼鱼浆影响较小,可能是所添加外源酶活力远小于组织酶或木瓜蛋白酶在本试验条件下活性,因此在实际生产中不需要添加外源酶。
4 结论
鳀鱼的蛋白质含量为(17.71±0.36)%,在55℃条件下,鳀鱼的最适酶解时间为7~9 h,酶解完成后游离氨基酸含量为14.97 g/100 g左右(干物质)。挥发性盐基氮和尸胺含量升高显著;组胺、腐胺、精胺、亚精胺含量降低,酶解过程对其表现为降解作用。酶解鳀鱼不饱和脂肪酸部分转化为饱和脂肪酸,酸价、丙二醛、过氧化值与原料鱼差别不大,油脂氧化程度较低。在55℃条件下鳀鱼蛋白质酶解迅速,蛋白质腐败和油脂氧化主要受组织酶作用,外源木瓜蛋白酶、微生物对其影响较小。
