桑叶水提液的急性毒性和遗传毒性研究
2015-01-17吴友苹
吴友苹, 张 升
(1.浙江大学医学院附属儿童医院,浙江杭州310003;2.浙江省医学科学院,浙江杭州310015)
桑叶水提液的急性毒性和遗传毒性研究
吴友苹1, 张 升2
(1.浙江大学医学院附属儿童医院,浙江杭州310003;2.浙江省医学科学院,浙江杭州310015)
目的初步评价桑叶水提液安全性。方法通过小鼠急性毒性试验、鼠伤寒沙门氏菌试验 (Ames试验)、中国仓鼠肺成纤维细胞 (CHL)染色体畸变试验和小鼠骨髓嗜多染红细胞微核试验,考察桑叶水提液急性毒性和遗传毒性。结果桑叶水提液40 g/kg小鼠灌胃给药未出现死亡,体质量与正常对照组比较无明显差异 (P>0.05)。经A-mes试验、CHL细胞染色体畸变试验、小鼠微核试验,桑叶水提液的结果均为阴性。结论本实验条件下,桑叶水提液的小鼠灌胃给药最大给药剂量为40 g/kg,且未表现出遗传毒性。
桑叶水提物;急性毒性;遗传毒性
桑叶始载于 《神农本草经》,为桑科植物桑Morus alba L.的干燥叶,味甘、苦、性寒,归肝经;具有疏散风热、清肺润燥、清肝明目的功效。据本草纲目记载: “桑叶乃手足阳明之药,汁煎代茗,能止消渴,明目长发。”现代药理学研究发现桑叶富含多糖、黄酮等活性成分,有降血压、抑制血糖上升、抗菌、消炎等功效,具有良好的药用价值[1-3]。桑叶还是我国目前已批准的既是食品又是药品的物品原料,但目前有关桑叶的研究报道多为其药理作用及化学成分分析研究[4-6],未见其毒理研究报道。我国传统的中草药原料有些具有毒性甚至较高毒性,因此对于这类中药原料的毒性应引起足够重视。为了解桑叶水提取液安全性,本实验对其进行了相关毒理学实验研究,为后续综合开发利用桑叶资源提供依据。
1 材料
1.1 实验动物与环境 SPF级ICR小鼠由上海斯莱克实验动物有限责任公司提供,许可证号SCXK(沪)2007-0005,动物合格证号为0037907。小鼠饲养于浙江大学实验动物中心,许可证号SYXK(浙)2007-0098。环境温度20.8~23.7℃,相对湿度48.7%~58.9%,压力33.4~46.8 Pa,换气次数为>15次/h,明暗交替12 h/12 h。
1.2 药物 桑叶购自浙江杭州九洲大药房,产自广东,批号110501。取桑叶适量,以10倍体积的水煎煮1 h,提取2次,滤过并将滤液浓缩至相当于生药量1 g/mL,即得桑叶水提取液(MWE)。进行Ames试验和细胞试验前,用孔径0.22μm一次性滤器过滤,备用。
1.3 试验菌株和细胞株 组氨酸营养缺陷型鼠伤寒沙门氏菌(TA97、TA98、TA100、TA102和TA1535)均购自美国Moltox公司。中国仓鼠肺成纤维细胞(CHL)购于中国科学院上海细胞研究所。
1.4 试验仪器 超低温冰箱 (702,美国Thermo公司);高压灭菌锅(HVE-50,美国Thermo公司);液氮罐(Cryosysterm 2000,MVE公司);超净工作台(Nu-425-400E,NUARE);正置显微镜及图像分析系统 (DM4000/ DM2500/DM1000,德国Leica公司);倒置显微镜(DMIL,德国Leica公司);二氧化碳培养箱(3111,美国Thermo公司)。
2 方法
2.1 小鼠急性毒性试验 取符合要求的SPF级ICR小鼠40只,雌雄各半。按体质量随机分成两组,每组20只。采用最大给药量法,设定桑叶水提取液 (1 g/mL)组和蒸馏水对照组,直接灌胃 (ig)给予,灌胃容量为0.4 mL/ 10 g。给药后连续观察3 h,后每天观察1次,连续观察14 d,记录小鼠死亡情况及中毒体征,处死并进行尸检。
2.2 Ames试验[7-8]采用标准Ames法,2种平板掺入试验条件 (非代谢活化-S9和代谢活化+S9),TA97、TA98、TA100、TA102和TA1535为试验用菌株。根据预试验结果,设定含有不同桑叶水提取液 (5 000、1 000、200、40、8μg/皿),和蒸馏水阴性对照 (100μL/皿)、标准阳性对照敌克松 (50μg/皿,-S9)、叠氮钠 (2μg/皿,-S9)、二氨基芴 (20μg/皿,+S9)、环磷酰胺 (200μg/皿,+ S9),分别加入含0.1mL增菌液的2mL顶层培养基中混匀倒入底层培养基上。37℃培养48 h,计算每皿回变菌落数。
2.3 中国仓鼠肺成纤维细胞 (CHL)染色体畸变试验[9-10]
采用桑叶水提液IC50(2.00 mg/m L)作为染色体畸变试验的最高试验质量浓度,以下设1.00、0.50 mg/mL两个试验浓度组,同时设定阴性对照组(RPMI1640,0.1 mL/孔)和阳性对照(环磷酰胺50μg/mL,丝裂霉素0.2μg/mL)。在活化 (+S9)条件下各剂量组处理CHL细胞6 h后更换培养液,继续培养至24 h。在非活化 (-S9)条件下,各剂量组处理CHL细胞6 h,24 h后更换培养液,继续培养至24 h。终止培养前4 h加10μg/mL秋水仙素溶液。常规消化、收获CHL细胞。经0.075 mol/L KCl低渗,固定液(甲醇-冰醋酸为3:1)预固定、固定、再固定等步骤后,将细胞滴在预冷的洁净载玻片上。染色,冲洗,晾干,备镜检。
2.4 小鼠骨髓嗜多染红细胞微核试验[11]采用桑叶水提取液40、20、10 g/kg 3个剂量组,同时设阴性对照组 (蒸馏水,40mL/kg)和阳性对照组 (环磷酰胺,50 mg/kg),采用经口灌胃30 h染毒法进行试验。在0 h、24 h各组均灌胃1次,末次灌胃后6 h,将小鼠颈椎脱臼处死,剪取双侧股骨用小牛血清稀释涂片,经甲醇固定,Giemsa染色后双盲阅片。每只小鼠计数2 000个嗜多染红细胞 (PEC)的微核发生率 (MN‰),同时计数200成熟红细胞 (RBC)中PEC/RBC值。
2.5 统计学方法 采用SPSS 17.0软件进行统计分析,各组数据均计算组平均值±标准差,急性毒性试验和致突变结果采用t检验,诱发微核作用和染色体畸变比较采用χ2检验。
3 结果
3.1 小鼠急性毒性试验 给药后30 min内桑叶水提取液组小鼠主要出现梳理毛发、活动减少和竖毛情况,其他行为活动均正常,给药后1 h行为活动无明显异常。蒸馏水对照组小鼠给予蒸馏水30 min后出现竖毛现象,其余活动均正常。观察期间两组小鼠均未出现死亡,体质量随着观察时间延长而增加。桑叶水提取液组小鼠体质量与蒸馏水组比较无统计学差异 (P>0.05)。详见表1。观察期结束对小鼠进行病理解剖,肉眼观察心脏、肺脏、肾脏、肝脏、脾脏、胃肠道等均未见明显异常。试验结果表明桑叶水提取液最大给药量为40 g/kg。
表1 桑叶水提液小鼠急性毒性试验体质量影响 (,n=20)
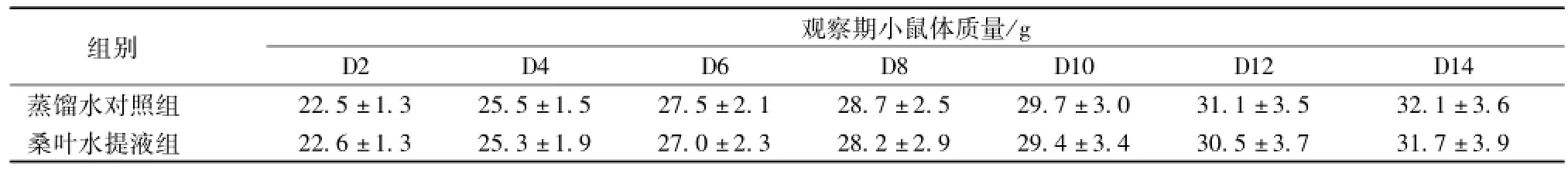
表1 桑叶水提液小鼠急性毒性试验体质量影响 (,n=20)
D2 D4 D6 D8 D10 D12 D14蒸馏水对照组组别观察期小鼠体质量/g 22.5±1.3 25.5±1.5 27.5±2.1 28.7±2.5 29.7±3.0 31.1±3.5 32.1±3.6桑叶水提液组22.6±1.3 25.3±1.9 27.0±2.3 28.2±2.9 29.4±3.4 30.5±3.7 31.7±3.9
3.2 Ames试验 阳性对照组均显著增加相应菌株的回变菌落数,与阴性对照组比较有显著性差异 (P<0.01),且回复突变菌落数均高于阴性对照组两倍以上,表明本测试系统符合测试要求。在非活化系统条件下,桑叶水提取液5 000μg/皿、1 000μg/皿和200μg/皿剂量组TA97菌株回变菌落数与阴性对照组比较减少,且有统计学差异 (P<0.05)。活化代谢条件下,除TA102菌株外,5 000μg/皿剂量组各菌株回复突变数与阴性对照组比较显著减少(P<0.05)。未见桑叶水提取液诱发基因回复突变作用,详见表2。
表2 桑叶水提液Ames试验结果()

表2 桑叶水提液Ames试验结果()
注:与阴性对照组比较,+表示超过两倍以上,视为阳性;t检验,*P<0.05,**P<0.01
TA97 TA98 TA100 TA102 TA1535 5 000(-S9) 10.2±2.1** 2.2±0.5* 16.7±6.5**剂量组别(μg/皿)259.7±9.7 9.7±3.2 1 000(-S9) 89.7±4.9* 5.7±5.1 84.7±5.0 284.3±53.3 10.0±4.0 200(-S9) 86.0±5.6* 11.0±5.0 86.3±3.8 288.3±11.1 8.3±1.5 40(-S9) 106.3±9.1 12.7±3.1 105.3±14.2 266.0±35.4 8.7±3.1 8(-S9) 107.0±6.2 14.0±2.0 106.7±7.6 295.0±24.6 12.0±2.0阳性组(-S9) 1 026.7±47.2**+ 659.3±40.2**+ 650.7±20.0**+ 1 114.0±100.0**+ 585.7±189.4**+阴性组(-S9) 107.0±7.9 16.0±6.6 96.3±17.9 284.3±30.8 14.7±4.2 5 000(+S9) 18±1.7** 9.7±0.2** 42.0±4.6* 188.0±59.0 3.3±1.5*1 000(+S9) 89.3±15.6 18.3±2.2 86.0±25.1 255.0±5.6 7.7±2.5 200(+S9) 99.3±13.7 23.7±4.2 95.3±1.5 275.0±60.7 8.3±3.1 40(+S9) 101.3±6.7 20.7±8.7 89.7±13.3 259.7±17.9 8.7±1.5 8(+S9) 96.7±9.9 23.0±3.6 97.7±15.7 258.3±7.6 9.0±2.6阳性组(+S9) 781.0±102.1**+ 936.3±121.2**+ 644.7±149.5**+ 771.3±88.5**+ 240.3±16.5**+阴性组(+S9)104.7±13.6 16.7±2.5 92.3±22.8 246.0±31.1 9.7±2.5
3.3 CHL细胞染色体畸变试验 桑叶水提取液高、中、低剂量的中期相染色体结构畸变率均<5%,与阴性对照组比较无显著性差异 (P>0.05)。而阳性对照组,染色体结构畸变率均>10%,明显高于阴性对照组 (P<0.01),显示阳性结果。因此,在活化和非活化条件下,桑叶水提取液质量浓度小于2 mg/m L对CHL细胞无明显的染色体畸变作用。详见表3。
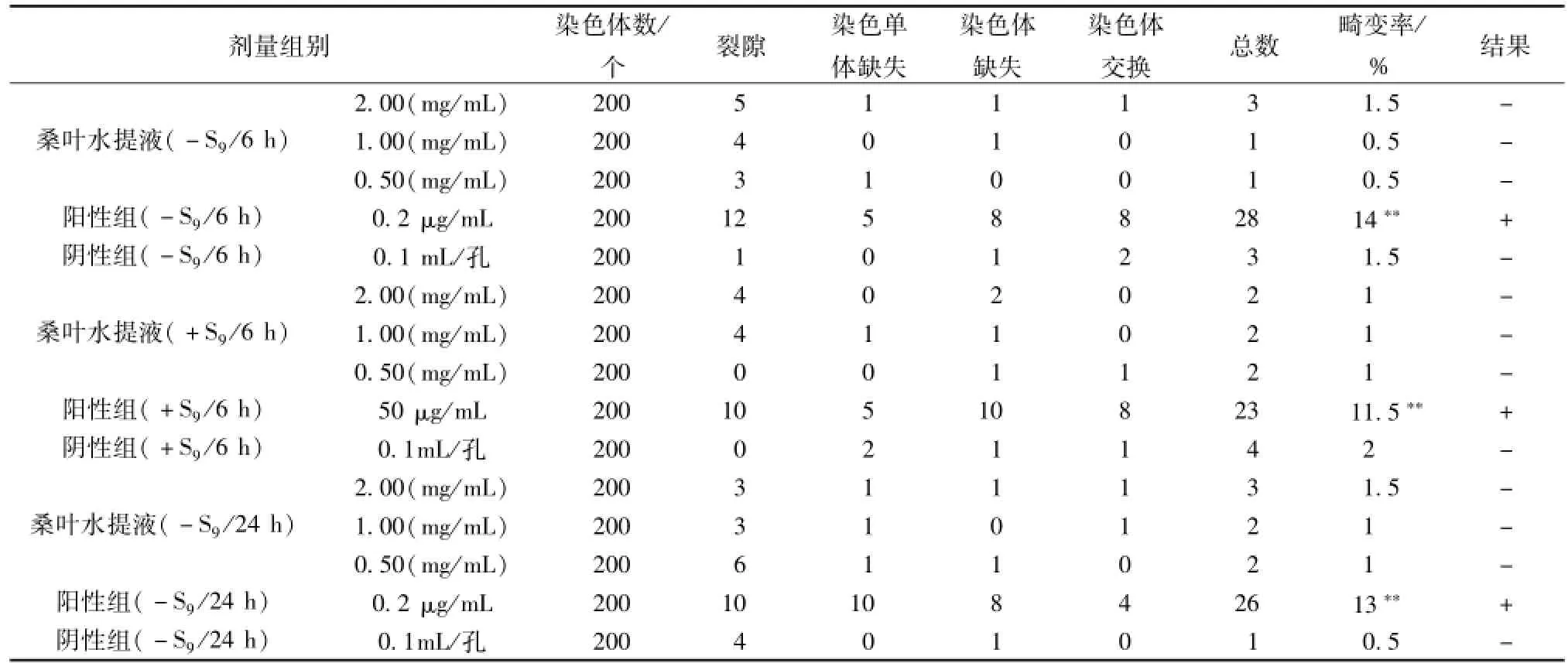
表3 桑叶水提取液对中国仓鼠肺成纤维细胞染色体畸变作用
3.4 小鼠骨髓微核试验 阳性对照组较蒸馏水对照组微核率显著增加 (P<0.01),显示阳性结果。桑叶水提取各剂量组微核率与蒸馏水对照组比较无显著性差异 (P>0.05),表明桑叶水提取剂量小于40 g/kg灌胃对小鼠的微核形成无明显影响。且各组嗜多染红细胞与总红细胞比值(PCE/RBC)范围处于0.36~0.60间,表明PCE形成正常,试验结果可靠,详见表4。
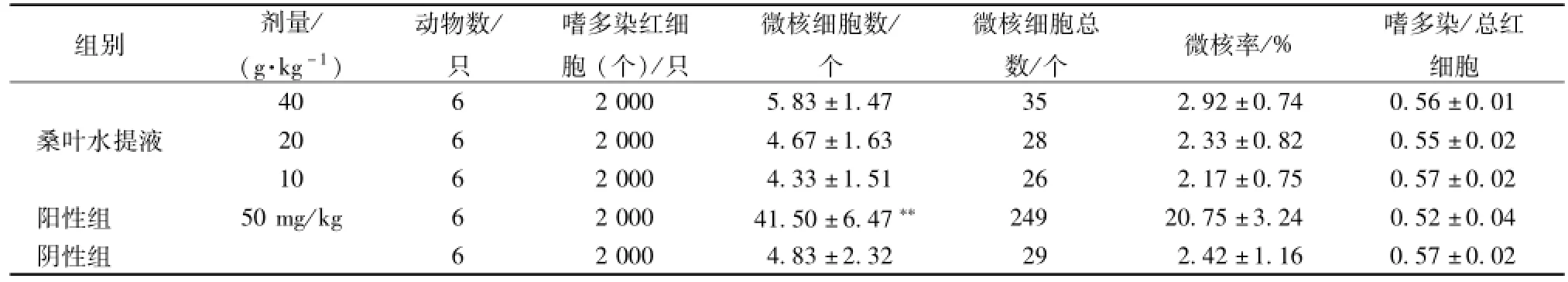
表4 桑叶水提液对小鼠骨髓PCE微核率的影响
4 讨论
文献报道,桑叶水提物对金黄色葡萄球菌(ATCC26001)、金黄色葡萄球菌耐药株、大肠杆菌(ATCC25—922)、绿脓杆菌 (ATCC10104)、甲型溶血性链球菌(ATCC32205)、乙型溶血性链球菌(ATCC32210)均有一定的的抗菌作用,且随着浓度增加,其抑菌率明显增高[12-14]。本次Ames试验观察到桑叶水提取液高剂量组各试验菌株回复突变菌落数明显小于自发回变数,提示桑叶水提取液对沙门氏菌有明显抑制作用,与文献报道一致[15]。
随着人们生活水平的提高,糖尿病成为继心脑血管疾病、癌症之后危害人类健康的第三大疾病之一。化学药物降血糖作用较好,但治疗并发症方面有明显不足,且多易产生不良反应和耐药性,而天然药物桑叶不良反应小,在降血糖的同时还可对抗糖尿病并发症,有着西药不可替代的综合优势和广阔的应用空间。我国桑树资源丰富,为预测其对人体潜在的威胁,本实验从体外到体内,从微生物到离体细胞,再到体细胞对桑叶水提液进行毒性研究。测试体系符合国际标准化要求,试验结果表明桑叶水提液在本实验剂量范围内未见明显毒性作用,无致突变作用,安全性高,本研究也将为桑叶资源进一步开发利用及临床安全使用提供科学依据。
[1]Chen JJ,Li X R.Hypolipidemic effect of flavonoids from mulberry leaves in triton WR-1339 induced hyperlipidemic mice[J].Asia Pac JClin Nutr,2009,16(1):290-294.
[2]Jaruchotikamol A,Pannangpetch P.Cytoprotective activity of mulberry leaf extract against oxidative stress-induced cellular injury in rats[J].Pakistan J Pharma Sci,2013,26(1):163-168.
[3]Chon SU,Kim Y M,Park Y J,et al.Antioxidantand antiproliferative effects of methanol extracts from raw and fermented parts ofmulberry[J].Eur Food Res Technol,2009,230(2):231-237.
[4]吕 欢,罗明俪,方 飞,等.桑叶提取物抑制α-葡萄糖苷酶活性体系的优化及动力学研究[J].中国新药与临床药理,2012,23(1):42-44.
[5]赵保胜,高晓燕,刘 洋,等,桑叶治疗2型糖尿病药效及其机制研究[J].中国实验方剂学杂志,2012,18(20):263-266.
[6]陈建国,步文磊,王 茵,等.桑叶多糖降血糖作用及其机制研究[J].中草药,2011,42(3):515-520.
[7]黄芳华,王庆利.药物遗传毒性研究相关要求进展[J].中国新药杂志,2010,19(6):468-472.
[8]S2B.Guideline for Industry Genotoxicity:A standard battery for genotoxicity testing of pharmaceuticals[S].ICH,1997.
[9]由振强,蒋春红,陈 晓,等.喜炎平注射液的遗传毒性实验研究[J].中国临床药理学杂志,2013,29(1):48-50.
[10]刘文斌,杨录军,李永红,等.甲氧化三丁基锡的急性毒性和遗传毒性研究[J].癌变·畸变·突变,2012,24(5):336-339.
[11]474 OECD.Guigeline for the testing of chemicals.mammalian erythrocytemicronucleus test[S].OECD,1997.
[12]Yan Xiaofen,Yan Huang,Zheng Hanshen,et al.In vitro antibiosis study ofmulberry[J].JGuangxi Tradi Chin Med Univ,2009,12(3):48-50.
[13]Wang Hui,Wu Sha,Sun Yifen,etal.An assay on the antiviral activity ofmulberry leafextract[J].SciSericul,2011,37(5):0952-0956.
[14]王 辉,吴 莎,孙毅凡,等.桑叶水提取物的抗病毒活性检测[J].蚕业科学,2011,37(5):0952-0956.
[15]杭 涛,姚 磊,李丽萍,等.桑叶提取物抑菌作用的研究[J].生物学杂志,2005,22(6):22-25.
R285.5
B
1001-1528(2015)04-0876-04
10.3969/j.issn.1001-1528.2015.04.042
2014-02-04
浙江省实验动物科技计划 (2011C37097)
吴友苹 (1982—),女,医学硕士,药剂师,主要从事药物临床前安全性评价及医院药学服务。Tel:(0571)88022520,E-mail:woyaojizu@126.com
