葛根异黄酮类化合物对α-葡萄糖苷酶的抑制作用及构效分析
2015-01-17马锦锦林娟娜魏崧丞叶开和刘清霞王小康叶春玲
马锦锦, 林娟娜, 魏崧丞, 叶开和, 刘清霞, 王小康, 叶春玲
(暨南大学药学院药理学教研室,广东广州510632)
葛根异黄酮类化合物对α-葡萄糖苷酶的抑制作用及构效分析
马锦锦, 林娟娜, 魏崧丞, 叶开和, 刘清霞, 王小康, 叶春玲*
(暨南大学药学院药理学教研室,广东广州510632)
目的观察葛根异黄酮类化合物对α-葡萄糖苷酶活性的影响,并分析其构效关系。方法以蔗糖作为底物,优化反应条件,建立α-葡萄糖苷酶-蔗糖筛选模型,观察葛根异黄酮类化合物 (0.1、1、10、100μmol/L)对α-葡萄糖苷酶的抑制作用。结果大豆素、刺芒柄花素、大豆苷、3'-甲氧基大豆素、葛根素、3'-甲氧基葛根素对α-葡萄糖苷酶有一定的抑制作用,其中大豆素、刺芒柄花素在100μmol/L时对α-葡萄糖苷酶的抑制作用明显强于阿卡波糖(P<0.01),其抑制率分别达37.56%和32.11%。3'-羟基葛根素在0.1μmol/L时的抑制作用较强,但在100μmol/L的作用减弱。经构效分析发现:在大剂量时,异黄酮母核的3位和5位的取代基为羟基且其他位未被取代时,其抑制作用增强;4位取代基为糖氧基,活性将减弱;若为多糖氧基,其活性会更弱;6位为取代基为羟基,在低浓度时有较强的抑制作用,而在高浓度下作用很弱;若6位为甲氧基时,且4位被糖氧基取代时,活性减弱。结论葛根异黄酮类化合物对α-葡萄糖苷酶活性具有一定抑制作用,其中大豆素、刺芒柄花素对α-葡萄糖苷酶的抑制作用较强。
葛根;异黄酮类化合物;α-葡萄糖苷酶;抑制;构效关系
葛根(Pueraria Radix)为豆科植物野葛Pueraria Lobata(wild)Ohwi或甘葛藤Pueraria Thomsonii Benth的干燥根。葛根化学成分中的异黄酮类包括大豆素、大豆苷、3'-甲氧基葛根素、3'-羟基葛根素、刺芒柄花素、葛根素等[1]。现代药理学研究表明,异黄酮类化合物具有抗氧化,降血糖,降血脂,保护心肌,扩张冠状血管以及抗血栓等药理作用[2-3]。异黄酮类化合物对α-葡萄糖苷酶活性是否有影响,目前均尚未清楚,因此,本实验建立α-葡萄糖苷酶-蔗糖筛选模型,观察葛根异黄酮类化合物对α-葡萄糖苷酶活性的影响,并对其进行构效分析。
1 材料
1.1 药物与试剂 葛根异黄酮类化合物大豆素、大豆苷、刺芒柄花素、3'-甲氧基大豆素、葛根素、3'-羟基葛根素、大豆苷元-8-C-芹糖 (1→6)葡萄糖、3'-甲氧基葛根素,均由暨南大学中药与天然药物化学研究所提供。α-葡萄糖苷酶(α-Glucosidase)、DMSO均购自美国Sigma公司,蔗糖(Sucrose)购自广州化学试剂厂,阿卡波糖(Acarbose)购自拜耳医药保健有限公司,无水碳酸钠购自天津市大茂化学试剂厂,PBS购自博士德生物工程有限公司,葡萄糖测定试剂盒购自上海荣盛生物药业有限公司。
1.2 仪器 BL255型电子天平 (北京赛多利斯仪器系统有限公司);Tecan safire2全波长多功能酶标仪(瑞士Tecan集团);DK-S22型电热恒温水浴锅 (上海精宏实验设备有限公司);QL-901型涡旋混合器 (海门市其林贝尔仪器制造有限公司);96孔细胞培养板 (美国Corning公司);单道移液器(德国Eppendorf公司);PHS-3C数字式酸度计(上海雷磁仪器厂)。
2 方法
2.1 葡萄糖的测定 葡萄糖经葡萄糖氧化酶作用生成葡萄糖酸和过氧化氢,后者在过氧化物酶的作用下,将还原性4-氨基安替比林与酚偶联合成可被分光光度计测定的醌类化合物。用0.1 mol/L PBS(pH 6.8)将葡萄糖测定试剂盒中5.55 mmol/L葡萄糖标准液稀释成1、0.8、0.6、0.4、0.2、0.1 mmol/L,分别取不同浓度的葡萄糖溶液50μL,加入150μL葡萄糖工作液,充分混匀,置于37℃水浴15min,于酶标仪为505 nm波长处,以空白调零,检测吸光度 (A),实验重复3次。以吸光度为纵坐标,葡萄糖浓度为横坐标,绘制标准曲线。
2.2 α-葡萄糖苷酶活性反应体系的建立 反应体系总体积为200μL,在70μL PBS(pH 6.8)中加入α-葡萄糖苷酶20μL,37℃预热10 min,加入蔗糖10μL,37℃反应30 min,再加入0.1 mol/L Na2CO3溶液100μL终止反应,取上述反应液50μL,加入150μL葡萄糖工作液充分混匀,于37℃水浴15 min,于505 mm波长检测吸光度 (A)。以不加酶液作为空白对照组,其他组分保持不变,分别改变蔗糖浓度、酶浓度,优化反应体系。确定反应体系后,以阿卡波糖作为阳性药物,观察阿卡波糖在浓度为10~104μmol/L时对α-葡萄糖苷酶活性的抑制作用。
2.3 葛根异黄酮类化合物对α-葡萄糖苷酶活性的测定按 “2.2”项方法优化反应体系,结果为:PBS(pH 6.8)50μL,待测样品20μL,1 U/mLα-葡萄糖苷酶20μL,37℃预热10 min,加入0.8mmol/L蔗糖10μL,37℃反应30 min,再加入Na2CO3溶液100μL终止反应。观察葛根异黄酮类化合物 (终浓度分别为 0.1、1、10、100 μmol/L)对α-葡萄糖苷酶活性的抑制作用。实验分组及操作过程见表1,每个浓度做4个复孔,重复3次实验。
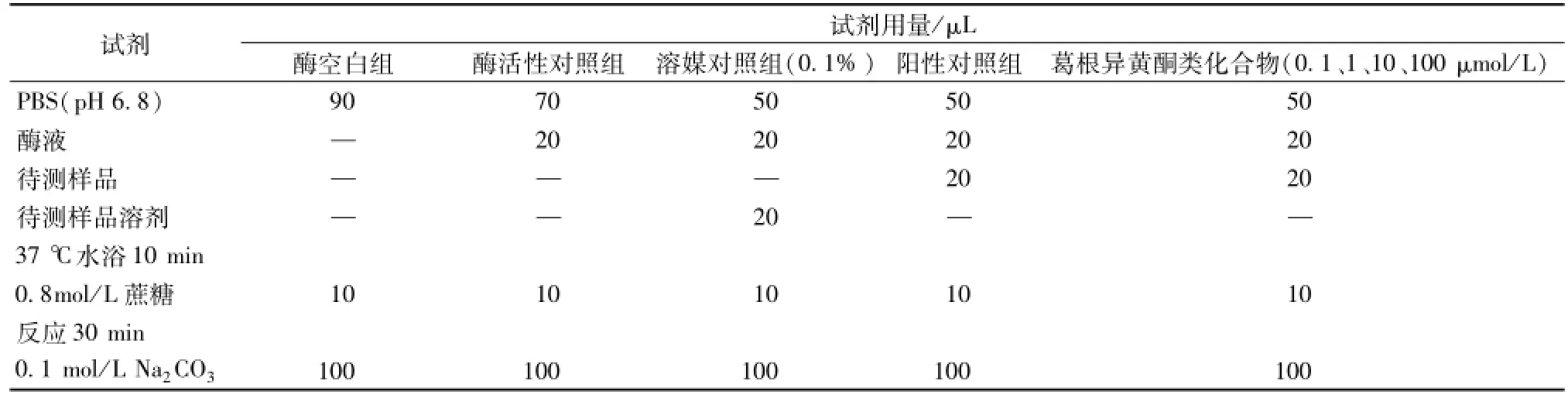
表1 α-葡萄糖苷酶活性反应体系
取上述反应液50μL,加入150μL葡萄糖工作液充分混匀,于37℃水浴15 min,于505 min波长检测吸光度(A)。样品对α-葡萄糖苷酶的抑制作用的计算公式:抑制率=(A酶活性对照组-A样品)/(A酶活性对照组-A酶空白组) ×100%。
2.3 统计学处理 采用SPSS 17.0统计软件分析,实验数据以 ()表示。不同浓度葛根异黄酮类化合物与阿卡波糖对α-葡萄糖苷酶的抑制率进行配对t检验,P<0.05为差异有统计学意义。
3 结果
3.1 反应体系的建立 按 “2.1”项方法以吸光度为纵坐标,葡萄糖浓度为横坐标,绘制葡萄糖的标准曲线 (y= 0.570 5x+0.000 7,r2=0.999 6),见图1。确定α-葡萄糖苷酶的浓度后发现,当蔗糖的浓度为0.8 mol/L时,OD值到达最高值。因此,选择0.8 mol/L蔗糖作为反应体系的底物浓度,见图2。以0.8mol/L蔗糖作为底物,当酶浓度为1.0 U/mL时,OD值开始到达平台期,葡萄糖生成量也较平缓。因此,选择1.0 U/mL的α-葡萄糖苷酶作为反应体系的酶浓度,见图3。确定蔗糖浓度和酶浓度后,改变阿卡波糖的浓度,结果发现在浓度为10~1×104μmol/L的范围内,阿卡波糖对α-葡萄糖苷酶活性的抑制作用呈剂量依赖关系,随着浓度增加,其抑制率逐渐增大,其IC50为623μmol/L,见图4。
3.2 葛根异黄酮类化合物对α-葡萄糖苷酶活性的影响

图1 葡萄糖标准曲线

图2 反应体系蔗糖的浓度
葛根异黄酮类化合物对α-葡萄糖苷酶有一定的抑制作用,阿卡波糖在100μmol/L时的抑制率为15.82%。大豆素、刺芒柄花素、大豆苷、3'-甲氧基大豆素、葛根素、3'-甲氧基葛根素对α-葡萄糖苷酶的抑制作用很强,其中大豆素、刺芒柄花素在100μmol/L时对α-葡萄糖苷酶的抑制作用明显强于阿卡波糖 (P<0.01),其抑制率分别达37.56%和32.11%。而大豆苷、3'-甲氧基大豆素、葛根素、3'-甲氧基葛根素在100μmol/L时的抑制作用增强,与阿卡波糖相比无显著性差异(P>0.05)。3'-羟基葛根素在0.1μmol/L时的抑制作用较强,但在100μmol/L的作用减弱。详见图5。

图3 反应体系酶浓度

图4 阿卡波糖对α-葡萄糖苷酶活性的影响

图5 葛根异黄酮类化合物对α-葡萄糖苷酶活性的影响
3.3 葛根异黄酮类化合物抑制α-葡萄糖苷酶的构效关系葛根异黄酮类化合物对α-葡萄糖苷酶的抑制作用可能存在以下的构效关系。
本次实验发现,在大剂量时,异黄酮母核的3位和5位取代基均为羟基且其它位未被取代时,其抑制作用增强,大豆素比刺芒柄花素或大豆苷的抑制作用更强。若4位取代基为糖氧基,活性将减弱;若为多糖氧基,其活性会更弱,大豆素的抑制作用强于葛根素,而葛根素又强于大豆苷元-8-C-芹糖 (1→6)葡萄糖;若6位取代基为甲氧基时,且4位被糖氧基取代时,活性减弱,3'-甲氧基大豆素的抑制作用强于3'-甲氧基葛根素,见表2、图6。

表2 异黄酮类化合物的化学结构

图6 异黄酮的结构式
4 讨论
糖尿病是以高血糖为显著特征的慢性代谢性疾病[4-5],餐后高血糖是2型糖尿病早期糖代谢异常的指标[6],因此,降低餐后血糖是防治糖耐量受损 (IGT)、2型糖尿病以及其并发症的重要因素[7-8]。α-葡萄糖苷酶(α-glucosidase)存在于小肠黏膜细胞刷状缘,是食物中绝大部分碳水化合物消化的一种关键酶,将多糖、双糖水解成单糖,然后被机体吸收[9-10]。
α-葡萄糖苷酶抑制剂通过抑制α-葡萄糖苷酶的活性,减少淀粉和蔗糖的水解,延缓糖的吸收,降低餐后血糖和HbA1c水平,进而改善餐后高血糖和高胰岛素血症,这对糖尿病并发症的预防及治疗具有重要的意义[11-12]。一个理想的葡萄糖苷酶抑制剂往往具有以下几个特征:含阳离子、三角形的异头碳中心、并且有一个共价连接的环形成半椅状或椅状构型,以及恰当的羟基构象。因此,带有可以质子化基团的抑制剂可以与酶优先结合,并且这个质子一般是处于环内氧的位置或取代异头碳,或是在糖苷键连接的位点[13-14]。目前上市的 α-葡萄糖苷酶抑制剂具有以上特征,主要有阿卡波糖、伏格列波糖和米格列醇,具有作用温和持久、毒副作用小的优点[15]。
本实验发现,大多数葛根异黄酮类化合物对α-葡萄糖苷酶有一定的抑制作用,其中大豆素、刺芒柄花素在100 μmol/L的作用较强,甚至强于阿卡波糖。葛根异黄酮类化合物对α-葡萄糖苷酶有不同程度的抑制作用,这可能与葛根异黄酮类化合物的化学结构有关。葛根异黄酮类化合物的基本母核为3-苯基色原酮,经构效分析发现:在大剂量时,异黄酮母核的3位和5位取代基均为羟基且其他位未被取代时,其抑制作用增强;4位取代基为糖基,其活性减弱;若为多糖基,其活性会更弱;6位取代基甲氧基时,且4位被糖氧基取代时,活性减弱。这与良好的葡萄糖苷酶抑制剂所具有的特征有些差别,但大豆素、刺芒柄花素抑制作用较强,有可能成为潜在的葡萄糖苷酶抑制剂,其有待进一步研究。本实验结果也提示,抑制α-葡萄糖苷酶,降低餐后血糖,可能也是葛根异黄酮类化合物的降血糖的作用机制之一。
[1]王治平,李卫民,高 英,等.HPLC同时测定不同产地葛根中6种主要异黄酮类成分的含量[J].中国实验方剂学杂志,2013,19(8):125-128.
[2]顾掌生,王大力.葛根素抗糖尿病大鼠心肌线粒体氧化应激损伤作用研究[J].中华中医药学刊,2010,28(10):2197-2200.
[3]Promden W,Monthakantirat O,Umehara K,et al.Structure and antioxidant activity relationships of isoflavonoids from Dalbergia parviflora[J].Molecules,2014,19(2):2226-2237.
[4]Kim C,Halter JB.Endogenous sex hormones,metabolic syndrome,and diabetes in men and women[J].Curr Cardiol Rep,2014,16(4):467.
[5]Samson S L,Garber A J.Metabolic syndrome[J].Endocrinol Metab Clin North Am,2014,43(1):1-23.
[6]Dodson C H,Simpson J,Feinstein D.Glycemic control in a medical intensive care setting:revision of an intensive care unit nurse-driven hyperglycemia protocol[J].Crit Care Nurs Q,2014,37(2):170-181.
[7]Flint A,Kapitza C,Hindsberger C,et al.The once-daily human glucagon-like peptide-1(GLP-1)analog liraglutide improves postprandial glucose levels in type 2 diabetes patients[J].Adv Ther,2011,28(3):213-226.
[8]Yuan L,Guo X,Xiong Z,et al.Self-monitoring of blood glucose in type 2 diabetic patients in China:current status and influential factors[J].Chin Med J(Engl),2014,127(2):201-207.
[9]Boath A S,Stewart D,McDougall G J,et al.Berry components inhibitα-glucosidase in vitro:Synergies between acarbose and polyphenols from black currantand rowanberry[J].Food Chem,2012,135(3):929-936.
[10]Wang Hui,Du Yang-ji,Song Hua-can.α-Glucosidase andαamylase inhibitory activities of guava leaves[J].Food Chem,2010,123(1):6-13.
[11]Pascale R,Carocci A,Catalano A,et al.New N-(phenoxydecyl)phthalimide derivatives displaying potent inhibition activity towardsα-glucosidase[J].Bioor Med Chem,2010,18(16):5903-5914.
[12]Zhang Lin,Bai Bing,Liu Xiuhua,et al.α-Glucosidase inhibitors from Chinese Yam(Dioscorea opposita Thunb.)[J]. Food Chem,2011,126(1):203-206.
[13]Mosi R,Sham H,Uitdehaag JC,et al.Reassessment of acarbose as a transition state analogue inhibitor of cyclodextrin glycosyltransferase†[J].Biochemistry,1998,37(49):17192-17198.
[14]Moorthy N S,Ramos M J,Fernandes P A.Fernandes,studies on alpha-glucosidase inhibitors development:magic molecules for the treatment of carbohydrate mediated diseases[J].Mini Rev Med Chem,2012,12(8):713-720.
[15]Kamiyama O,Sanae F,Ikeda K,et al.In vitro inhibition ofαglucosidases and glycogen phosphorylase by catechin gallates in green tea[J].Food Chem,2010,122(4):1061-1066.
R285.5
B
1001-1528(2015)04-0858-05
10.3969/j.issn.1001-1528.2015.04.037
2014-01-10
广东省高等学校科技创新重点项目 (cxzd1111)
马锦锦(1988—),女,硕士生,研究方向为内分泌药理学。Tel:13719425254,E-mail:majin569@163.com
*通信作者:叶春玲 (1963—),博士,教授,硕士生导师,研究方向为内分泌药理学。Tel:(020)85223843,E-mail:yechunling2005@163.com
