大鼠体内大脏器创伤模型涂布康派特®医用胶后生物反应观测
2015-01-16郎书惠张然然沈连忠
卜 文,李 彦,郎书惠,刘 超,丛 源,张然然,沈连忠
(山东欣博药物研究有限公司,山东临邑251500)
大鼠体内大脏器创伤模型涂布康派特®医用胶后生物反应观测
卜 文,李 彦,郎书惠,刘 超,丛 源,张然然,沈连忠
(山东欣博药物研究有限公司,山东临邑251500)
目的:评价康派特®医用胶对大鼠内脏创面止血后的安全性及其体内降解情况。方法:大鼠随机分为空白对照组,手术对照组和手术涂胶组,给胶组分别给予8μL或40 μL康派特®医用胶。术后动物进行临床症状观察,体重、摄食量测定,血常规、血清生化学、脏器重量和组织病理学检查。结果:各项指标均未见与康派特®医用胶相关毒性反应;6个月组织病理学检查可见胶体被纤维结缔组织逐渐分割,多核巨细胞和炎症细胞参与异物降解。结论本实验条件下,未见康派特®医用胶对大鼠机体有毒性作用,胶体在大鼠体内6个月开始降解。
康派特®医用胶;α-氰基丙烯酸正丁酯;SD大鼠;安全性;体内降解
α-氰基丙烯酸酯类化合物1949年 Ardis等首次合成[1],因黏合速度快,黏合力强,此类化合物广泛应用于医疗领域[2]。康派特®医用胶主要成分为α-氰基丙烯酸正丁酯,适用于手术切口和创面的粘接闭合、内脏创面止血和血管栓塞。关于α-氰基丙烯酸正丁酯医用胶内脏创面止血的安全性和体内降解的研究还没有相关的系统报道,本试验通过大鼠肝脏、肾脏和脾脏创伤后给予康派特®医用胶后大鼠的临床症状观察、体重摄食量检测和不同时期剖检后血液学、血清生学化、脏器湿重和脏器系数以及病理学检查,来考察其安全性和降解情况,为临床应用提供参考。
1 材料与方法
1.1 实验动物
SPF级SD大鼠(Sprague Dawley Rat,远交群),560只,雌雄各半;体重:♀108~139 g,♂117~161 g;购自北京维通利华实验动物技术有限公司,动物生产许可证号: SCXK(京)2012-0001,实验动物质量合格证编号: 0276012、0276479;饲养环境:山东欣博药物安全评价研究中心SPF级屏障系统(环境控制:温度:20~26℃,湿度:40~70%,换气次数:≥15次/h,动物照度:15~20 Lx,工作照度:≥150 Lx,照明时间:12 h/12 h明暗交替),实验动物使用许可证号:SYXK(鲁)2011-0013;设施使用许可证号:H20120015、H20130025;饲料和垫料均购于北京科澳协力饲料有限公司。
1.2 供试品
康派特®医用胶,批号:111201,规格型号:喷雾型1.5 mL/支,北京康派特医疗器械有限公司提供。
1.3 实验仪器
ADVIA 2120血液分析仪、Dimension RxL Max全自动生化分析仪,德国西门子;ALC-2100.2电子天平、BSA224s电子天平,德国赛多利斯;CX21BIM-SET5双目显微镜,日本奥林巴斯。
1.4 试验方法
1.4.1 分组
选用560只SD大鼠,雌雄各半,用TOXSTAT2006统计软件按体重随机分为空白对照组(A组)、肝脏手术对照组(B组)、肝脏手术涂胶1组(C组)、肝脏手术涂胶2组(D组)、脾脏手术对照组(E组)、脾脏手术涂胶组(F组)、肾脏手术对照组(G组)和肾脏手术涂胶组(H组),70只/组,雌雄各半。
1.4.2 手术及给胶方法
A组:不进行任何手术;B~H组动物麻醉后腹部手术部位备皮、消毒,依次切开皮肤和腹壁,将所需手术脏器暴露于体表外(B~D组:肝左叶下缘;E~F组:脾脏下缘1/3处;G~H组:左侧肾脏外缘),用手术刀在其表面切一深约0.1 cm长约1.0 cm的切口,无菌纱布按压2~5 min止血。B、E、G组不涂布康派特®医用胶直接将脏器退回腹腔,进行缝合。C、F、H组创面止血后涂布8μL康派特®医用胶后将脏器退回腹腔,进行缝合。D组创面止血后涂布40 μL康派特®医用胶后将脏器退回腹腔,进行缝合。所有手术动物缝合时,先将腹壁进行缝合,再缝合皮肤。缝合完成后,大鼠单笼饲养1天后再放回原饲养笼饲养观察,每天用75%的酒精棉球和碘酒棉球对腹部缝合皮肤消毒1次,直到术口愈合或剖检。
1.4.3 指标检测临床症状观察
2次/天;体重、摄食量:术后、剖检前,其它时间1次/周(术后1天、3天剖检大鼠不测摄食量);剖检:术后1、3、7、14天,1、3、6个月,5只/性别/组,动物剖检时进行血液学、血清生化学、脏器湿重(脑、胸腺、心脏、肺脏、肝脏、脾脏、肾脏、肾上腺、睾丸、附睾、子宫、卵巢)和组织病理学检查(脑、胸腺、心脏、肺脏、肝脏、脾脏、肾脏、肾上腺、膀胱、睾丸、附睾、子宫、卵巢、胃、十二指肠、空肠、结肠、盲肠、直肠)。
1.5 统计学方法
动物的体重、摄食量、血液学检查各指标、血清生化检测各指标、脏器湿重和脏器系数等计量数据用EXCEL软件进行列表,采用TOXSTAT2006进行计量数据统计分析。首先用Bartlett检验方法进行数据均一性检验,如果数据均一(P>0.05),则进行方差分析检验(F检验);如果Bartlett检验的结果显著(P≤0.05),则进行Kruskal-wallis检验。如果方差分析检验结果显著(P≤0.05),则进一步用Dunnett参数检验法进行多重比较检验;如果方差分析结果不显著(P>0.05),则统计结束。如果Kruskal-wallis检验结果显著(P≤0.05),则进一步用Dunnett非参数检验法进行多重比较检验;如果Kruskal-wallis检验结果不显著(P>0.05),则统计结束。
2 结果
2.1 临床症状
未发现与康派特®医用胶相关毒性反应的临床症状。
2.2 体重和摄食量
未发现康派特®医用胶对雌雄动物体重和摄食量有明显毒性影响。
2.3 血液学
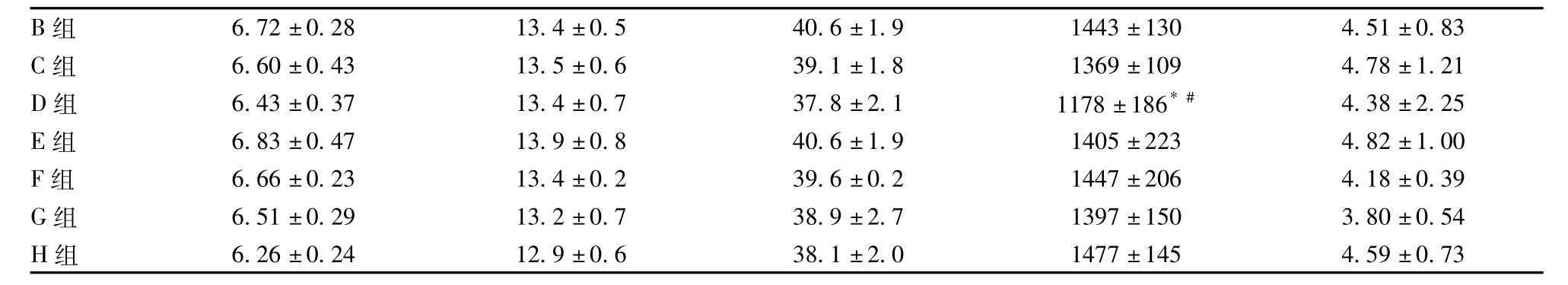
手术组动物(手术空白组和手术涂胶组)血液学个别指标在1、3和7日剖检时与空白对照组比较有统计学差异,主要以白细胞变化为主,但14日剖检时,这种差异明显减少,1个月以后剖检时所有动物的血液学指标已恢复正常,结合病理学检查未发现脏器有特异性毒性组织病理学改变,表明手术组动物血液学指标的改变是手术造成的,与康派特®医用胶无关。由于篇幅有限,只列出3日(见表1~2)和6个月(见表3~4)剖检动物的血液学结果。
表1 术后3日剖检雌鼠血液学结果(±s)

表1 术后3日剖检雌鼠血液学结果(±s)
表2 术后3日剖检雄鼠血液学结果(±s)

表2 术后3日剖检雄鼠血液学结果(±s)
(续表)
表3 术后6个月剖检雌鼠血液学结果(±s)

表3 术后6个月剖检雌鼠血液学结果(±s)
表4 术后6个月剖检雄鼠血液学结果(±s)

表4 术后6个月剖检雄鼠血液学结果(±s)
注:WBC:白细胞数量;NEU%:中性粒细胞比率;LYM%:淋巴细胞比率;MONO%:单核细胞比率;EOS%:嗜酸性粒细胞比率; BASO%:嗜碱性粒细胞比率;RBC:红细胞数量;HGB:血红蛋白含量;HCT:红细胞压积;PLT:血小板数量;%RETIC:网织红细胞百分比。上述表格中与A组比较,*P<0.05,**P<0.01;与B组比较,#P<0.05,##P<0.01;与C组比较,$P<0.05,$$P<0.01;与E组比较,▲P<0.05,▲▲P<0.01;与G组比较▼P<0.05,▼▼P<0.01。a:B组雄鼠M250自发性粒细胞白血病,白细胞数值增高。
2.4 血清生化学
手术组动物(手术空白组和手术涂胶组)血清生化学个别指标在1、3和7日剖检时与空白对照组比较有统计学差异,主要表现为AST、BUN升高,ALP、GLU降低等,但14日剖检时,这种差异明显减少,1个月以后剖检时所有动物的血清生化学指标已恢复正常,结合病理学检查未发现脏器有特异性毒性组织病理学改变,表明手术组动物血清生化学指标的改变是手术造成的,与康派特®医用胶无关。由于篇幅有限,只列出3日(见表5~6)和6个月(见表7~8)剖检动物的血清生化学结果。
表5 术后3日剖检雌鼠血清生化学结果(±s)

表5 术后3日剖检雌鼠血清生化学结果(±s)
表6 术后3日剖检雄鼠血清生化学结果(±s)
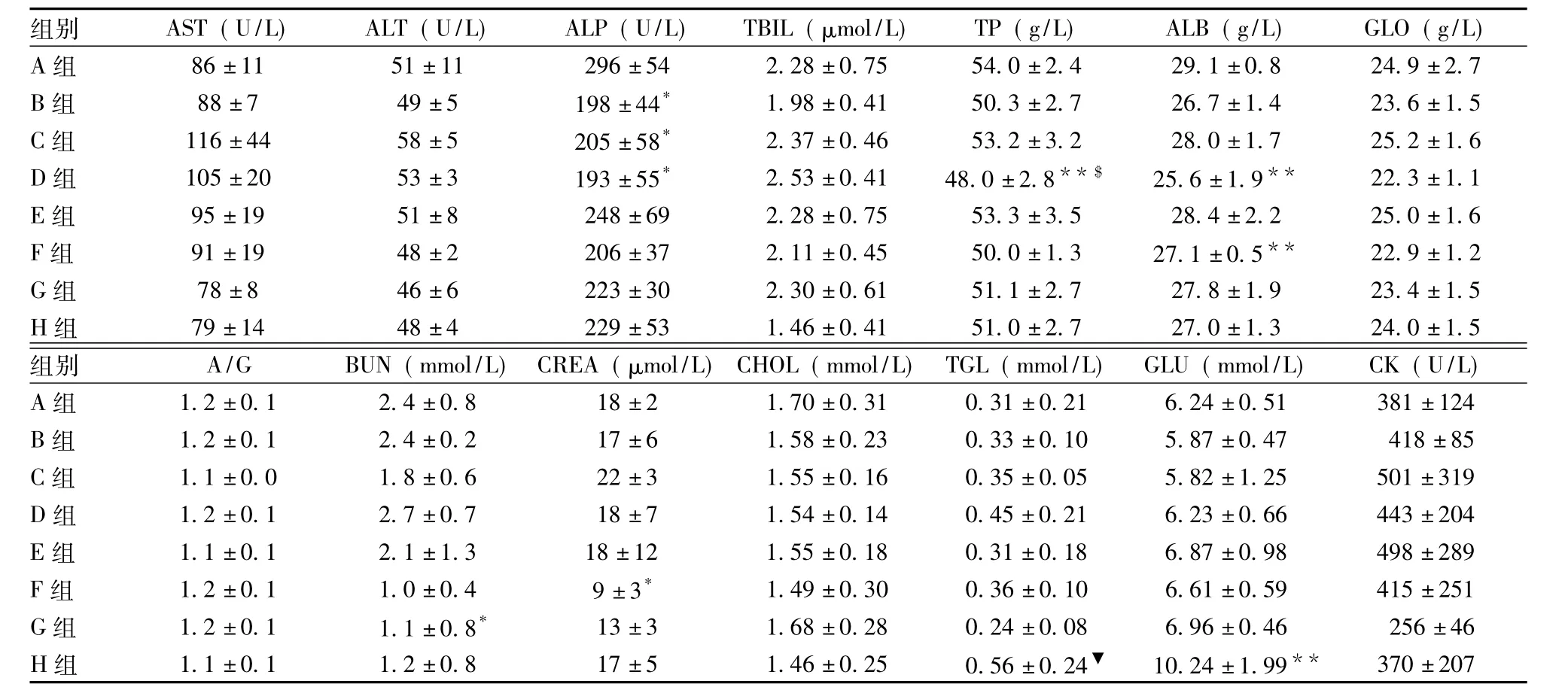
表6 术后3日剖检雄鼠血清生化学结果(±s)
表7 术后6个月剖检雌鼠血清生化学结果(±s)

表7 术后6个月剖检雌鼠血清生化学结果(±s)

(续表)
表8 术后6个月剖检雄鼠血清生化学结果(±s)

表8 术后6个月剖检雄鼠血清生化学结果(±s)
注:AST:谷草转氨酶;ALT:谷丙转氨酶;ALP:碱性磷酸酶;TBIL:总胆红素;TP:总蛋白;ALB:白蛋白;GLO:球蛋白;A/G:白球比;BUN:尿素氮;CREA:肌酐;CHOL:总胆固醇;TGL:甘油三酯;GLU:葡萄糖;CK:肌酸激酶。上述表格中与A组比较,*P<0.05,**P<0.01;与B组比较,#P<0.05,##P<0.01;与C组比较,$P<0.05,$$P<0.01;与E组比较,▲P<0.05,▲▲P<0.01;与G组比较▼P<0.05,▼▼P<0.01。b:B组雌鼠F250自发性肾母细胞瘤,谷草转氨酶数值增高;c:B组雄鼠M250自发性粒细胞白血病,谷草转氨酶数值增高。
2.5 脏器湿重和脏器系数
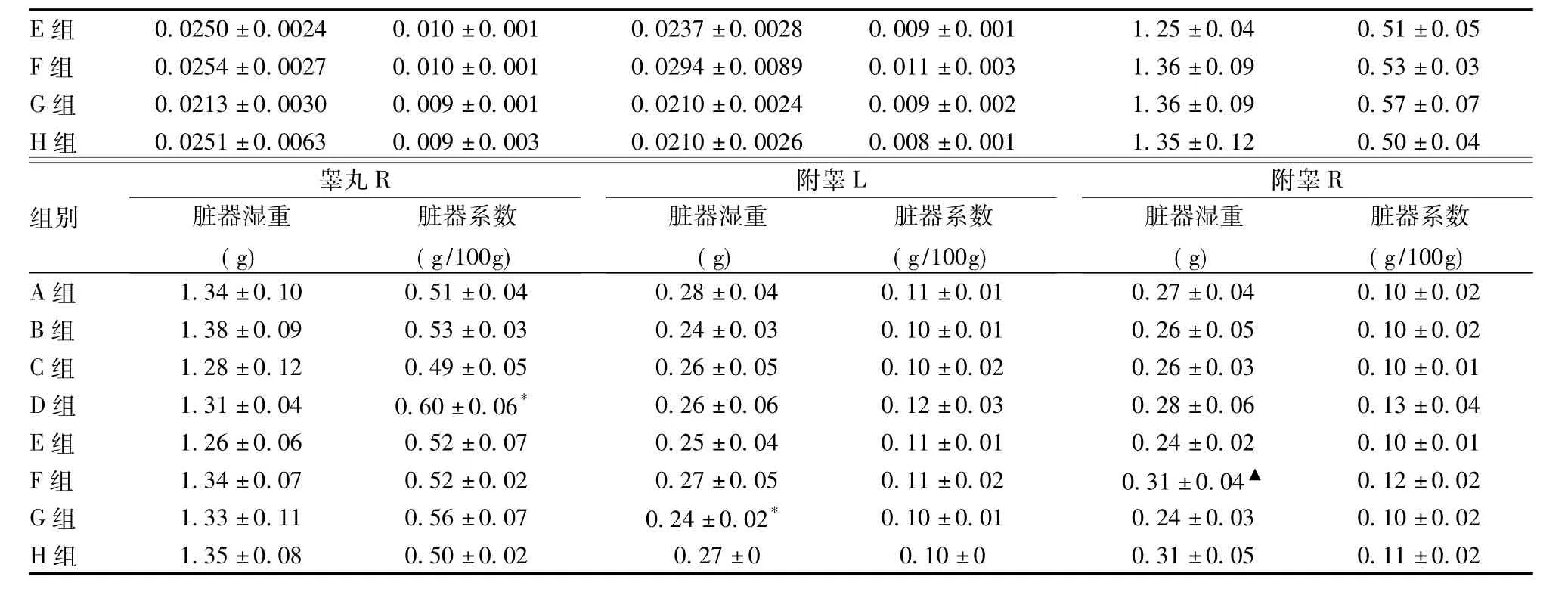
手术组动物(手术空白组和手术涂胶组)个别指标在个别时期与对照组比较有统计学差异,但变化幅度较小,且数值基本在正常值范围内,并不具有生物学改变的意义,结合病理学检查未发现脏器有特异性毒性组织病理学改变,表明手术组动物个别脏器指标的改变为动物个体差异,与康派特®医用胶无关。由于篇幅有限,只列出3日(见表9~10)和6个月(见表11~12)剖检动物的脏器湿重和脏器系数结果。
表9 术后3日剖检雌鼠脏器湿重和脏器系数(±s)

表9 术后3日剖检雌鼠脏器湿重和脏器系数(±s)
肝脏 脾脏 肾脏L 肾脏R

表10 术后3日剖检雄鼠脏器湿重和脏器系数(±s)

表10 术后3日剖检雄鼠脏器湿重和脏器系数(±s)
(续表)
表11 术后6个月剖检雌鼠脏器湿重和脏器系数(±s)

表11 术后6个月剖检雌鼠脏器湿重和脏器系数(±s)
?

(续表)
表12 术后6个月剖检雄鼠脏器湿重和脏器系数(±s)

表12 术后6个月剖检雄鼠脏器湿重和脏器系数(±s)
注:上述表格中与A组比较,*P<0.05,**P<0.01;与B组比较,#P<0.05,##P<0.01;与C组比较,$P<0.05,$$P<0.01;与E组比较,▲P<0.05,▲▲P<0.01;与G组比较▼P<0.05,▼▼P<0.01。
2.6剖检和组织病理学检查
剖检:手术组个别动物手术脏器与网膜粘连,其它各组织脏器未见与康派特®医用胶相关的大体病理学改变。
组织病理学检查:各手术组切口在手术14日恢复;各手术涂胶组14日、1个月和3个月检查可见手术切口局部被膜外见纤维结缔组织增生、包裹胶伴炎性细胞浸润;各手术涂胶组6个月后涂胶局部纤维结缔组织包裹分割胶,包裹腔内见多核巨细胞。提示手术6个月组织局部涂胶康派特®医被纤维结缔组织逐渐分割,并见多核巨细胞和炎症细胞参与异物降解。
康派特®医用胶对各手术涂胶组手术脏器涂胶部位及心脏、肺脏、胸腺、消化道、膀胱、睾丸、附睾、子宫、卵巢、肾上腺和脑等组织均未引起特异性毒性组织病理学改变。
3 讨论
自1959年美国EASTMAN KODAK公司首次推出α-氰基丙烯酸酯快速胶粘剂Eastman 910,用于粘合皮肤和止血[2],α-氰基丙烯酸酯类医用胶的应用已有50多年的历史。α-氰基丙烯酸酯类医用胶,聚合快速,固化成膜固化时间10s,固化时产生的聚合热仅为21J,具有局部刺激小,固化迅速的特点[3]。扫描电镜观察可见胶膜与组织紧密镶嵌,由直径2~3μm的纤维缠绕形成网状结构,阻止红血球通过。胶聚合体可在3~5个月降解吸收排除体外,体表应用4~10d随角化上皮脱落,其在体内仅是可逆、暂存的异物[4]。田霞等[5]曾对α-氰基丙烯酸酯进行毒理学评价,其急性毒性试验结果为:LD5013g/kg,属实际无毒级;亚急性毒性试验:皮下注射胶观察,全部病理形态学指标属正常;染色体畸变试验:大白鼠试验检查骨髓染色体畸变率属正常范围;Ta菌株诱变试验:Ta系列鼠伤寒沙门氏菌诱变试验为阴性;繁殖试验:对小白鼠未产生致畸毒性;致癌试验结果:对340只大白鼠追踪观察两年,无致癌作用;抑菌性:对金黄色葡萄球菌、白色葡萄球菌和四联球菌的抑菌带直径>20 mm,对溶血性链球菌、甲型链球菌、肺炎双球菌和大肠杆菌抑菌带直径为10~20 mm,对变形杆菌、枯草杆菌、绿脓杆菌和酵母菌无抑制带。
康派特®医用胶可在创面血液、组织液中阴离子作用下,5~15s快速聚合、固化成膜并与创面镶嵌紧密,具有粘合、止血、止痛、消炎、护创、促进愈合等功效。该试验研究中术后动物全部存活,无局部出血、感染和囊肿形成等并发症,动物未见康派特®医用胶相关毒性反应,该医用胶在大鼠体内6个月开始降解,与上述报道基本一致。
目前康派特®医用胶已广泛用于各类腺体手术的创面止血、封闭、加固;各种腹部脏器外伤或脏器病变手术切除后创面渗血的止血及创面的覆盖、封闭、减少术后并发症;各种瘘管的栓塞治疗;预防瘘的发生;疝手术补片固定及免缝粘合;术中固定脏器,术口粘合等外科手术中,安全简便可靠。
另外,康派特®医用胶粘合强度大,起效快,使用时应注意涂抹切口或伤口时动作要快。用胶量必须适中,防止切口愈合不良。
综上所述,本实验条件下,未见康派特®医用胶对大鼠机体有毒性作用,胶体在大鼠体内6个月开始降解。
[1]李伯清,杨仲春.2-氰基丙烯酸酯的制法及用途[J].化工技术与开发,2007,36(3):30-32.
[2]汪锡安,胡宁先,王庆生编.医用高分子[M].上海:科学技术文献出版社,1980.
[3]王养忠,朱豫,周丽君,等.EC耳脑胶在眶壁修复术中应用[J].中国实用眼科杂志,2004,22(5):400.
[4]夏穗生,田霞,卢永顺.新一代喷涂型福爱乐医用胶(基础研究)[J].临床外科杂志,2003,11(2):120-121.
[5]田霞,卢永顺.快速医用胶的研究[J].粘接,1991,12(12):5-8.
[6]国食药监械[2007]345号:医疗器械生物学评价和审查指南.
[7]GB/T 16886.1-2011医疗器械生物学评价,第1部分:风险管理过程中的评价与试验.
[8]GB/T 16886.2-2011医疗器械生物学评价,第2部分:动物福利要求.
BiologicalResponse Observationin Major Organ Injury Model of Rats Treated With Compont®Medical Adhesive
Bu Wen,Li Yan,Lang Shuhui,Liu Chao,Cong Yuan,Zhang Ranran,Shen Lianzhong
(Shandong Xinbo Pharmaceutical R&D,Ltd.,linyi,Shandong,251500,China)
Objective:To evaluate the safety of the visceral wound surface hemostasis in ratand degradation of Compont®medical adhesive in vivo.Methods:The rats were randomly divided into blank control group,the operation control group and the medical adhesive operation group.Rats in medical adhesive operation group were treated with 8 or 40 μL medical adhesive.Clinical observations,body weight,food intake,blood routine,serum biochemical,organ weight and histopathological examination were performed on Postoperative animals.Results:No toxic effect was observed in all indexes related with Compont®medical adhesive.Histopathological examination after administration for 6 months showed the colloid was gradually divided by fibrous connective tissue,and the degradation of foreign matter is participated by multinucleated giant cells and inflammatory cells.Conclusions:The Compont® medical adhesive were no toxic effect on the body of rats under the experimental conditions,and began to degrade in rats after 6 months.
Compont®medical adhesive;α-butyl cyanoacrylate;SD rats;Safety;Degradation in vivo
R446
A
1002-2376(2015)07-0021-09
2015-03-20
