胃癌患者术前中性粒细胞淋巴细胞比率与淋巴结转移相关性临床研究
2015-01-16杜晓辉徐迎新夏绍友
李 晨 杜晓辉 徐迎新 陈 凛 夏绍友 张 勇
胃癌(gastric cancer,GC)是最常见的消化道恶性肿瘤之一,胃癌受多种因素影响,虽诊断和治疗措施不断改进,但胃癌患者的病死率仍居高不下[1]。炎症条件建立了肿瘤发生的微环境,反之肿瘤又促进了炎性反应[2]。机体免疫状态重要的指标NLR,反映了由炎性细胞和炎性因子组成的肿瘤微环境状态,成为揭示肿瘤状态的标志物。在肠癌、肝癌等肿瘤患者的研究中已经证实,NLR 升高与肿瘤患者预后相关[3]。
本研究回顾性分析244 例施行胃癌根治术患者的临床资料,以探讨术前NLR 与胃癌淋巴结转移的关系,评价NLR 指导胃癌术中淋巴结清扫的临床价值,报道如下。
资料与方法
1.研究对象:2006 年1 月~2008 年12 月于笔者所在科室行胃癌根治术患者244 例,其中男性184 例(75.4%),女性60 例(24.6%),患者平均年龄58.3(29 ~85)岁。病例纳入标准:①术前胃恶性肿瘤诊断明确;②术后病理学诊断为根治(R0)切除;③近期均无其他脏器感染、未接受放化疗、无输血史者。病例剔除标准:病理学诊断资料不全者。采集相关病史及术前化验检查结果。手术方式及术后病理组织学检查均按日本胃癌协会《胃癌处理规约》规定施行。
2.研究方法:(1)血样收集:所有患者术前均进行常规的血常规检查,分类检验白细胞计数、红细胞计数、血小板计数、血红蛋白浓度、血细胞比容、嗜酸性粒细胞计数、嗜碱性粒细胞计数、中性粒细胞计数、淋巴细胞计数等(XE2100 全自动血液分析仪。中性粒细胞淋巴细胞比率(NLR)临界值确定:计算术前NLR,考虑到肿瘤部位、生物学特征及样本数量都会对NLR 取值产生影响,每个NLR 使用Kaplan-Meier 法切断,分层分析NLR 比值≥1、≥2、≥3、≥4、≥5 的临床价值[4]。从样本本身出发,确定NLR≥4 为临界点。将244 例患者分为两组,高NLR 组(NLR≥4),低NLR 组(NLR <4)。并计算NLR均值。(2)淋巴结收集:淋巴结的获取由手术医师根据日本胃癌规约规定,在术后迅速用剪刀和镊子从整块切除的标本中检取;所有淋巴结行石蜡切片和HE 染色,并由病理医师诊断。按照有无淋巴结转移分为有淋巴结转移组、无淋巴结转移组。按照淋巴结转移数目进行分类:N1为1 ~2 枚转移;N2为3 ~6 枚转移;N3为7 枚以上转移[5]。统计淋巴结清扫总数,按清扫总数是否≥15 枚分为两个组。统计阴性及阳性淋巴结数目,计算淋巴结转移率(度)。
3.统计学方法:统计分析采用SPSS 19.0 统计软件包,χ2检验比较高NLR 与低LNR 组之间的差异,计量资料以均数±标准差(±s)表示,计数资料采用χ2检验,以P <0.05 为差异有统计学意义。
结 果
1.术前NLR 与临床病理因素相关性分析:244例患者有淋巴结转移176 例,无淋巴结转移68 例;NLR <4 的患者179 例(73.36%),其中无淋巴结转移62 例,有淋巴结转移117 例;NLR≥4 的患者65 例(26.64%),其中无淋巴结转移6 例,有淋巴结转移59 例;术前NLR 与淋巴结转移有关(P <0.05)。两组比较发现在肿瘤浸润深度及远处转移上差异有统计学意义(P <0.05,表1)。病理结果提示,NLR≥4组与NLR <4 组比较,胃癌组织及转移淋巴结中,淋巴细胞减少(图1 ~图4)。
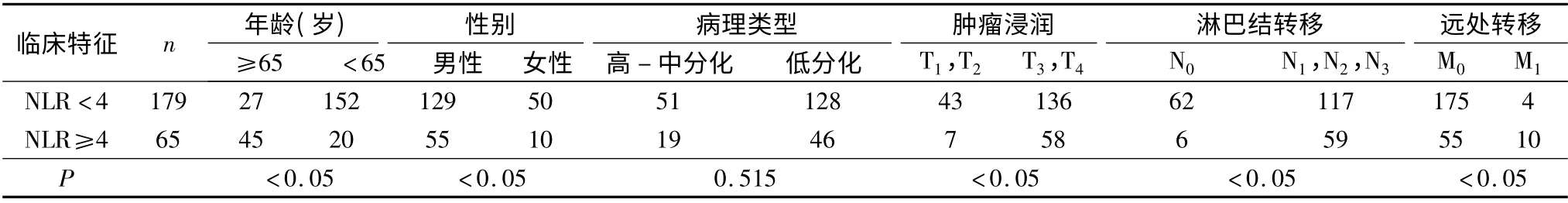
表1 患者术前NLR 与临床特征(n)

图1 NLR≥4 病例胃癌组织病理(HE,×400)

图2 NLR <4 病例胃癌组织病理(HE,×400)
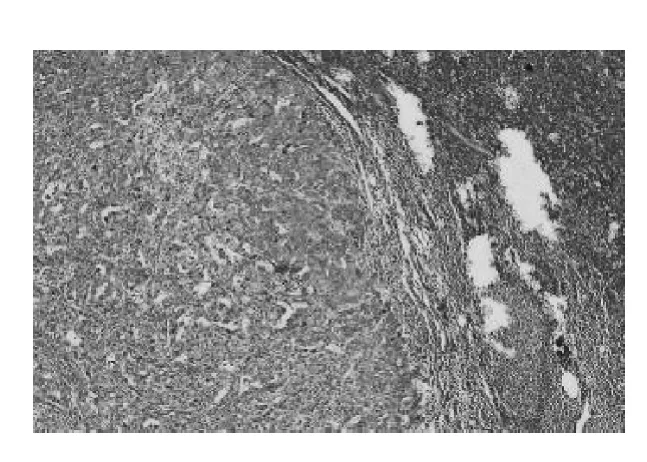
图3 NLR≥4 转移淋巴结病理(HE,×400)

图4 NLR <4 转移淋巴结病理(HE,×400)
2.术前NLR 与淋巴结转移率(度)相关性分析:244 例胃癌患者中,淋巴结清扫总数3935 枚。NLR≥4 组共发生淋巴结转移59 例,淋巴结转移率90.8%,检出阳性淋巴结数目444 枚,淋巴结转移度35.5%;NLR <4 组共发生淋巴结转移117 例,淋巴结转移率65.4%,检出阳性淋巴结数目681 枚,淋巴结转移度25.4%。比较两组淋巴结转移率(度),NLR≥4 组均高于NLR <4 组,差异有统计学意义(P <0.05,表2、图5、图6)。
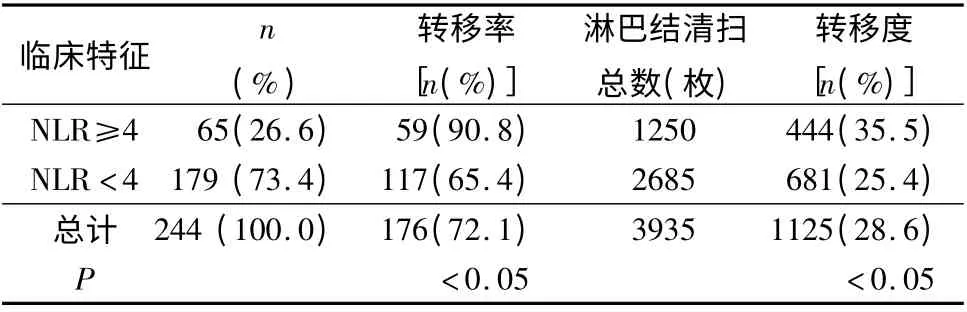
表2 术前NLR 与淋巴结转移率(度)

图5 淋巴结转移率与NLR

图6 淋巴结转移度与NLR
3.术前NLR 在不同肿瘤表型中与淋巴结转移相关性分析:244 例患者平均NLR 为2.99 ±1.59。进一步比较不同肿瘤大小、不同Borrmann 分型术前NLR 与淋巴结转移的关系,结果提示,NLR 与淋巴结转移率、转移度在不同的肿瘤大小、Borrmman 分型中呈正相关。(1)不同肿瘤大小的患者术前NLR 与淋巴结转移的关系:术前NLR 与肿瘤大小相关,肿瘤直径<4cm的胃癌患者的NLR 均值低于≥4cm 的患者,两组比较差异有统计学意义(P <0.05,表3)。(2)不同Borrmann 分型的患者术前NLR 与淋巴结转移的关系:术前NLR 与Borrmann 分型相关,溃疡浸润型的患者,术前NLR 均值高,淋巴结转移率较高。而弥漫浸润型患者,术前NLR 均值高,淋巴结转移度最高(表4)。
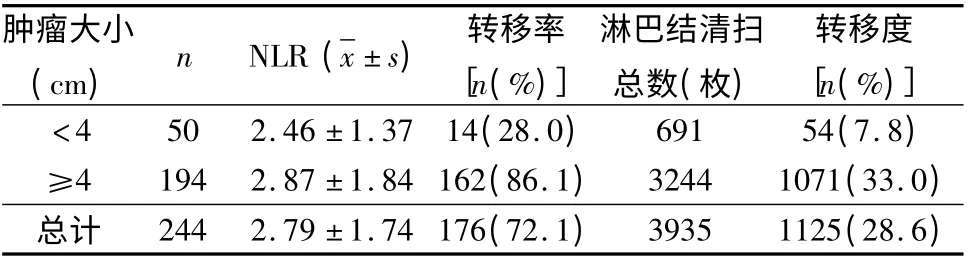
表3 不同肿瘤大小术前NLR 与淋巴结转移的关系
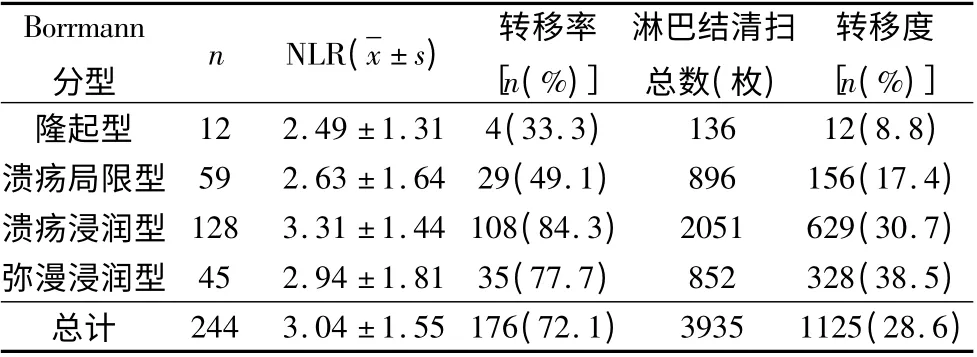
表4 不同Borrmann 分型的患者术前NLR 与淋巴结转移的关系
4.术前NLR 与淋巴结分期及淋巴结清扫范围相关性分析:患者术前NLR 与淋巴结分期相关,术前NLR 增高,淋巴结分期增高,N0期NLR 均值为2.59±1.36;N1~N3期NLR 均值2.89 ±1.36,两组相比,差异有统计学意义(P <0.05)。淋巴结转移≥N1组与N0组比较,NLR≥4 的患者比例明显增多,差异有统计学意义(P <0.01)。按切除的淋巴结数目分为≥15 枚组和<15 枚组,比较两组术前NLR 均值水平高低与淋巴结清扫的关系。244 例患者术中淋巴结清扫总数≥15 枚的194 例(占79%),NLR 均值为2.89 ±1.86;术中淋巴结清扫总数<15 枚的50 例(占21%),NLR 均值为2.49 ±1.26。比较两组术前NLR 均值水平,差异有统计学意义(P <0.05)。比较两组术前NLR 均值水平高低与淋巴结清扫的关系,术中淋巴结清扫总数术前NLR 均值偏高者>术前NLR 均值偏低者,差异有统计学意义(P <0.05)。
讨 论
胃癌的发生是一个多因素、多步骤、多阶段的过程,是生物因素、环境因素、遗传因素等共同作用的结果,其中生物因素是胃癌发生的主要原因[6]。NLR 的变化,反映了体内活性物质之间的含量比值,体现了机体的整体性和内环境变化的动向及规律。淋巴结在机体体液免疫和细胞免疫等特异免疫反应中起着重要作用,淋巴结状态反映了机体和肿瘤的相互作用。
1.NLR 与胃癌淋巴结转移相关的理论基础:淋巴结转移是胃癌的主要转移途径。受肿瘤侵犯的淋巴结往往丧失了部分或全部的免疫功能,肿瘤组织周围中性粒细胞较多的患者预后较差[7]。淋巴细胞减少,警示体内存留的免疫状态受损。本次研究发现,术前NLR 高,患者淋巴结转移率、转移度相应增高。解剖学研究认为,淋巴结状态反映了机体和肿瘤的相互作用,肿瘤可能会刺激淋巴结的增生、转移,致使淋巴结免疫功能受损。淋巴细胞是炎症细胞性间质的主要成分之一。淋巴细胞在癌组织内浸润的重要性,随着免疫学的发展,这种推断得到证实。临床资料表明:癌组织中及癌组织旁见大量的淋巴细胞浸润且密集成团,或呈灶性浸润于癌实质,期间癌组织有不同程度被分离、变性、核固缩或灶性坏死等现象。淋巴结转移癌的发生率,随着癌内淋巴细胞数减少而呈梯形上升。通过特殊方法观察,发现癌巢内的淋巴细胞多为T 淋巴细胞,即细胞免疫功能的反映,和B 淋巴细胞的“免疫监视”学说相吻合[8]。胃癌淋巴结转移与NLR 相关。NLR 升高,提示淋巴细胞的减少,对肿瘤有免疫杀伤的淋巴细胞减少适合癌细胞增生及转移。胃壁各层特别是黏膜下及浆膜下层的淋巴管网丰富,为胃癌淋巴转移提供了有利条件[9]。NLR 的生物学特性与胃组织淋巴引流的解剖学特点,是胃癌淋巴结转移与NLR 相关的理论基础。
2.NLR 预测肿瘤转移能力与肿瘤恶性表型相关的临床价值:肿瘤转移能力有赖于肿瘤本身恶性表型的变化。本研究通过观察肿瘤浸润深度、Borrmann分型及不同肿瘤大小与术前NLR 和胃癌淋巴结转移的关系发现:NLR 变化与肿瘤浸润及Borrmann 分型相关。Yasuhiro 等[10]的研究显示,胃癌淋巴结转移率随着肿瘤浸润深度的递增而增加,浸润至胃黏膜内、黏膜下、固有肌层、浆膜下层、浆膜层分别为2.3%、19.7%、31.5%、66.1%、72.4%。本研究结果显示,随着胃癌浸润深度的进展,术前NLR 均值增高,淋巴结转移率(度)也增高;溃疡浸润型的患者,术前NLR 均值高,淋巴结转移率较高。而弥漫浸润型患者,术前NLR 均值高,淋巴结转移度最高。充分认识浸润深度和淋巴结转移发生概率的关系,有利于术前手术方式的选择。按照AJCC 标准,应检查至少15 个淋巴结,手术时应尽量清扫足量的淋巴结。NLR 变化与胃癌肿瘤大小相关。Yasuda 等[11]研究观察肿瘤直径<1.0cm、1 ~4cm 的胃癌,淋巴结转移率分别为0.5%、1.0% ;而直径>4cm 的胃癌,淋巴结转移率则高达46%。本研究结果显示,肿瘤直径<4cm 的胃癌患者的NLR 均值低于≥4cm 的患者。肿瘤直径>4cm 和≤4cm 的淋巴结转移率分别为28.0%、86.1%,表明随着肿瘤增大,淋巴结转移率亦升高,此时应该注意胃周围淋巴结的清扫。NLR 升高,提示胃癌肿瘤偏大,肿瘤浸润较深,临床分期偏晚,Borrmann 分型Ⅲ、Ⅳ型患者增多。这些作为胃癌淋巴结转移的独立危险因素的数据,并不能在术前完全取得。但是回顾性研究发现,这些独立危险因素均与NLR 相关。术前NLR 对胃癌肿瘤大小、临床分期、Borrmann 分型有提示作用及一定的参考价值。
3.术前NLR 对术前淋巴结分期的提示作用:淋巴结分期(N 分期)是影响胃癌预后的重要因子,对于不同患者的疗效及预后的评估根据淋巴结分期的不同有着不同的判断[5]。目前,国际TNM 分期与日本胃癌分期在评估淋巴结分期方面仍存在分歧[12]。本研究结果显示:胃癌淋巴结转移≥N1,NLR≥4 的患者比例明显较高。这提示术前NLR 与术前淋巴结转移分期存在一定的相关性,术前NLR 升高的患者,其术前淋巴结分期也提高。因此,NLR 可以作为粗略预测淋巴结转移程度的生物学标志,可作为淋巴结分期的一种补充,以克服N 分期偏移的问题,有利于提高术前淋巴结分期的准确性,具有一定的临床实用价值。
4.术前NLR 对术中淋巴结清扫范围的指导意义:胃癌的治疗以手术为主,淋巴结清扫是胃癌手术规范化的核心。准确判断胃癌转移淋巴结,是精确手术治疗胃癌的前提。目前标准化的手术可能导致某些患者接受的是相对扩大的淋巴结清扫,承受了不必要的创伤和风险。淋巴结清扫范围的不足或者过度,都会导致不良的预后或手术并发症的增加,严重影响了手术疗效。因此,精确清扫淋巴结数目和范围,是实现最优个体化手术方案的关键[13]。本研究进一步研究了NLR 与淋巴结清扫范围是否相关,并探讨术前NLR 对术中淋巴结清扫的指导意义。回顾性研究说明,患者术前高NLR,提示淋巴结转移率高,术中淋巴结清扫范围应相应广泛。术前NLR 与淋巴结清扫范围的相关性提示,术前NLR 高低,对术中淋巴结清扫有指导意义,可以作为术前制定淋巴结清扫范围的重要参考指标之一,以避免过度清扫或清扫不足。
胃癌淋巴结转移与否,是临床最为重要的诊断、治疗参考指标。目前对术前淋巴结转移评估存在的缺陷,已成为影响临床分期准确性、制约提高患者生存率的重要原因之一。慢性炎症对肿瘤的发展尤其是侵袭转移有促进作用,NLR 是机体免疫状态重要的反映指标之一,也是反映肿瘤状态的一种简单可信的生物学标志物,为术前预测淋巴结转移程度、评估肿瘤风险、判断预后等提供了可能。
1 陈凛,张勇,卫勃,等.2335 例胃癌外科治疗的临床分析[J]. 中华胃肠外科杂志,2007,10(5):421 -422
2 Mantovani A,Allavena P,Sica A,et al. Cancer-related inflammation[J]. Nature,2008,454:36 -444
3 Gomez D,Farid S,Malik HZ,et al. Preoperative neutrephil to lymphocyte ratio as a prognostic predictor after curative resection for hepatocellular carcinoma[J]. World J Surg,2008,32:1757 -1762
4 Motomura T,Shirabe K,Mano Y,et al. Neutrophil-lymphocyte ratio reflects hepatocellular carcinoma recurrence after liver transplantation via inflammatory microenvironment[J].J Hepatol,2013,58:58-64
5 陈凛. 新版日本胃癌“处理规约"和“治疗指南”之解读. 临床外科杂志,2012,20(1):10 -11
6 Grivennikov SI,Greten FR,Karin M. Immunity,inflammation and cancer[J]. Cell,2010,140(6):883 -899
7 Satomi A,Murakami S,Matsuki M,et al.Sign ificance of increased neutrophils in patients with advanced colorectal cancer[J]. Acta Oncol,1995,34(1):69 -73
8 房良华. 现代肿瘤免疫靶向治疗[M]. 南京:东南大学出版社,2010:34 -49
9 Kojima N,Yonemura Y,Bando E,et al. Optimal extent of lymph node dissection for T1 gastric cancer,with special reference to the distribution of micrometastasis,and accuracy of preoperative diagnosis for wall invasion[J]. Hepato Gastroenterology,2008,55(84):1112-1l17
10 Yasuhiro K,Yshitaka Y,Yukihide K,et al.Lymph node metastasis in cancer of the middle-third stomach:criteria for treatment with a pylorus-preserving gastrectomy[J].Surg Today,2001,31:196 -203
11 Yasuda K,Shiraishi N,Suematsu T,et al. Rate of detection of lymph node metastasis is correlated with the depth of submucosal invasion in early stage gastric carcinoma[J]. American Cancer,1999,2:2119 -2123
12 洪骏,毕建威. 国际TNM 分期与日本胃癌分期指导意义的区别[J].中华胃肠外科杂志,2010,13(10):790 -791
13 栗东海,刘明.胃癌的淋巴结转移与清扫范围关系的探讨[J]. 现代肿瘤医学,2012,1:105 -107
