电喷雾质谱法研究Kras基因启动子区G-四链体的形成与性质
2015-01-16张士伟李卉卉杨小弟
张士伟,李卉卉,周 江,杨小弟
(1.北京大学化学与分子工程学院,北京 100871;2.南京师范大学化学与材料科学学院,江苏 南京 210046)
近年来,关于G-四链体结构与生物学相关性的研究越来越多[1]。在人类端粒[2]和很多癌基因启动子区域[3-4]均含有能够形成G-四链体的潜在富G序列。已有研究表明,G-四链体结构的形成可能对基因的转录表达有影响[5-7],因此,G-四链体结构已成为众多科学家研究的热点,并有望作为癌症治疗的新型靶点[8]。
在Kras基因启动子区域,有段富含鸟嘌呤G的核酸酶超敏感位点(NHPPE)[9-10],它对基因的转录具有重大意义。Cogoi等[11]发现,当此序列形成基因G-四链体结构后,核酸酶的活性受到影响,基因启动表达发生了下调的现象,这将影响到P21蛋白的编码与合成,进一步抑制细胞的分裂。Kras基因G-四链体的形成可协助抑制肿瘤细胞增殖,因此,Kras基因G-四链体结构的形成、稳定性以及构象特点的研究也成为肿瘤疾病治疗的新重点。
本工作以原生型Kras基因启动子区序列(KS1)及其4种突变体序列(KS2~KS5)为研究目标,采用电喷雾质谱(ESI-MS)和圆二色谱(CD)法[12-13]研究Kras基因G-四链体的形成与性质,希望为研究G-四链体的结构和生物学功能提供更多信息,同时也为相关抗癌药物的研制提供更广阔的思路和方向。
1 实验部分
1.1 主要仪器与装置
LCQ DECA XP plus电喷雾质谱仪:美国Thermo Finnigan公司产品,配有电喷雾离子源(ESI)、Xcalibur1.2数据处理系统;J-810圆二色谱仪:日本JASCO公司产品;Mastercycler nexus PCR退火及控温仪:德国Eppendorf公司产品;Seven Multi型pH计:梅特勒-托利多上海仪器有限公司产品。
1.2 主要材料与试剂
HPLC纯化的寡核苷酸序列KS1~KS5:由上海生物工程技术有限公司提供,其序列与命名列于表1;DNA储备液用Milli-Q超纯水(电阻率18.2 MΩ·cm)配制,其他实验用水均为去离子水;实验所用CH3OH、NH4OAc、KCl、NaCl均为分析纯。
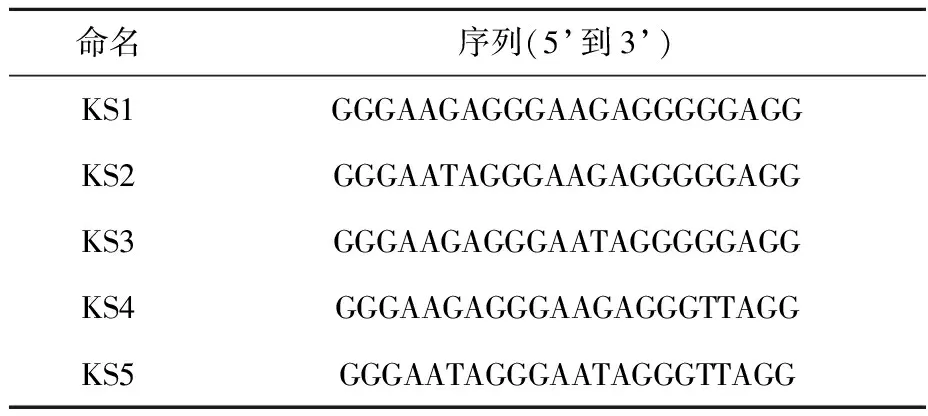
表1 实验所用DNA序列及命名Table 1 Sequences and abbreviations of DNA used in this study
1.3 样品处理
1.3.1质谱溶液 用25%CH3OH水溶液配制浓度分别为10、25、50、100 mmol/L的NH4OAc溶液,再分别用这些溶液配制浓度为5 μmol/L的DNA样品溶液,静置2 h后,用质谱采样。
1.3.2CD条件 配制2.5 μmol/L的DNA样品溶液,溶液中阳离子(NH4+、Na+和K+)浓度随条件变化而改变。除NH4OAc溶液外,其他阳离子溶液中tris-HCl浓度均为30 mmol/L。将配好的样品静置30 min后,放入PCR仪中,于90 ℃加热5 min,再以0.1 ℃/min缓慢降温至4 ℃。
1.4 实验条件
1.4.1质谱条件 电喷雾离子源,喷雾电压-2.7 kV,毛细管温度130 ℃,N2流速25 个单位,负离子扫描模式,质量扫描范围m/z1 000~2 000,进样速率2 μL/min。
1.4.2圆二色谱条件 扫描范围320~220 nm,吸收池温度20 ℃,扫描速度100 nm/min,每次进样前均采用背景溶液进行基线校准。变温实验采用固定波长温度间隔模式扫描,吸收池温度从20 ℃以2 ℃/min升至95 ℃。所得数据用Origin软件处理,Boltzmann拟合得出Tm值。
2 结果与讨论
2.1 G-四链体结构的形成
5 μmol/L KS1在10、25 mmol/L NH4OAc溶液中(含25%CH3OH)的ESI-MS图示于图1。ESI-MS结果显示,对于稳定时间相同的溶液,KS1链在10 mmol/L NH4OAc溶液中,质谱基峰是m/z1 412.71,经计算,确认其为单链DNA离子([KS1-5H+]5-)的峰,示于图1a;而当NH4OAc浓度增加到25 mmol/L时,质谱图中的[KS1-5H+]5-离子峰消失,出现的是KS1链加合2个NH4+的复合物离子峰m/z1 418.41([KS1+2NH4+-7H+]5-),示于图1b。这说明,太低浓度的NH4OAc溶液不利于G-四链体结构的形成,而高于25 mmol/L NH4OAc溶液便可诱导KS1序列形成G-四链体结构。为了进一步确定NH4+结合的特异性,逐步增加NH4OAc溶液的浓度,结果发现,在升高NH4OAc浓度时,ESI-MS谱图中基峰的位置保持不变,即仍是G-四链体离子峰[KS1+2NH4+-7H+]5-,并未检测到DNA加合多个NH4+的复合物离子峰。可见,DNA加合NH4+的数目与NH4OAc的浓度无关,这在一定程度上说明NH4+与DNA的相互结合作用并非一般的非特异性吸附,而是一种选择性的特异性结合方式,即NH4+已经嵌入到G-四分体平面层间,形成了稳定的G-四链体结构。根据加合的NH4+个数可判断,KS1链在NH4OAc溶液中形成了三层G-四链体结构[14]。

图1 5 μmol/L KS1在10 mmol/L(a)和25 mmol/L(b) NH4OAc溶液中(含25%CH3OH)的ESI-MS图Fig.1 ESI-MS spectra of 5 μmol/L KS1 in solution of 10 mmol/L (a) and 25 mmol/L (b) NH4OAc with 25% CH3OH
采用CD光谱研究了不同阳离子对G-四链体结构的诱导和影响。根据文献报道[15],当富G序列形成G-四链体结构时,其溶液的CD光谱将会出现特征吸收峰。若CD谱图中有260 nm的正吸收和240 nm的负吸收,说明形成的G-四链体为平行构象;若CD谱图中有290 nm的正吸收和260 nm的负吸收,则说明形成的G-四链体为反平行构象[15]。2.5 μmol/L的KS1链在NH4OAc、KCl、NaCl溶液中的CD光谱图示于图2。由图2可见,CD谱图在260 nm和 240 nm处均出现明显的正、负吸收峰,说明该阳离子可以促进Kras启动子G-四链体结构的形成;图中特征吸收峰的强度随着阳离子浓度的升高而增大,这说明提高阳离子浓度有利于G-四链体结构的形成。在NH4OAc溶液中,当NH4+浓度从100 mmol/L增加到150 mmol/L时,CD吸收值的变化不太明显,可见NH4OAc浓度在100 mmol/L时,溶液中2.5 μmol/L KS1转化成G-四链体结构的过程已基本达到平衡状态。而在KCl溶液中,CD吸收值随着阳离子浓度的增加而平稳升高。在NaCl溶液中,当NaCl 浓度在25~100 mmol/L范围内,CD吸收值缓慢增加;但当NaCl浓度升高到100~150 mmol/L时,CD吸收值增加幅度变大,这可能是因为高含量Na+条件有利于促进平衡向KS1形成G-四链体结构的方向移动,因此可检测到更强的CD吸收峰。值得一提的是,在K+条件下,CD图在290 nm 处有微弱的正吸收,而在Na+溶液中,290 nm处的正吸收峰消失,伴随着的是240 nm处的负吸收增强,这说明K+可促进KS1形成平行构象为主的混合构象G-四链体,而Na+则诱导KS1形成平行G-四链体结构。
2.2 G碱基突变对G-四链体结构的影响
突变体KS2序列是由KS1序列中从5’端数起的第6个G碱基突变成T碱基得到的。在ESI-MS实验中,KS2序列质谱图的基峰是DNA结合2个NH4+形成的离子峰m/z1 413.45([KS2+2NH4+-7H+]5-),示于图3a,这表明,在NH4OAc溶液中,KS2序列形成的G-四链体仍是三层结构。KS1序列中的第13个G碱基突变成T碱基后得到KS3链,KS3序列在质谱图中显示的基峰是m/z1 410.52处的DNA加合1个NH4+形成的5电荷复合物离子峰([KS3+NH4+-6H+]5-),示于图3b,这说明KS3序列G-四链体大部分已转变为两层结构。KS1序列中第18、19个G碱基突变成T碱基得到KS4链,对于突变体KS4链,ESI-MS谱图中的基峰是m/z1 408.97处的DNA加合了2个NH4+的离子峰([KS4+2NH4+-7H+]5-) ,示于图3c,可见,这两个碱基突变后,对KS1链G-四链体的层数影响并不明显。将上述几种位置的碱基同时突变,即第6、13、18、19位的G碱基均突变为T碱基后,得到的序列KS5在质谱图中的基峰是DNA加合1个NH4+的5电荷离子峰([KS5+NH4+-6H+]5-) ,示于图3d。由于KS5序列比KS1序列更加规整,同时排除了KS1序列中非连续鸟嘌呤G参与G-四链体形成的可能,因此,ESI-MS结果符合实验预想,未检测到加合2个NH4+的复合物离子峰。综合比较原生型KS1序列和几种突变体KS2~KS5序列的质谱现象,可以得出,不同位置的碱基突变对G-四链体结构的形成影响各不相同,其中以第13位的G碱基突变对G-四链体结构层数的影响最为明显。

注:1—25 mmol/L;2—50 mmol/L;3—100 mmol/L;4—150 mmol/L图2 2.5 μmol/L KS1链在NH4OAc(a)、KCl(b)、NaCl(c)溶液中的CD光谱图Fig.2 CD spectra of 2.5 μmol/L KS1 in NH4OAc (a), KCl (b) and NaCl (c) solution

图3 5 μmol/L KS2~KS5(a~d)链在25% CH3OH、50 mmol/L NH4OAc溶液中的ESI-MS图Fig.3 ESI-MS spectra of 5 μmol/L KS2-KS5 (a-d) in solution of 25% CH3OH and 50 mmol/L NH4OAc
通过CD光谱研究比较了KS1~KS5序列G-四链体结构的形成构象特点,2.5 μmol/L KS1~KS5链在NH4OAc、KCl、NaCl溶液中的光谱图示于图4。从图4可以看出:突变体KS2及KS3序列形成的G-四链体构象与KS1相近,均是平行构象为主的混合G-四链体结构;不同的是这3个序列在CD吸收强度上存在差异,KS2在260 nm处的正吸收强度与KS1相近,吸收峰发生明显下降的是KS3序列,这可能与ESI-MS谱图分析中KS3序列所形成的G-四链体层数减少有关。

注:1—KS1;2—KS2;3—KS3;4—KS4;5—KS5;图4 2.5 μmol/L KS1~KS5链在NH4OAc(a)、KCl(b)、NaCl(c)溶液中的CD光谱图Fig.4 CD spectra of 2.5 μmol/L KS1-KS5 in solution of NH4OAc (a), KCl (b) and NaCl (c)
KS4和KS5序列在3种阳离子条件下的CD光谱与KS1序列明显不同,特别是KS4序列,尽管ESI-MS实验表明其在NH4OAc溶液中形成的是三层G-四链体结构,但CD谱图却表明此G-四链体的构象已发生了明显变化,具体表现为260 nm处的正吸收消失,而在290 nm处的正吸收出现微弱的增强,这意味着KS4序列G-四链体已部分转变为反平行构象;而KS5序列在这3种阳离子条件下,CD光谱比KS4链在240 nm和290 nm处的正吸收均明显增强,且在260 nm处出现明显的负吸收,这种变化在KCl和NaCl溶液中也表现出一致的趋势,可见,KS5序列形成的构象相对于KS1序列更加偏向反平行G-四链体结构。

图5 KS1~KS5在30 mmol/L KCl、30 mmol/L tris-HCl溶液中的CD升温归一化图Fig.5 Normalized CD melting of KS1-KS5 in solution of 30 mmol/L KCl and 30 mmol/L tris-HCl
采用CD升温法对G-四链体的稳定性进行评估。将所有富G序列(KS1~KS5)分别溶解在30 mmol/L KCl和30 mmol/Ltris-HCl中,使DNA的最终浓度为2.5 μmol/L,将溶液静置30 min后,于95 ℃ PCR仪中加热5 min,然后以0.1 ℃/min降温至4 ℃。随后采用CD光谱固定波长程序升温扫描,将得到的结果归一化后用Origin作图,即得吸收值随温度的变化关系图,示于图5。对S曲线进行Boltzmann拟合,得到的X0值即为反映各序列稳定性的Tm值,列于表2。由表2可见,KS1~KS3序列的Tm值比较接近,均在75 ℃左右,说明这些序列的G-四链体结构稳定性差别不大;而KS4和KS5序列的Tm值相对于KS1序列均降低约15 ℃,可见其形成的G-四链体结构稳定性相对于原生型序列明显降低,这可能是因为原有稳定的平行构象发生了解链,新的反平行构象不够稳定。

表2 KS1~KS5序列的CD升温Tm值Table 2 Tm values of KS1-KS5
综合分析ESI-MS和CD的结果,发现Kras原生型序列KS1可以形成比较稳定的G-四链体结构,突变位点不同对Kras序列G-四链体的影响各不相同。KS2序列所形成的G-四链体层数、构象和稳定性均与KS1序列差别不大,可见KS1序列第6位的G碱基对其G-四链体结构贡献不大;虽然KS3序列形成的G-四链体构象、稳定性与KS1序列差别不大,但其所形成的G-四链体层数与KS1明显不同,说明第13位G碱基对KS1序列G-四链体结构的形成有一定的贡献,有可能动态参与了G-四链体结构的形成;KS4和KS5序列相对于KS1序列所形成的G-四链体变化最明显,不但构象转变为反平行,且稳定性也明显降低,说明KS1序列第18、19位的G碱基参与了G-四链体结构的形成。
Neidle等[17]发现,癌基因C-kit启动子区序列d(AGGGAGGGCGCTGGGAGGAGGG)在K+溶液中可以形成一种特殊结构的G-四链体,示于图6a,序列中并非处于G碱基连续序列位置的G10也参与了G-四分体平面的形成。本研究根据KS2~KS5序列碱基变化特点以及实验规律,分析KS1序列可能形成了多种结构共存的G-四链体,有一种可能是类似于C-kit序列的G-四链体结构,示于6b,序列中的G13、G18和G19均参与了G-四分体平面的形成。
3 结论
本工作利用ESI-MS和CD法验证了Kras启动子区序列KS1的G-四链体形成,结果表明,在阳离子条件下,KS1序列形成的是平行构象为主的混合构象G-四链体。基因突变实验表明,在KS1序列中,第6位G碱基几乎未参与G-四分体平面的形成,而第13、18、19位的G碱基则很有可能参与G-四分体平面的形成,从而形成一种特殊的G-四链体结构。整体看来,突变后的序列形成G-四链体的能力整体比原生型序列弱,这在一定程度上表明,生物体内一部分基因突变后所导致的癌症可能与G-四链体结构的破坏有关。
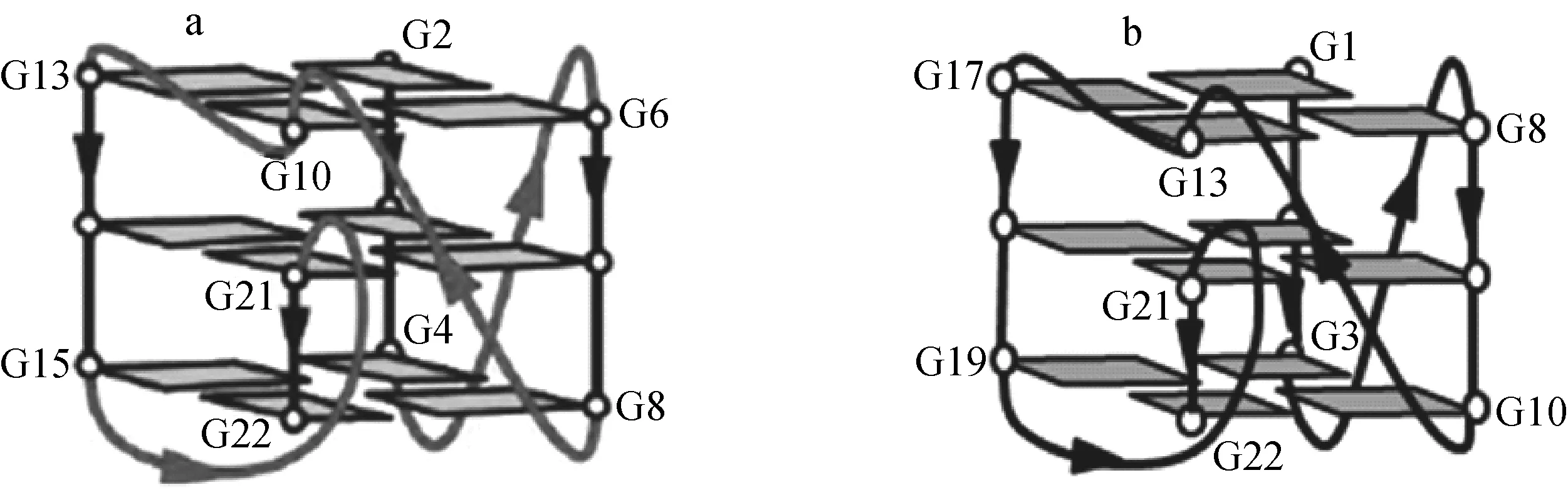
图6 C-kit序列(a)[17]和KS1序列(b)可能形成的G-四链体结构图Fig.6 NMR structure of C-kit G-quadruplex (a)[17] and possible structure of KS1 G-quadruplex (b)
[1] BURGE S, PARKINSON G N, HAZEL P, et al. Quadruplex DNA: Sequence, topology and structure[J]. Nucleic Acids Research, 2006, 34(19): 5 402-5 415.
[2] AMBRUS A, CHEN D, DAI J X, et al. Human telomeric sequence forms a hybrid-type intramolecular G-quadruplex structure with mixed parallel/antiparallel strands in potassium solution[J]. Nucleic Acids Research, 2006, 34(9): 2 723-2 735.
[3] PHAN A T, KURYAVYI V, GAW H Y, et al. Small-molecule interaction with a five-guanine-tract G-quadruplex structure from the human Myc promoter[J]. Nature Chemical Biology, 2005, 1(3): 167-173.
[4] DAI J X, DEXHEIMER T S, CHEN D, et al. An intramolecular G-quadruplex structure with mixed parallel/antiparallel g-strands formed in the human Bcl-2 promoter region in solution[J]. Journal of the American Chemical Society, 2006, 128(4): 1 096-1 098.
[5] BROOKS T A, KENDRICKS, HURLEY L, Making sense of G-Quadruplex and I-motif functions in oncogene promoters[J]. Febs Journal, 2010, 277(17): 3 459-3 469.
[6] SUN D Y, THOMPSON B, CATHERS B E, et al. Inhibition of human telomerase by a G-quadruplex-interactive compound[J]. Journal of Medicinal Chemistry, 1997, 40(14): 2 113-2 116.
[7] SIDDIQUI-JAIN A, GRAND C L, BEARSS D J, et al. Direct evidence for a G-quadruplex in a promoter region and its targeting with a small molecule to repress C-Myc transcription[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(18): 11 593-11 598.
[8] OU T M, LU Y J, TAN J H, et al. G-quadruplexes: Targets in anticancer drug design[J]. Chemmedchem, 2008, 3(5): 690-713.
[9] JORDANO J, PERUCHO M. Chromatin structure of the promoter region of the human C-K-Ras gene[J]. Nucleic Acids Research, 1986, 14(18): 7 361-7 378.
[10] HOFFMAN E K, TRUSKO S P, MURPHY M, et al. An S1 nuclease-sensitive homopurine homopyrimidine domain in the C-Ki-Ras promoter interacts with a nuclear factor[J]. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(7): 2 705-2 709.
[11] COGOI S, PARAMASIVAM M, SPOLAORE B, et al. Structural polymorphism within a regulatory element of the human kras promoter: Formation of G4-DNA recognized by nuclear proteins[J]. Nucleic Acids Research, 2008, 36(11): 3 765-3 780.
[12] 周江,袁谷. 溶液pH和阳离子对端粒G-四链体DNA形成和结构的影响[J]. 化学学报,2007,65(16):1 728-1 732.
ZHOU Jiang, YUAN Gu. Effect of pH and cations on the formation and structure of human telomeric G-quadruplex DNA[J]. Acta Chimica Sinica, 2007, 65(16): 1 728-1 732(in Chinese).
[13] 袁谷,李卉卉,周江,等. G-四链体DNA的质谱学研究:形成、性质、转变和识别[J]. 质谱学报,2008,29(增刊):106-107.
YUAN Gu, LI Huihui, ZHOU Jiang, et al. Mass spectrometry of G-quadruplex DNA: Formation, property, conversion and recognition[J]. Journal of Chinese Mass Spectrometry Society, 2008, 29(Suppl): 106-107(in Chinese).
[14] ROSU F, GABELICA V, HOUSSIER C, et al. Triplex and quadruplex DNA structures studied by electrospray mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2002, 16(18): 1 729-1 736.
[15] VORLICKOVA M, KEJNOVSKA I, SAGI J, et al. Circular dichroism and guanine quadruplexes[J]. Methods, 2012, 57(1): 64-75.
[16] LI H H, LIU Y Q, LIN S, et al. Spectroscopy probing of the formation, recognition, and conversion of a G-quadruplex in the promoter region of the Bcl-2 oncogene[J]. Chemistry, 2009, 15(10): 2 445-2 452.
[17] ANH TUAN P, VITALY K, SARAH B, et al. Structure of an unprecedented g-quadruplex scaffold in the human c-kit promoter[J]. Journal of American Chemical Society, 2007, 129(14): 4 386-4 392.
