HPLC法同时测定荷叶中金丝桃苷、异槲皮苷和槲皮素
2015-01-16朱滢涧王新财
朱滢涧, 王新财
(1.湖州市中医院,浙江湖州 313000;2.湖州市食品药品检验研究院,浙江湖州313000)
HPLC法同时测定荷叶中金丝桃苷、异槲皮苷和槲皮素
朱滢涧1, 王新财2
(1.湖州市中医院,浙江湖州 313000;2.湖州市食品药品检验研究院,浙江湖州313000)
目的建立HPLC法同时测定荷叶中金丝桃苷、异槲皮苷和槲皮素。方法荷叶甲醇提取液采用Agilent Eclipse XDB C18柱 (250 mm×4.6 mm,5μm)分析;流动相为磷酸盐缓冲液 (pH=4.0)-乙腈,梯度洗脱;体积流量1.0 mL/min;检测波长356 nm;柱温30℃。结果金丝桃苷、异槲皮苷和槲皮素分别在0.041 6~0.416 0μg、0.038 0~0.380 0μg和0.008 8~0.088 0μg范围内线性关系良好,平均回收率分别为98.7%、98.5%和100.4%,RSD分别为1.1%、1.4%和2.2%。结论该方法操作简便准确,重复性较好,可为荷叶中黄酮类化合物的开发利用提供质量评价依据。
荷叶;黄酮类化合物;金丝桃苷;异槲皮苷;槲皮素;高效液相色谱法
荷叶为睡莲科植物莲Nelumbo nucifera Gaertn的干燥叶[1],在我国大部分地区均有种植,为卫生部规定的第二批 “既是食品又是药品”的品种,广泛用于食品与药品领域。目前对荷叶的开发利用主要侧重在生物碱类成分,而黄酮类成分相对较少。文献报道,荷叶中含有较多的黄酮类化合物,具有降血脂、抑菌、抗氧化等作用[2-6],应用前景较好。然而,其中黄酮类化合物结构相似,难以分离,给检测分析带来较大难度。目前,荷叶中黄酮类化合物的检测多采用紫外可见分光光度法测定总黄酮[7-9],该方法虽然简便,但定量不准确,且无法确定黄酮的具体种类。此外,有文献报道采用高效液相色谱法测定荷叶中单一黄酮类化合物[10-13],但检测效率较低。笔者采用HPLC法同时测定荷叶中3种主要的黄酮类成分金丝桃苷、异槲皮苷、槲皮素,以弥补上述检测方法中存在的不足,可用于荷叶选育和黄酮提取工艺研究,为更有效地开发利用荷叶黄酮提供可靠的筛选方法。
1 仪器与试药
1.1 仪器 Agilent 1200高效液相色谱仪(美国Agilent公司);USC-502超声波清洗仪(上海波龙电子设备有限公司);XS205 Dual Range分析天平(瑞士METTLER TOLEDO公司)。
1.2 试药 金丝桃苷对照品 (批号111521-201004,纯度 93.9%,中国食品药品检定研究院);异槲皮苷对照品 (批号10391,纯度93.0%,德国HWIANALYTIK公司);槲皮素对照品(批号100081-200406,纯度97.3%,中国食品药品检定研究院);乙腈为色谱纯 (德国Merck公司);水为重蒸水;其他试剂为分析纯。荷叶采自湖州市南太湖地区,经浙江中医药大学药学院谷满仓博士鉴定为睡莲科植物莲的叶。
2 方法与结果
2.1 色谱条件 色谱柱为Agilent Eclipse XDB C18柱(250 mm×4.6 mm,5μm);磷酸盐缓冲液(0.2%磷酸溶液,用10%氢氧化钠溶液调节pH至4.0,即得)-乙腈为流动相,梯度洗脱 (0~45 min,8%乙腈;45~55 min,8%~18%乙腈;55~65 min,18%-30%乙腈;65~66 min,30%~8%乙腈;66~75min,8%乙腈);体积流量为1.0 mL/min;检测波长为356 nm;柱温为30℃;进样体积为5μL。
2.2 对照品溶液的制备 精密称取金丝桃苷、异槲皮苷、槲皮素对照品适量,分别置于25 mL、50 mL、100 mL量瓶中,加80%甲醇溶液溶解并稀释至刻度,制成每1 mL含金丝桃苷0.520 mg、异槲皮苷0.475mg、槲皮素0.110mg的对照品贮备液。精密量取各贮备液1 mL,置于25 mL量瓶中,加80%甲醇溶液稀释至刻度,摇匀,即得。
2.3 供试品溶液的制备 取荷叶粉末 (荷叶自然晾干后,105℃下干燥3 h,粉碎,过5号筛)0.25 g,置于50 mL量瓶中,加80%甲醇溶液30 mL,超声处理30 min,加80%甲醇溶液稀释至刻度,摇匀后,过滤,取续滤液,即得。
2.4 系统适用性试验 取上述对照品溶液和供试品溶液,按 “2.1”项下色谱条件测定,结果见图1。结果发现,供试品中其他组分不干扰金丝桃苷、异槲皮苷、槲皮素的测定,待测组分峰与其他峰分离度良好,且理论塔板数均不低于3 000。
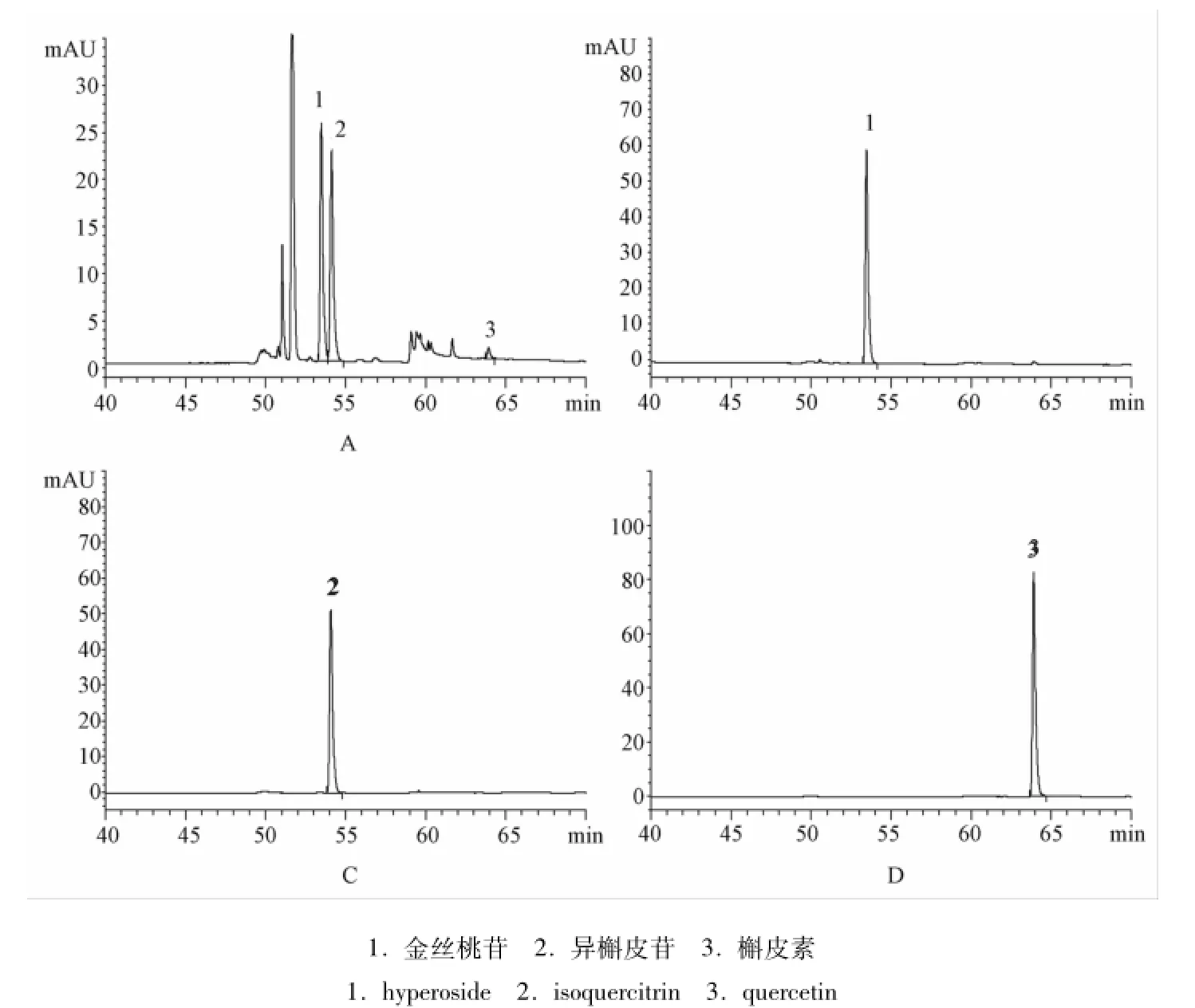
图1 供试品 (A)、金丝桃苷对照品 (B)、异槲皮苷对照品 (C)、槲皮素对照品 (D)色谱图Fig.1 HPLC chromatograms of sam ple(A),hyperoside(B),isoquercitrin(C),quercetin(D)
2.5 线性关系考察 分别精密量取对照品溶液2、4、8、14、20μL,按 “2.1”项下色谱条件测定。以对照品的峰面积为纵坐标 (Y),对照品的进样量 (μg)为横坐标 (X)进行线性回归,得回归方程金丝桃苷Y=40.9X+3.72,r=0.999 7;异槲皮苷Y=43.8X+4.73,r=0.999 5;槲皮素Y= 15.3X-1.06,r=0.999 5。表明金丝桃苷、异槲皮苷、槲皮素分别在 0.041 6~0.416 0μg、0.038 0~0.380 0μg、0.008 8~0.088 0μg浓度范围内呈良好线性关系。
2.6 精密度试验 取对照品溶液,连续测定6次,结果金丝桃苷、异槲皮苷、槲皮素峰面积的RSD分别为0.7%、0.5%、0.9%,表明精密度良好。2.7 稳定性试验 取同一供试品溶液,于0、2、4、6、8、10、12 h进样测定。结果,金丝桃苷、异槲皮苷、槲皮素峰面积的RSD分别为0.9%、1.3%、1.7%,表明精密度良好。
2.8 重复性试验 取同一样品,按 “2.3”项下方法制备6份供试品溶液,按 “2.1”项下色谱条件测定并计算。结果,金丝桃苷、异槲皮苷、槲皮素的RSD分别为0.5%、0.6%、1.7%,表明精密度良好。
2.9 加样回收率试验 精密称取已知含有量 (金丝桃苷、异槲皮苷、槲皮素分别为5.23、4.19、0.38 mg/g)的同一样品6份,每份约0.125 g,分别精密加入金丝桃苷、异槲皮苷、槲皮素对照品贮备液1.2、1.0、0.4 mL,按“2.3”项下方法制备供试品溶液,按 “2.1”项下色谱条件测定,计算金丝桃苷、异槲皮苷、槲皮素的回收率,结果见表1。

表1 加样回收率试验结果(n=6)Tab.1 Results of recovery tests(n=6)
2.10 样品的测定 取4批供试品,按 “2.3”项下方法制备供试品溶液,按 “2.1”项下色谱条件测定,按外标法计算金丝桃苷、异槲皮苷、槲皮素的量,结果见表2。
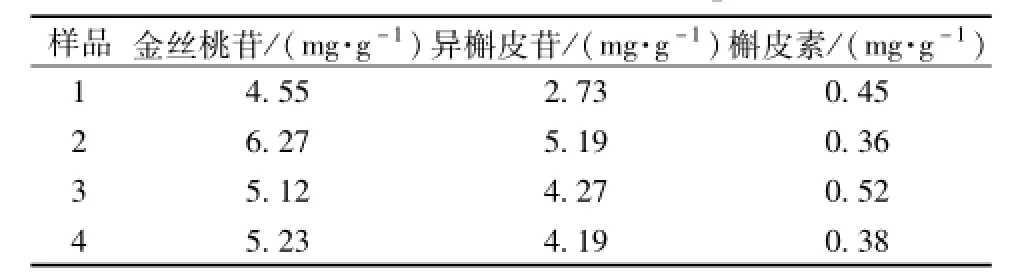
表2 样品测定结果(n=3)Tab.2 Determ ination resu lts of sam p les(n=3)
3 讨论
3.1 提取方法的选择 在供试品溶液制备过程中,选用了不同体积分数的甲醇溶液作为提取溶剂,考察了回流和超声两种方法的提取效果,结果显示80%甲醇溶液超声提取效果最佳。然后,比较了超声10、20、30 min样品中各组分的提取率,发现30min时各组分的提取率不再增加,因此选择超声时间为30 min。
3.2 色谱条件的选择 金丝桃苷和异槲皮苷分子结构相似,不易完全分离,因此选择了多组流动相进行比较。结果显示,磷酸盐缓冲液 (pH4.0)-乙腈为流动相进行梯度洗脱时,金丝桃苷和异槲皮苷出峰时间适宜,实现基线分离,并且极性较低的槲皮素也能较快出峰,缩短分析时间,提高检测效率。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:258-259.
[2]孔文琦,李严魏.荷叶活性化学成分及药理研究进展[J].中药研究与信息,2005,7(6):22-24.
[3]陈希平,杨 鹏,张阳德.荷叶提取物体外抗氧化活性研究[J].中国现代医学杂志,2009,19(15):2339-2342.
[4]赵小亮,王智民,马小军,等.荷叶化学成分研究[J].中国中药杂志,2013,38(5):703-708.
[5]张 蕾,乔旭光.荷叶黄酮对油脂抗氧化作用的研究[J].现代食品科技,2009,25(10):1180-1192.
[6]白秀君,蒋益虹,杨海燕.荷叶提取液的抑菌特性研究[J].中国食品学报,2007,7(3):90-93
[7]曹 娟,王福刚,陈 静,等.分光光度法测定不同产地荷叶药材总黄酮的含量[J].泰山医学院学报,2010,31(5):358-360.
[8]邓胜国,邓泽元,范亚苇.紫外分光光度法测定荷叶总黄酮含量[J].南昌大学学报 (理科版),2008,32(2):148-150.
[9]康 杰,金丽萍,孙晓雪.荷叶不同萃取部位总黄酮含量测定[J].黑龙江中医药,2014,43(3):51-53.
[10]高 丽,操得群,刘 芳,等.高效液相色谱法测定荷叶中槲皮素的含量[J].中国酿造,2012,31(6):175-177.
[11]赵艳波,施晓光.高效液相色谱法测定荷叶中总黄酮的含量[J].中国医院药学杂志,2010,30(20):1795-1796.
[12]唐 超,张学兰,徐 鑫.荷叶炮制金丝桃苷含量变化研究[J].山东中医药大学学报,2011,35(1):78-79.
[13]侯小龙,熊苗苗,朱红莲,等.不同品系子莲荷叶中荷叶碱和槲皮素的含量测定及品质评价[J].中国医院药学杂志,2013,33(8):666-668.
Sim ultaneous determ ination of hyperoside,isoquercitrin and quercetin from Nelumbinis Folium by HPLC
ZHU Ying-jian1, WANG Xin-cai2
(1.Huzhou Hospital of Traditional ChineseMedicine,Huzhou 313000,China;2.Huzhou Institute for Food and Drug Control,Huzhou 313000,China)
AIMTo establish an HPLC method for simultaneous determining hyperoside,isoquercitrin and quercetin from Nelumbinis Folium.METHODSThe separation of N.Folium methanolic extractwas achieved on an Agilent Eclipse XDB C18column(250 mm×4.6 mm,5μm).The mobile phase consisted of acetonitrilephosphate buffer solution(pH=4.0)in a gradient elution mode at the flow rate of 1.0 mL/min.The detection wavelength was set at356 nm,and the column temperature wasmaintained at30℃.RESULTSGood linearities of hyperoside,isoquercitrin and quercetin were obtained within the ranges of 0.041 6-0.416 0,0.038 0-0.380 0,and 0.008 8-0.088 0μg,respectively.Their average recoverieswere98.7%,98.5%and 100.4%,and the RSDs were 1.1%,1.4%and 2.2%,respectively.CONCLUSIONThe method is simple,accurate and reproducible,which can provide a basis for exploitation and utilization of N.folium.
Nelumbinis Folium;flavonoids;hyperoside;isoquercitrin;quercetin;HPLC
R284.1
:A
:1001-1528(2015)06-1276-04
10.3969/j.issn.1001-1528.2015.06.025
2014-09-25
湖州市生物医药重大科技专项重点项目 (2009ZD2003-2)
朱滢涧(1983—),女,中药师,从事中药分析与鉴定工作。E-mail:clerk2003@sohu.com
