鞣花酸体外抗人脐静脉血管内皮细胞血管生成
2015-01-16吴建明李利民邹文俊秦旭华
于 娅, 潘 嘉, 吴建明, 李利民, 李 翔, 邹文俊, 秦旭华*
(1.成都中医药大学药学院,四川成都610075;2.四川省中医药科学院,四川成都610041;3.泸州医学院药学院,四川泸州646000;)
鞣花酸体外抗人脐静脉血管内皮细胞血管生成
于 娅1, 潘 嘉2, 吴建明3, 李利民2, 李 翔1, 邹文俊1, 秦旭华1*
(1.成都中医药大学药学院,四川成都610075;2.四川省中医药科学院,四川成都610041;3.泸州医学院药学院,四川泸州646000;)
目的观察鞣花酸体外抗人脐静脉血管内皮细胞(HUVEC)血管生成作用,以及对PDGFB,JAK/STAT表达的影响。方法采用SRB法、划痕法及Matrigel体外成管实验分别考察鞣花酸对HUVEC增殖、迁移及小管形成的影响;采用逆转录-聚合酶链(RT-PCR)法、酶联免疫法(ELISA)法、免疫印迹法(Western blot)分别观察鞣花酸对HUVEC细胞PDGFB mRNA表达、对细胞上清中PDGFB分泌及对细胞中PDGFB、STAT3、p-STAT3蛋白表达水平的影响。结果鞣花酸能显著抑制HUVEC增殖、迁移和小管形成 (P<0.01或P<0.05),其增殖抑制作用呈时间和浓度依赖性,迁移和小管形成抑制作用呈剂量依赖性。同时,鞣花酸能显著降低PDGFB基因和蛋白表达水平 (P<0.01或P<0.05),降低STAT3蛋白的磷酸化水平(P<0.01或P<0.05),而对STAT3蛋白表达总量无变化。结论鞣花酸可能通过下调内皮细胞中PDGFB的表达并进一步抑制下游STAT3蛋白磷酸化来抑制血管生成。
鞣花酸;人脐静脉血管内皮细胞(HUVEC);血管生成;;PDGFB;STAT3
鞣花酸 (EA)是一种由两分子没食子酸聚合形成的小分子多酚,分布于蔷薇科、大戟科、石榴科等多种植物,尤其在五倍子、石榴、地榆等多种中药中含量丰富。近年来研究表明,鞣花酸具有良好的抗肿瘤作用,体外抑制多种肿瘤细胞的生长[1-2],进一步的研究表明,其抗肿瘤作用可能与抗肿瘤血管生成有关[3-4]。但前期关于鞣花酸抗肿瘤新生血管生成研究主要针对血管内皮生长因子(vascular endothelial growth factor,VEGF)途径,对血小板衍生因子(platelet-derived growth factor,PDGF)的表达及其关联的新生血管研究尚未见报道,更未见对其下游信号途径的研究。PDGFB是PDGF的一个亚型,与细胞膜上的受体结合激活细胞内JAK/STAT(janus kinase-signal transduction and transcription activator)等信号通路发挥抗血管生成作用,与肿瘤新生血管新生的关系密切。因此本研究采用人脐静脉血管内皮细胞(HUVEC)为模型,观察鞣花酸体外抗血管生成作用,探讨其基于PDGFB、JAK/STAT信号途径的作用机理。
1 材料和方法
1.1 试剂和仪器 鞣花酸对照品 (纯度≥98%,批号00411117,成都瑞芬思生物科技有限公司);人脐静脉血管内皮细胞(HUVEC)、内皮细胞培养基(美国Sciencell公司);Matrigal基质胶(批号2195739,美国BD公司);PDGFB、GAPDH引物(上海生工生物工程技术服务有限公司,引物序列见表1);One-step RT-PCR试剂盒(批号AK1301,大连宝生物工程有限公司);人血小板衍化生长因子B(PDGF-B)ELISA试剂盒(批号E00951,上海硕联生物科技有限公司);胞浆和核蛋白提取试剂盒 (批号20140704,南京凯基生物科技发展有限公司);PDGFB(批号B2013)、STAT3(批号10913)、p-STAT3(Tyr705,批号F0413)、β-actin抗体 (批号F2112,美国Santa Cruz公司);山羊抗小鼠免疫球蛋白G(IgG,批号112438,北京中杉金桥生物技术有限公司)。CO2培养箱 (日本Sanyo公司);倒置相差显微镜 (日本Nikon公司);多功能酶标仪(美国PerkinElmer公司)、PCR仪(美国Thermo Fisher Scientific公司)。
1.2 实验方法
1.2.1 细胞培养 采用EGM培养基(含5%新生胎牛血清、双抗、ECGS),于37℃、5%CO2、饱和湿度的培养箱中培养HUVECs细胞,2~3 d更换一次培养基,取对数生长期细胞用于实验。
1.2.2 SRB法检测HUVEC增殖能力 细胞接种于96孔培养板中,5 000个/孔,次日更换新鲜培养基并加药,阳性药索拉菲尼 (简写为saf)终浓度为10μmol/L,鞣花酸终质量浓度为20、10、5 μg/mL,同时设置空白组,每组6个复孔,常规培养。分别于0、24、48、72 h每孔加入50μL TCA溶液4℃固定细胞1 h,去离子水冲洗5遍,晾干;每孔加入0.4%的SRB染色液50μL,室温染色30 min,1%乙酸冲洗5次,晾干;每孔加入Trisbase碱液200μL,室温摇床充分溶解,540 nm处测吸光度。细胞增殖百分率=[(TX-T0)/(C-T0)]× 100%,其中TX为药物作用终点的平均吸光度,T0为药物作用前的平均吸光度,C为空白组终点的平均吸光度。
1.2.3 划痕法检测HUVEC迁移能力 铺板前,在培养板的背面用marker笔均匀地划3道横线。细胞接种于6孔板中,30万/孔,8 h后,吸弃培养基,PBS洗3次,过夜饥饿细胞 (加含2%FBS、双抗的培养基)。次日,吸弃培养基,PBS冲洗3次。直尺比着,用无菌的枪头在每孔细胞生长单层相同位置,与板底横线垂直地做一道划痕,PBS轻轻冲洗划去的细胞,加入新鲜饥饿培养基并加药。索拉菲尼终浓度为5μmol/L,鞣花酸终质量浓度分别为20、10、5μg/mL,同时设空白组。直线与划痕相交处作为划痕宽度测量点,40×拍照,每孔3张。20 h后,测量点处拍照,方法同0 h。IPP软件处理图片,计算划痕宽度,每组平均值作为该孔划痕宽度,重复3次。迁移距离为0 h划痕宽度减去20 h划痕宽度。
1.2.4 Matrigel体外成管实验检测HUVEC小管形成能力 基质胶4℃过夜融化,预冷的无血清培养基1∶1稀释基质胶,50μL/孔铺于96孔培养板中,37℃使其充分凝固备用。将含药的细胞悬液接种于基质胶包被好的培养板中,索拉菲尼终浓度为10μmol/L,鞣花酸终质量浓度分别为20、10、5μg/mL,同时设置空白组,每组3个复孔,常规培养。6 h后,40×镜下观察并拍照,每孔随机选择3处拍照,IPP软件计算小管长度,平均值作为该组小管长度,重复3次。
1.2.5 RT-PCR法检测HUVEC中PDGFB mRNA的表达 细胞接种于6孔培养板中,次日更换饥饿培养基,4 h后更换完全培养基并加药,鞣花酸终质量浓度分别为20、10、5μg/mL,同时设置空白组。16 h后采用Trizol试剂提取细胞总RNA,参照RT-PCR试剂盒说明书扩增目的基因,序列:正向5'-TGCGGA AGA CAA TCT-3',反向5'-TAA ATA ACC CTG CCC ACA CAC T-3'。反应条件:50℃、30 min(逆转录);94℃、2 min,94℃、30 s,56℃、30 s(扩增),28个循环;72℃、5 min(最后延伸)。同时设置内参基因GAPDH的扩增。产物进行2%琼脂糖凝胶电泳,拍照,Quantity One软件分析灰度值,采用半定量方法 (目的基因/GAPDH)计算目的基因表达水平。
1.2.6 ELISA检测HUVEC上清中PDGFB蛋白的分泌 接种及加药方法同 “1.2.5”项,加药24 h后吸取上清,2 000 r/min离心15 min,取上清按试剂盒说明书进行ELISA实验,每组设置3个复孔,平均值作为该组的吸光度。
1.2.7 Western blot检测HUVECs中PDGFB、STAT3、p-STAT3蛋白的表达 接种及加药方法同“1.2.5”项,加药24 h后按试剂盒说明书提取胞浆蛋白;BCA法测定蛋白浓度;变性后进行SDSPAGE电泳;将蛋白转移至PVDF膜上;5%脱脂奶粉室温摇床上封闭2 h,PBST洗膜3次,每次10 min;加入用PBST稀释的PDGFB(1∶500)、STAT3(1∶1 000)或p-STAT3(1∶500)抗体,4℃过夜孵育,次日PBST洗膜3次,每次10 min;加入辣根过氧化物酶标记的二抗,室温孵育2 h,PBST洗3次,每次10 min;ECL发光,Quantity One软件分析灰度值。
1.2.8 统计学方法 实验数据采用以均数±标准差(x±s)表示,数据分析采用SPSS 18.0统计软件包处理,组间均数比较采用单因素方差分析,P<0.05则表示差异有统计学意义。
2 实验结果
2.1 鞣花酸对HUVEC的增殖影响 随着鞣花酸质量浓度的增加,细胞增殖率降低 (P<0.01或P<0.05),呈现剂量依赖性。随着鞣花酸作用时间增长,细胞的增殖率降低,呈现时间依赖性。阳性药索拉菲尼HUVEC的增殖率小于鞣花酸各剂量组,见表2。
2.2 鞣花酸对HUVEC的迁移能力的影响 与空白组比较,鞣花酸20、10、5μg/mL剂量组HUVEC细胞的迁移距离显著缩短 (P<0.01),且随着药物质量浓度增加,细胞的迁移距离降低,鞣花酸对HUVEC迁移能力的抑制作用呈剂量依赖性,见表3,图1。
2.3 鞣花酸对HUVECs的小管形成的影响 与空白组比较,鞣花酸20、10、5μg/mL剂量组HUVEC细胞形成的小管总长度显著降低 (P<0.01),且随着药物质量浓度增加,小管总长度降低,鞣花酸对HUVEC细胞小管形成能力的抑制作用呈剂量依赖性。空白组细胞能相互连接,形成较多、较长的 “管道样”结构,而鞣花酸处理后,细胞形成“管道样”结构能力减弱,小管较短且不连续,见表4、图2。

表3 鞣花酸对HUVEC迁移的影响(x±s,n=3)Tab.3 Effect of EA on the m igration of HUVEC in vitro(x±s,n=3)
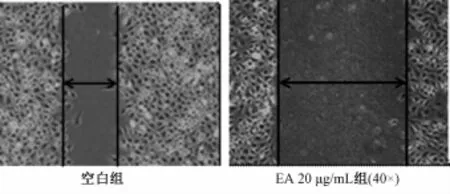
图1 鞣花酸对HUVEC迁移的影响Fig.1 Effect of EA on them igration of HUVEC in vitro

表4 鞣花酸对HUVEC小管形成的影响(x±s,n=3)Tab.4 Effect of EA on the tube formation of HUVEC in vitro(x±s,n=3)

图2 鞣花酸对HUVEC小管形成的影响Fig.2 E ffect of EA on tube formation of HUVEC in vitro
2.4 鞣花酸对HUVEC中PDGFBmRNA表达的影响 与空白组比较,鞣花酸20、10μg/mL剂量组PDGFB条带明显变暗。半定量分析结果显示,鞣花酸20、10μg/mL剂量组PDGFBmRNA表达水平下降(P<0.01),鞣花酸5μg/mL剂量组无显著抑制作用,各组内参基因GAPDH条带基本一致,见表5、图3。
2.5 鞣花酸对HUVEC上清中PDGFB分泌的影响
与空白组比较,鞣花酸20、10μg/mL剂量组HUVEC细胞培养上清液中PDGFB水平下降(P<0.01),鞣花酸5μg/mL剂量组无显著抑制作用,见表6。

表5 鞣花酸对HUVEC细胞PDGFB m RNA表达的影响(x±s,n=3)Tab.5 E ffect of EA o on them RNA expression of PDGFB(x±s,n=3)
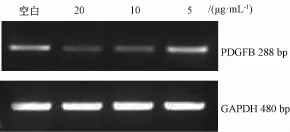
图3 鞣花酸对HUVEC细胞PDGFB m RNA表达的影响Fig.3 Effect of EA on themRNA expression of PDGFB

表6 鞣花酸对HUVEC上清中PDGFB分泌的影响(x± s,n=3)Tab.6 Effect of EA on the secretion of PDGFB(x±s,n=3)
2.6 鞣花酸对HUVEC中PDGFB、p-STAT3、STAT3表达的影响 鞣花酸20、10、5μg/m L剂量组PDGFB蛋白条带减弱,20、10μg/mL剂量组p-STAT3蛋白条带减弱。半定量灰度值分析结果显示,鞣花酸20、10、5μg/mL剂量组PDGFB蛋白表达水平均显著下降 (P<0.01或P<0.05),同时鞣花酸20、10μg/mL剂量组p-STAT3水平显著下降 (P<0.01或P<0.05),鞣花酸各剂量组对STAT3蛋白表达水平无影响,各组管家蛋白β-actin条带基本一致,见表7、图4。
3 讨论
近年来,从天然植物或中药中寻找新型抗肿瘤血管生成单体成分是抗肿瘤研究的热点,许多中药单体成分显示具有良好的抗血管生成作用,包括葫芦素E[5]、百里香醌[6]、人参皂苷Rg3[7]等。本研究结果表明,鞣花酸体外能显著抑制HUVEC细胞增殖、迁移、成管3个重要环节从而发挥抗血管生成作用。

表7 鞣花酸对HUVEC细胞中PDGFB、p-STAT3、STAT3表达的影响(x±s,n=3)Tab.7 Effect of EA on the expressionof PDGFB,p-STAT3,STAT3(x±s,n=3)
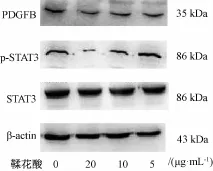
图4 鞣花酸对HUVEC细胞中PDGFB、p-STAT3、STAT3表达的影响Fig.4 Effect of EA o on the expression of PDGFB,p-STAT3,STAT3
血管的新生是一个连续、复杂的过程,主要包括①细胞外基质的降解;②血管内皮细胞的增殖、迁移和小管形成;③血管平滑肌细胞和周细胞 (合成为壁细胞)的增殖、迁移并包围血管内皮细胞进而形成稳定成熟的新生血管。PDGFB作为重要的促血管生成因子,其主要通过以下三个方面发挥促血管生成作用:第一,作用于血管内皮细胞,促进其增殖、迁移及小管形成[8];第二,与VEGF、bFGF等促血管生成因子发挥协同作用[9];第三,PDGFB促进壁细胞的增殖[10-11],募集其向新生血管迁移,包围血管内皮细胞,进一步形成成熟和稳定的新生血管网壁[12]。同时也有研究表明[13],即使血管内皮细胞凋亡,壁细胞也能在PDGFB等促血管生成因子的作用下单独开启血管生成效应。STAT家族包括STAT1-6,其中STAT3在PDGFB介导的血管新生中发挥重要作用。PDGFB与其受体结合,引发受体磷酸化并形成二聚体,激活细胞内JAK/STAT途径,并进一步激活STAT3磷酸化(p-STAT3)形成活性形式,转入细胞核调节血管生成因子的表达,从而介导血管新生。本研究结果表明,鞣花酸组PDGFB基因和蛋白的表达下降,同时p-STAT3水平下降,提示鞣花酸可能通过抑制PDGFB表达,进一步抑制STAT3磷酸化发挥抗血管生成作用。
Wang、Zhao等[3-4]研究表明,鞣花酸通过抑制VEGF的表达、VEGFR的磷酸化,进一步抑制下游Ras-MARK信号途径中JNK、ERK、AKT的磷酸化发挥抗血管生成作用。本研究结果进一步表明,鞣花酸同时具有抑制PDGFB的表达,抑制JAK/ STAT信号途径中STAT3的磷酸化从而发挥抗血管生成的作用。鞣花酸的抗血管生成作用与其同时抑制VEGF、PDGFB及其受体,并进一步抑制下游Ras-MARK、JAK/STAT信号途径有关,其抗血管生成作用具有多靶点、多途径的特点 (见图5)。本研究结果进一步阐明了鞣花酸的抗血管生成机制,为鞣花酸后续研究与开发奠定基础。

图5 鞣花酸抗血管生成机理图Fig.5 Mechanism of ellagic acid on angioenesis
[1]Weisburg JH,Schuck A G,Reiss SE,et al.Ellagic acid,a dietary polyphenol,selectively cytotoxic to HSC-2 oral carcinoma cells[J].Anticancer Res,2013,33(5):1829-1836.
[2]EdderkaouiM,Luqea A,Hui H,et al.Ellagic acid and embelin affect key cellular components of pancreatic adenocarcinoma,cancer,and stellate cells[J].Nutr Cancer,2013,65(8):1232-1244.
[3]Wang N,Wang Z Y,Mo S L,et al.Ellagic acid,a phenolic compound,exerts anti-angiogenesis effects via VEGFR-2 signaling pathway in breast cancer[J].Breast Cancer Res Treat,2012,134(3):943-955.
[4]Zhao M,Tang SN,Marsh JL,et al.Ellagic acid inhibits human pancreatic cancer growth in Balb c nudemice[J].Cancer Lett,2013,337(2):210-217.
[5]Dong Y,Lu B,Zhang X,et al.Cucurbitacin E,a tetracyclictriterpenes compound from Chinesemedicine,inhibits tumor angiogenesis through VEGFR2-mediated Jak2-STAT3 signaling pathway[J].Carcinogenesis,2010,31(12):2097-2104.
[6]Yi T,Cho SG,Yi Z,et al.Thymoquinone inhibits tumor angiogenesis and tumor growth through suppressing AKT and extracellular signal-regulated kinase signaling pathways[J].Mol Cancer Ther,2008,7(7):1789-1796.
[7]Liu T G,Huang Y,Cui D D,et al.Inhibitory effect of ginsenoside Rg3 combined with gemcitabine on angiogenesis and growth of lung cancer in mice[J].BMC Cancer,2009,9(250):2407-2409.
[8]Marx M,Perlmutter R A,Madri JA.Modulation of platelet-derived growth factor receptor expression inmicrovascular endothelial cells during in vitro angiogenesis[J].JClin Invest,1994,93(1):131-139.
[9]Guo S F,Yang X H,Cheng Y X,et al.bFGF and PDGF-BB have a synergistic effect on the proliferation,migration and VEGF releaes of endothelial progenitor cells[J].Cell Bio Int,2011,35(5):545-551.
[10]Park E S,Lee K P,Jung SH,et al.Compound K,an intestinal metabolite of ginsenosides,inhibits PDGF-BB-induced VSMC proliferation and migration through G1 arrest and attenuates neointimalhyperplasia after arterial injury[J].Atherosclerosi,2013,228(1):53-60.
[11]Wang H,Yin Y,Li W,et al.Over-expression of PDGFR-β promotes PDGF-induced proliferation,migration,and angiogenesis of EPCs through PI3K/Akt signaling pathway[J].PLoS One,2012,7(2):e30503.
[12]Hellström M,Kalén M,Lindahl P,et al.Role of PDGF-B and PDGFR-beta in recruitment of vascular smooth muscle cells and pericytes during embryonic blood vessel formation in the mouse[J].Development,1990,126(14):3047-3055.
[13]Bergers G,Benjamin L E.Tumorigenesis and the angiogenic switch[J].Nat Rev Cancer,2003,3(6):401-410.
Ellagic acid inhibits the angiogenesis of HUVEC in vitro
YU Ya1, PAN Jia2, WU Jian-ming3, LILi-min2, LIXiang1, ZOUWen-jun1, QIN Xu-hua1*
(1.Chengdu University of Traditional Chinese Medicine,Chengdu 610075,China;2.Sichuan Academy of Chinese Medicine Sciences,Chengdu 610041,China;3.Luzhou Medical College,Luzhou 646000,China)
AIMTo observe the anti-angiogenesis effect of ellagic acid in vitro on human umbilical vein endothelial cell(HUVEC)and to investigate the influence of ellagic acid on PDGFB,JAK/STAT signal pathway.METHODSThe effect of ellagic acid on the proliferation,migration and tube formation of HUVEC were studied using SRB assay,wound healing assays,and the tube formation,respectively.RT-PCR and ELISA assays were used to investigate the effects of ellagic acid on the expression of PDGFBmRNA and the secretion of PDGFB in the supernatant.The expression of PDGFB,STAT3 and p-STAT3 were studied using Western blot analysis.RESULTSEllagic acid inhibited the proliferation,migration and tube formation of HUVEC significantly(P<0.01 or P<0.05),the proliferation presented in a dose-dependent and time-dependentmanner and migration and tube formation of HUVEC in a time-dependentmanner,respectively.Meanwhile,ellagic acid down-regulated the gene and protein expression of PDGFB(P<0.01 or P<0.05)and inhibited the phosphorylation of STAT3(P<0.01 or P<0.05)in HUVECwhile had no influence on total STAT3 protein expression.CONCLUSIONEllagic acid can effectively inhibit the angiogenesis of HUVEC in vitro,which may be related to decreasing expression and secretion of PDGFB and phosphorylation of STAT3 in vascular endothelial cells.
ellagic acid;HUVEC;angiogenesis;PDGFB;STAT3
R966
:A
:1001-1528(2015)06-1181-06
10.3969/j.issn.1001-1528.2015.06.006
2014-10-16
四川省科技厅项目 (2012JY0037)
于 娅(1990—),女,硕士,从事中药临床与应用研究。Tel:13730834400,E-mail:yuyaangela@163.com
*通信作者:秦旭华 (1972—),女,博士,副教授,从事中药临床理论及应用研究。Tel:13398199519,E-mail:qxhjsr@120.com
