TCF7L2 在2 型糖尿病大鼠胰岛中的表达及影响
2015-01-16桂书彦陈立波
桂书彦 韩 瑾 叶 强 李 静 陈立波
近年较多的研究显示Wnt 信号通路在生物的代谢平衡调节以及糖尿病等其他代谢相关疾病中有着重要的影响和作用。2006 年关于TCF7L2 单核苷酸多态性与2 型糖尿病发病易感性研究的新发现,已经再次激起了Wnt 信号通路与胰岛β 细胞功能及糖代谢调节的研究热潮。
前期,笔者采用小鼠来源的NIT -1 胰岛β 细胞进行研究,通过重组蛋白Wnt3a 外源性激活经典的Wnt/β-catenin/TCF 通路,增加了细胞内β -catenin的蛋白水平和下游TCF7L2 的转录活性,通过调节与β 细胞生长和功能密切相关的靶基因的表达实现对β 细胞的增殖、凋亡和功能的调节作用,参与2 型糖尿病的发病机制。但是,在这些调节作用的具体实现中有诸多的分子生物学机制仍是未知和假想的,有待于进一步的研究来探讨和证实。在本研究中,笔者拟尝试通过诱导2 型糖尿病大鼠模型,研究Wnt 信号通路中关键蛋白β -catenin、TCF7L2 的转录与表达,了解Wnt 通路与2 型糖尿病大鼠发病机制的关联。
材料与方法
1.材料:35 只雄性Wistar 大鼠及高脂高糖饲料购自广东省医学实验动物中心。链脲佐菌素(STZ)、牛血清白蛋白(BSA)购自美国Sigma 公司;Western 及IP 裂解液、BCA 蛋白浓度测定试剂盒、TUNEL 细胞凋亡检测试剂盒(显色法)、DAPI、Alexa Fluor 488 标记的山羊抗兔IgG(H +L)、Cy3 标记的山羊抗小鼠IgG(H +L)、小鼠抗β -actin 单克隆抗体等相关试剂购自碧云天生物技术研究所;兔抗TCF7L2 多克隆抗体、兔抗β-catenin 单克隆抗体购自Abcam 公司。小鼠抗insulin单克隆抗体、兔抗Ki67 多克隆抗体购自武汉谷歌生物科技有限公司。
2.分组及模型建立:雄性Wistar 大鼠35 只,体重200 ~220g,喂养在南方医科大学珠江医院动物实验中心,自由进食、饮水,室内温度20 ~25℃,湿度40% ~50%。随机分两组,每组10 只,正常对照组(NC 组),给予普通饮食,2 组25只,造模实验组,给予高脂高糖饮食(高脂高糖饲料:其比例为猪油15%,蔗糖20%,蛋黄3%,基础饲料62%。购于广东省医学实验动物中心)。喂养8 周后,实验组进行造模。隔夜禁食12h,实验组大鼠给予用0.1mmol/L 枸橼酸-枸橼酸钠缓冲液(pH 4.4)新鲜配制的1%链脲佐菌素(STZ)溶液避光冰浴,25mg/kg,腹腔注射,正常对照组大鼠仅注射柠檬酸钠缓冲液25mg/kg。注射后第6、7 天连续2 次剪尾测随机血糖>16.7mmol/L 即可纳入实验组。
3.取材及标本制备:实验组及对照组大鼠继续高脂高糖和普通饮食喂养4 周后,禁食8h,称重测血糖,10%水合氯醛腹腔注射麻醉处死,立即分离胰腺置液氮保存,留待提取蛋白质。部分置于4%多聚甲醛溶液中固定,石蜡包埋、切片,制作石蜡切片,用于免疫组化及免疫荧光检测。
4.免疫荧光检测胰岛TCF7L2、β -catenin 组织表达及β细胞的增殖:将石蜡切片脱蜡水化,用柠檬酸抗原修复液进行抗原修复后,加入5%BSA 稀释的抗insulin(1∶100 稀释)、抗TCF7L2(1∶100 稀释)、抗β -catenin(1∶200 稀释)或抗Ki67(1∶200 稀释)抗体,二抗对照组加入等体积的5% BSA,置于4℃孵育过夜。PBS 洗3 次后,加入Alexa Fluor 488 标记的山羊抗兔IgG(H +L)(1∶400 稀释)和Cy3 标记的山羊抗小鼠IgG(H+L)(1∶300 稀释)混合液,室温下避光孵育1h。PBS洗3 次,加入终浓度为1μg/ml 的DAPI 溶液,置于室温避光孵育10min,以复染细胞核。用抗荧光淬灭封片液封片后在荧光显微镜下观察拍照,荧光强度用Image Pro Plus 6.0 软件进行分析。
5.免疫组化检测胰岛组织β 细胞凋亡:按照TUNEL 细胞凋亡检测试剂盒的操作说明书,检测凋亡细胞。Insulin 染色方法如上所述,二抗为碱性磷酸酯酶标记的山羊抗小鼠IgG(H+L)(1∶2000 稀释)。
6.Western blot 法检测TCF7L2 及β -catenin 蛋白表达:向冻存的胰腺组织加入适量Western 及IP 裂解液,用匀浆器充分研磨后,将组织匀浆液置于冰上振摇孵育30min,于4℃离心,13000g×10min,吸取上清液,用BCA 法测定蛋白质的浓度。每组各取50μg 总蛋白行SDS-聚丙烯酰胺凝胶电泳,将蛋白条带转印至PVDF 膜,用10%的脱脂奶粉于室温封闭3h后,分别加入1∶1000 稀释的兔抗TCF7L2 多克隆抗体、1∶2000稀释的兔抗β-catenin 单克隆抗体和1∶2000 稀释的兔抗βactin 单克隆抗体,置于4℃孵育过夜。TBST 洗3 次,分别加入1∶8000 稀释的辣根过氧化物酶(HRP)标记的山羊抗兔IgG(H+L)二抗和1∶5000 稀释的HRP 标记的山羊抗小鼠IgG(H+L)二抗,室温下孵育1.5h。用ECL 化学发光试剂盒显色,并行X 线片曝光。蛋白条带用凝胶成像系统扫描和进行灰度分析,以目的蛋白与β -actin 条带的灰度比值表示其相对表达量。
7.统计学方法:所有实验数据均进行正态性检验,并以均数±标准差(±s)表示,采用SPSS 17.0 软件分析。两组间用独立t 检验,多组间两两比较采用单因素方差分析(one -way ANOVA)。P <0.05 为差异有统计学意义。
结 果
光镜下观察正常对照组胰岛呈团状,边界清晰,细胞核呈椭圆形,胞质丰富,胰岛数量及岛内细胞数目较多,高倍镜/低倍镜视野中平均10 ~15 个胰岛。糖尿病模型组镜下胰腺组织中胰腺萎缩,胰岛数量减少,体积缩小,视野中平均5 ~8 个胰岛(图1)。
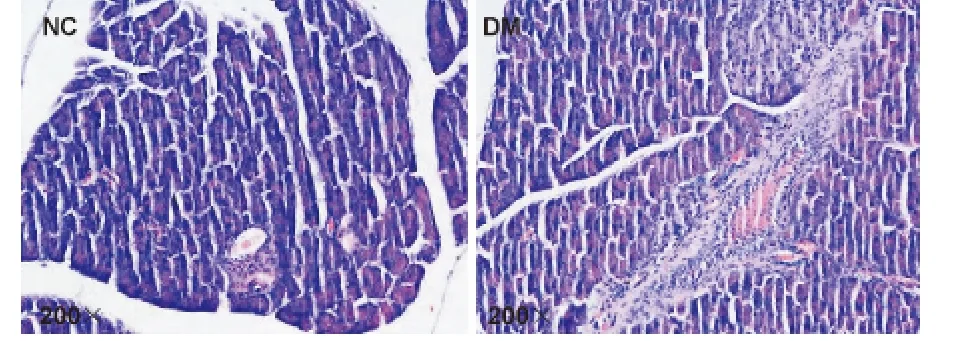
图1 HE 染色光镜下观察胰腺
Wistar 大鼠经高脂高糖饮食联合小剂量STZ 处理成模后,比较糖尿病模型组体重(BW)低于与对照组,差异无统计学意义(P >0.05)。糖尿病模型组血糖(BG)显著高于对照组,差异有统计学意义(P <0.05)。免疫荧光通过Ki67 及胰岛素双标检测胰岛细胞增值率9(图2)。Ki67 染色阳性代表增殖细胞,insulin 染色阳性代表胰岛β 细胞,镜下计数Ki67 + /Insulin+细胞和Insulin +细胞比值代表胰岛细胞增殖率。同样,TUNEL+细胞与Insulin+细胞比值代表胰岛细胞的凋亡率(图3)。DM 组胰岛细胞的增殖率高于NC 组,差异有统计学意义(P <0.05);DM 组胰岛细胞凋亡率明显高于NC 组,差异有统计学意义(P <0.05),详见表1。
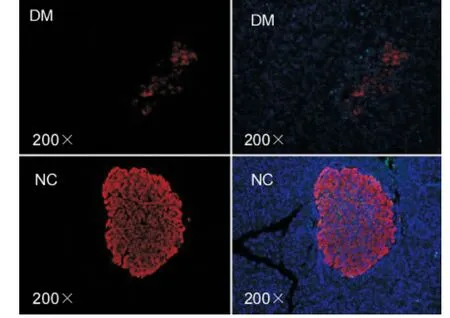
图2 Ki67 检测细胞增殖
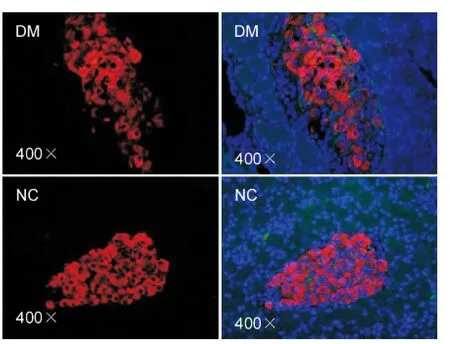
图3 TUNEL 检测细胞凋亡
取胰岛内TCF7L2 相对表达面积代表胰岛组织内TCF7L2 表达水平,结果显示DM 组胰岛细胞TCF7L2 表达显著高于正常对照组(P <0.05);β -catenin 表达差异不明显(图4、图5)。
Western blot 法检测糖尿病大鼠模型组TCF7L2蛋白表达水平高于正常对照组(P <0.05),详见图6,与免疫荧光检测结果一致。
讨 论
迄今为止,众多研究已经证实TCF7L2 与2 型糖尿病之间有着密切的联系。2006 年,两个前驱研究首次发现和提出了Wnt/β -catenin 信号调节的一个转录因子TCF7L2,其基因多态性与2 型糖尿病发病风险增加密切相关。并在随后的不同国家和人种群体中进行了大量的遗传学研究,均证实了转录因子TCF7L2 是2 型糖尿病的最强易感基因[1]。但是TCF7L2 的遗传变异性对2 型糖尿病发病风险的具体影响机制仍然不详。TCF7L2 在多种组织中表达,其中包括胰腺,毫无疑问,TCF7L2 可以直接影响胰腺胰岛β 细胞的功能。但是TCF7L2 的转录与翻译要受到多种因素包括细胞内各种微环境影响,同时,它可以通过多种转录途径调控下游靶基因的表达,实现对胰岛β 细胞功能及数量的作用及影响[2]。
表1 模型组与对照组体重、血糖及增殖、凋亡比较(±s)
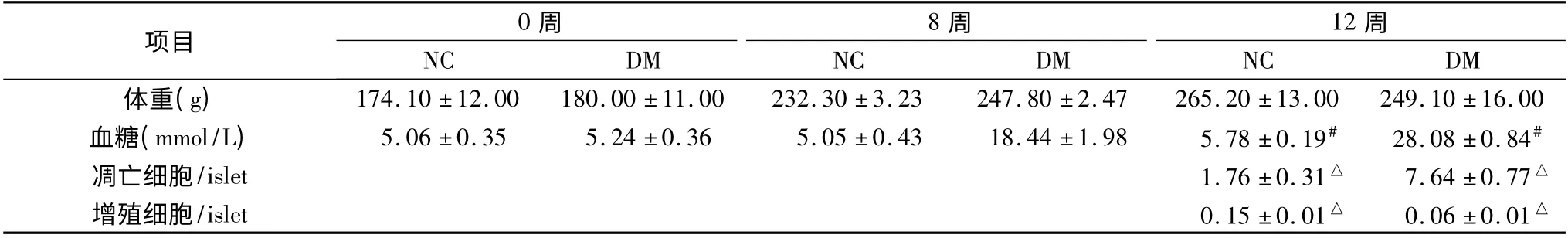
表1 模型组与对照组体重、血糖及增殖、凋亡比较(±s)
NC.正常对照组;DM.糖尿病大鼠模型组;与NC 组比较,△P <0.05,#P <0.01
项目 0周8周12周NC DM NC DM NC DM体重(g) 174.10 ±12.00 180.00 ±11.00 232.30 ±3.23 247.80 ±2.47 265.20 ±13.00 249.10 ±16.00血糖(mmol/L) 5.06 ±0.35 5.24 ±0.36 5.05 ±0.43 18.44 ±1.98 5.78 ±0.19# 28.08 ±0.84#凋亡细胞/islet 1.76 ±0.31△ 7.64 ±0.77△增殖细胞/islet 0.15 ±0.01△ 0.06 ±0.01△
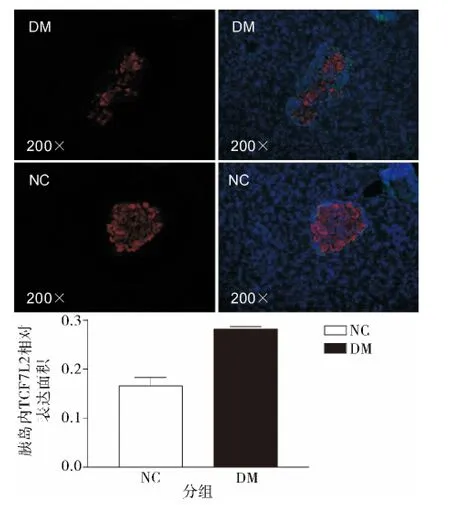
图4 免疫荧光检测TCF7L2 表达:
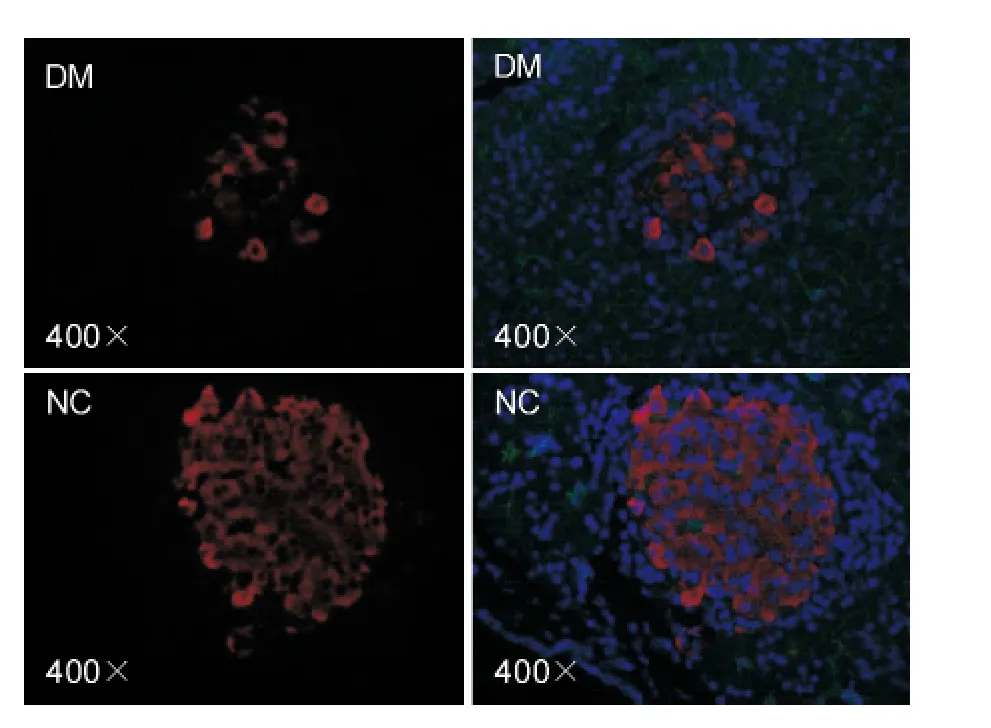
图5 免疫荧光检测β-catenin 表达
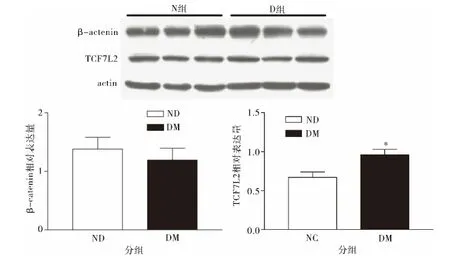
图6 Western blot 法检测TCF7L2 及β-catenin 表达
尽管Wnt 通路及其关键基因TCF7L2 与2 型糖尿病发病有着密切相关性已成共识,但是目前研究关于Wnt 通路及TCF7L2 对胰岛的具体作用还存在很多的未知和分歧。细胞内存在着纵横交错的复杂的调控网络体系,Wnt 通路可能与胰岛素、FOXO 等其他信号通路之间互相影响及作用,实现对体内葡萄糖及其他代谢平衡的调控[3]。同样,Wnt 信号通路对胰岛细胞的作用也是一个复杂得过程。笔者在前期的细胞系研究中发现,Wnt 不仅可以通过激活下游TCF7L2 的转录活性,调节与β 细胞生长和功能密切相关的靶基因的表达,实现对胰岛细胞的直接作用,还可能通过胰岛素信号通路中IRS - 2 及其下游PI3K/AKT 通路,间接调节胰岛β 细胞增殖、凋亡及胰岛素释放功能[4]。
本研究中,笔者采用传统的高脂、高糖饮食诱导肥胖及胰岛素抵抗大鼠,小剂量STZ 诱导胰岛β 细胞的损伤,使其胰岛素分泌功能缺损,构建模拟人类2 型糖尿病大鼠模型。糖尿病组大鼠血糖显著高于正常对照组大鼠。胰腺组织的HE 染色提示胰腺萎缩及胰岛的数量减少。而且通过对两组大鼠胰腺组织的石蜡切片免疫组化检测,发现糖尿病大鼠组中胰岛细胞凋亡增加,增殖减少。同时,笔者采用免疫荧光及Western blot 法检测了胰腺组织的TCF7L2 及β-catenin 的表达,发现糖尿病大鼠的TCF7L2 和β -catenin 的表达是明显高于正常对照大鼠的。TCF7L2及β-catenin 是Wnt 信号通路中的关键效用靶基因,TCF7L2 表达增多提示Wnt 通路的激活状态,研究结果提示糖尿病大鼠的Wnt 通路可能是处于激活的,而正常对照大鼠的Wnt 通路处于相对静息状态。Wnt 通路的激活/TCF7L2 的增加是糖尿病发生的因还是果?TCF7L2 对胰岛细胞究竟是保护还是损伤作用仍是未知的。早期Schinner 等[5]通过体外分离培养人和小鼠的原代胰岛β 细胞发现,抑制TCf7L2 表达后,胰岛β 细胞的凋亡增加,增殖减少,胰岛素分泌减少,相反使TCf7L2 过表达后,则可以保护β 细胞的糖毒性和细胞因子毒性。体外细胞实验显示TCF7L2 表达增加,促进胰岛细胞增殖及胰岛素释放,而糖尿病患者或危险基因携带者胰岛β 细胞中TCF7L2 表达是增加的[6]。本研究发现糖尿病大鼠模型中的TCF7L2 表达是增加的,结果提示TCF7L2可能对胰岛细胞有潜在的破坏作用,这个与之前在细胞系研究中所得出TCF7L2 对胰岛细胞的保护作用结论却是相悖的[6,7]。同样另外一项研究发现,在不同的啮齿类动物的2 型糖尿病模型中,胰岛的TCF7L2 的mRNA 水平是升高的,但是蛋白水平却是降低的[7]。
这些来自不同研究所得出的关于TCF7L2 在胰岛中发挥有利或有害作用这些看似相互矛盾的结论,可能与TCF7L2 在同一种细胞内,有不同的表达形式即剪接体有关(不同的剪接体,它们转录的模版是一样的,但外显子不太一样,所以翻译成蛋白后功能会有差异;还有可以指蛋白的修饰水平不同,比如乙酰化修饰、磷酸化修饰等)。最近的一项研究结果显示,胰岛β 细胞中不同表达形式的TCF7L2 会对细胞的生存、功能和Wnt 激活产生相反的作用[8]。
综上所述,TCF7L2 可能通过在细胞内形成不同的剪接体选择性作用于胰岛β 细胞的增殖、凋亡及功能,从而成为胰岛细胞损伤及2 型糖尿病发生的一个重要因素。但是有关2 型糖尿病的TCF7L2 风险单核苷酸多态性与TCF7L2 的选择性剪切之间的重要关联仍有待于开展进一步研究。在TCF7L2 的编码区、或确定能影响TCF7L2 表达及可变剪接的区域内,并没有出现能导致2 型糖尿病的风险性单核苷酸多态性。TCF7L2 对胰岛β 细胞的作用和影响是极其复杂的,笔者预测在不久的将来,人们会对胰岛及胰腺外组织的TCF7L2 单核苷酸多态性和其可变剪接之间的关系会进行更深入地探索。通过对不同组织内的各种TCF7L2 剪接体正反效应的研究,能够更进一步阐明2 型糖尿病的发病机制,并为糖尿病的治疗和预防提供新的思路。
1 Grant SF,Thorleifsson G,Reynisdottir I,et al. Variant of transcription factor 7 -like 2 (TCF7L2)gene confers risk of type 2 diabetes[J].Nat Genet,2006,38:320 -323
2 Renström E. Impact of transcription factor 7 - like 2 (TCF7L2)on pancreatic islet function and morphology in mice and men[J].Diabetologia,2012,55:2559 -2561
3 Ip W,Chiang YT,Jin T. The involvement of the wnt signaling pathway and TCF7L2 in diabetes mellitus:the current understanding,dispute,and perspective[J]. Cell Biosci,2012,2:28
4 Gui SY,Yuan G. Wnt3a regulates proliferation,apoptosis and function of pancreatic NIT -1 beta cells via activation of IRS2/PI3K signaling[J]. J Cell Biochem,2013,114:1488 -1497
5 Schinner S,Willenberg HS,Schott M,et al. Pathophysiologicall aspects of Wnt—signaling in endocrine disease[J]. Horm Metab Res,2009,41:159 -163
6 Shu L,Sauter NS,Schulthess FT,et al. Transcription factor 7 - like 2 regulates B cell survival and function in human pancreatic islets[J].Diabetes,2008,57:645 -653
7 Shu L,Matveyenko AV,Kerr-Conte J,et al.Decreased TCF7L2 protein levels in type 2 diabetes mellitus correlate with downregulation of GIP- and GLP -1 receptors and impaired beta - cell function[J].Hum Mol Genet,2009,18:2388 -2399
8 Le Bacquer O,Shu L,Marchand M,et al.TCF7L2 splice variants have distinct effects on betacell turnover and function[J]. Hum Mol Genet,2011,20:1906 -1915
