改良小鼠尾静脉注射器联合微量注射泵在Micro-CT 碘海醇增强造影中的应用
2015-01-16王艳杰阿不来海提张宏伟吴向未冯文磊
王艳杰 阿不来海提 张宏伟 吴向未 冯文磊 张 猛
啮齿类动物因体积小、实验重复性和可控性好、且成本低廉而成为科学研究中最为广泛使用的动物模型[1]。Micro-CT,又称微型CT 或小动物CT,具有微米级的分辨率。它以较低的辐射剂量和高质量的容积测量影像及定量分析功能,为小动物成像研究提供解决方案,在临床前生物医学无创成像方面得到广泛应用[2,3]。Micro -CT 对一些疾病模型(如肿瘤模型、包虫病模型等)的研究,很多情况下要动态观察模型的发生、发展过程,这就需要保证小动物存活。扫描前,先将造影剂经尾静脉注入小鼠体内,尾静脉穿刺成功与否很大程度上决定实验能否取得理想的结果。由于Micro-CT 专业造影剂价格较为昂贵,笔者尝试使用性价比较高的医用碘海醇造影剂,如何提高图像采集成功率及降低小鼠死亡率。在参照有关小鼠尾静脉穿刺实践的基础上,进一步改进穿刺设备及操作技术,运用于小鼠Micro - CT 腹部增强造影中,取得了良好效果。
对象与方法
1.实验动物及分组:健康昆明(KM)小鼠100 只,雌雄不限,6 ~8 周,体重20 ±2g,由石河子大学动物中心提供,随机分为5 组,每组20 只。应用5 组设备行尾静脉穿刺:①常规1ml 注射器及2.5#诺和锐针头;②常规1ml 注射器及4.5#针头;③常规输液器7#针头;④常规输液器5#针头;⑤改良4.5#针头及输液连接装置(图1)。
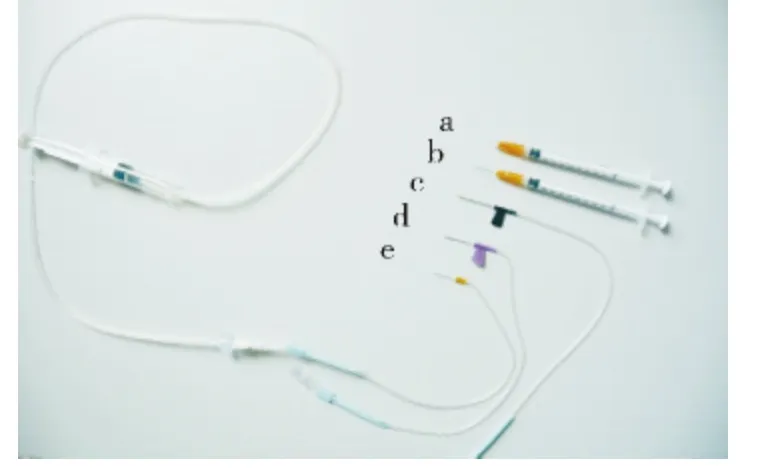
图1 各种型号注射器实物图
2.材料和器材:skyscan1176 Micro-CT 活体成像系统[美国布鲁克(Bruker)公司];PHD 22/2000 微量精密注射泵(美国Harvard 公司,精度为0.0001μl/h);VMR 小动物麻醉机[美国马特(Matrx)公司];异氟烷、普通医用碘海醇造影剂、常规1ml 注射器及2.5#诺和锐针头、常规1ml 注射器及4.5#针头、常规输液器7#针头、常规输液器5#针头、改良4.5#针头及输液连接器、75%乙醇、0.9%氯化钠溶液(250 毫升/瓶)均由石河子大学医学院第一附属医院提供。
3 改良注射器针头并高压灭菌后使用:将诺和锐2.5#针芯热嫁接到4.5#针头输液器的输液枕上,使输液器的7#和5#针头变为4.5#针头(图1e)。
4.图像采集过程:(1)尾静脉扩张:首先对小鼠尾部行备皮处理,之后将小鼠固定,仅尾部显露,鼠尾浸泡于50℃左右的温水中约2min,用酒精棉球擦拭尾部,以扩张尾静脉[4]。(2)操作方法:小鼠行Micro-CT 扫描前需禁食8h,禁水4h,以减小腹部气体干扰。使用3.4%异氟烷在麻醉挥发罐中使小鼠麻醉,调节合适的刻度,时刻观察小鼠生命体征,避免麻醉过度,实验过程中麻醉维持流量为300ml/min。待麻醉满意后,实验者将小鼠固定于Micro-CT 扫描床上,使用胶带将小鼠四肢和胸部固定,要求松紧度适宜。同时由助手调整小鼠位置,使一侧面小鼠尾静脉朝向正上方。穿刺部位选择尾部中下1/2 ~2/3 处。左手压住小鼠尾部远端,右手持针头,从选择的静脉正上方平行进针,利用可机械化设置泵入时间及剂量的微量注射泵持续注入约0.3ml 造影剂(无此设备可使用其他方式代替),穿刺成功后用输液贴牢固地固定在扫描床边缘。(3)图像采集:5 组穿刺设备经尾静脉注入碘海醇造影剂,利用Micro-CT 行增强造影扫描,获得扫描图像经系统软件进行图像重建,观察重建图像能否出现增强期。如图2 所示。(4)止血:分别行以上5 组操作后,操作者用左手拇指压住注射针头,撤离注射器,交由另一人用纱布压住穿刺部位反折尾部进行止血。(5)记录:记录穿刺过程中5 组设备的穿刺成功次数和扫描后小鼠死亡数目。

图2 注入碘海醇造影剂和不同设备穿刺后采集的图像
5.统计学方法:应用SPSS 17.0 软件进行统计学分析,计数资料组间比较选用卡方检验,以P <0.05 为差异有统计学意义。
结 果
经过实验验证,各种型号的注射器优缺点如下:①使用2.5#诺和锐针头的注射器,尾静脉注射成功率高,但不能在行CT 时持续泵入造影剂,另由于针体较短,固定时容易脱出;②常规1ml 注射器及4.5#针头,穿刺成功率较2.5#针头低,不能在行CT 时持续泵入造影剂;③常规输液器7#针头,穿刺成功率较4.5#针头低;④常规输液器5#针头,穿刺成功率较7#针头高,但较4.5#较低;⑤改良4.5#针头及输液连接装置,穿刺成功率高,在微量注射泵的配合下,可实现造影剂精准、持续的泵入且无人员暴露于辐射下,目前为最优配置。采用前4 组穿刺时,经尾静脉注射的造影剂很快便经过肾脏进行代谢,导致增强造影效果不明显。采用第5 组改良的方式进行小鼠尾静脉注射可以方便控制造影剂的出入量和速度,提高了穿刺的成功率和效率,同时达到了良好的造影效果。统计结果显示,各组间尾静脉穿刺成功率比较,差异有统计学意义(χ2=16.000,P =0.003),图像采集成功率比较,差异有统计学意义(χ2=13.429,P=0.009),小鼠死亡率比较,差异有统计学意义(χ2=11.905,P =0.018)。其中第1 组穿刺成功率最高为95%,图像采集成功率最低为42.10%,小鼠死亡率为30%;第2组穿刺成功率为80%,图像采集成功率为43.75%,小鼠死亡率为50%;第3 组穿刺成功率最低为50%,图像采集成功率为50.00%,小鼠死亡率为45%;第4组穿刺成功率为60%,图像采集成功率为58.33%,小鼠死亡率为15%;第5 组穿刺成功率为90%,图像采集成功率最高为94. 44%,小鼠死亡率最低为10%;综合评价各组穿刺成功率、图像采集率以及小鼠死亡率:第1 组穿刺成功率最高(95%),但图像采集率偏低,小鼠死亡率为30%(6 只);第4 组小鼠死亡率较低为15%(3 只),但穿刺成功率和图像采集率也较低;第5 组经改良的穿刺设备,穿刺成功率较高(90%),同时图像采集率达最高(94.44%),小鼠死亡率仅为10%(2 只),同时可以控制注射速度和剂量,就避免了一次性大剂量注射动物不能耐受的情况,有效控制了小鼠的死亡(图3)。
讨 论
适宜的环境温度对尾静脉扩张有一定影响,应保持实验室内温度在28℃左右,特别是在新疆维吾尔族自治区,在冬季较寒冷条件下,适宜的温度能够使血流通畅,降低穿刺阻力,另外应用热水浴浸泡法也可以使尾静脉扩张[5]。在进行穿刺时,可以通过回抽血来判断穿刺是否成功。使用改良组穿刺设备,穿刺后也较易固定,即使小鼠稍微活动也不会影响穿刺效果,在持针方式上,操作者用左手压住小鼠尾部远端向下压低稍倾斜,右手持针,斜面向上,从选择的静脉正上方平行进针,针尖紧贴皮下刺入血管后再进针约5mm,感觉无阻力后,稍回撤针见有回血,再轻推无阻力即可注射。在操作过程中,要避免采用其他不规范手式持针在针头扎入血管后又换手带来的针头位移问题。
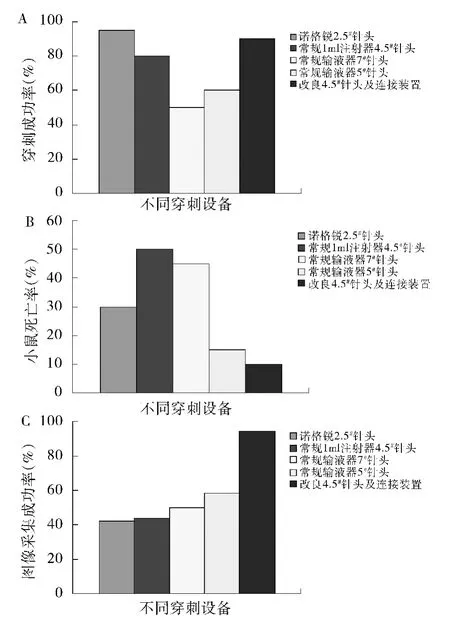
图3 不同穿刺设备的尾静脉穿刺成功率(%)、小鼠死亡率(%)、图像采集成功率(%)
一些科研工作者在进行Micro -CT 腹部脏器增强造影实验中,时常会涉及经小鼠尾静脉注射造影剂的问题。小鼠在正常生理体位下,尾部血管有4 根明显可见,即背腹面上各有一根动脉,两个侧面各有一根静脉,平均直径小于0.6 ±0.5mm[6]。通常情况下尾静脉注射有着起效快,血药浓度高等优势,但由于小鼠尾静脉较细,穿刺困难而限制了其使用[7,8]。另一方面,Micro -CT 增强成像使用的专用造影剂Microfil[9]、Aurovist - gold nanoparticle angiographic agent、Fenestra LC/VC 等,注入小鼠体内后可在相应脏器部位停留数小时,能够满足单次注射增强扫描,但价格较为昂贵,比普通医用造影剂要高几十倍以上[10,11]。小鼠尾静脉单次注射碘海醇造影剂的剂量一般不宜超过0.4ml,如果大剂量迅速推注,会容易造成小鼠超负载性猝死,特别是注射混悬型或高浓度造影剂时,更容易造成并发血管栓塞性猝死,所以应尽量控制好注射剂量和速度。笔者在实验中常采用的注射剂量为0.3ml,尽管如此,前4 组方式注射后有部分小鼠出现呼吸急促、窒息和心脏骤停等猝死现象,可能与造影剂进入太快,而导致的造影剂超载性猝死。若剂量过小,达不到造影效果,应尽量使剂量和造影效果均衡。使用正确的注射器规格也很重要,有研究者使用1ml 注射器以及2ml 和2.5ml 注射器也取得了一定的实验成果[12,13]。笔者也发现1ml 注射器的4.5#针头在尾静脉穿刺中有较好的成功率,而在小鼠Micro-CT 增强造影实践中发现上述方法也存在弊端,如不能持续将造影剂以小剂量缓慢按时间-剂量需要,送入鼠体,会导致图像采集失败。因此笔者采用的是改良4.5#针头及输液连接装置,配合微量注射泵,将造影剂持续泵入。
虽然Micro-CT 扫描时辐射剂量较低,但积累到一定程度同样对实验人员造成身体损害,碘海醇在小鼠体内代谢快,如果使用人工持续不断地将0.3ml 的造影剂推入鼠体会导致以下问题:①进入鼠体造影剂剂量不精确;②时间不易掌握;③CT 扫描时,辐射对实验人员身体损害大。利用微量注射泵,可以程序化设定注射时间以及造影剂注射的速率和剂量,这样就可以避免实验人员暴露于辐射源下。
经过改良的设备进行小鼠尾静脉注射,穿刺成功率、图像采集率和小鼠死亡率均有优化,与其余组相比差异有统计学意义。这种改良的穿刺方式,使得Micro-CT 扫描的基于碘海醇的腹部增强造影效果得到提升,降低了科研成本,这对于后续进行Micro -CT 增强造影的实验研究广泛开展提供非常必要的帮助。
1 安备,杜湘珂,霍天龙,等. SD 大鼠腹腔注射及尾静脉注射18F -FDG PET/CT 成像对比研究[J]. 医学研究杂志,2013,42(5):48 -51
2 秦波音,周文江. 小动物活体计算机断层Micro -CT(explore Locus)仪器介绍及应用[J].微生物与感染,2008,3(3):61 -62
3 王宝明. Micro-CT 系统几何校正算法研究及实现[D].西安:西安电子科技大学硕士论文.2012,3
4 温军业,问明,杨冬野,等. C57BL/6 小鼠鼠尾静脉注射不同方法的对比[J].中华实验外科杂志,2013,30(6):1317
5 孙美芳,黄德武. 热水浴浸泡法在大小鼠尾静脉注射中的应用[J].实验动物科学与管理,1999,16(3):36
6 苏丽娜,郭剑伟,饶光玲.小鼠尾静脉注射与断头取血实验技术的改进[J].大理学院学报,2010,9(6):25 -27
7 余绍兰,马跃荣.实验用小鼠尾静脉穿刺几点体会[J]. 泸州医学院学报,2007,30(4):330
8 陈育尧,黄雪玲. 小鼠尾静脉注射法[J]. 毒理学杂志,2008,22(4):311 -312
9 Vanden W,Schwarz J,Horssen P,et al. 3D imaging of vascular networks for biophysical modeling of perfusion distribution within the heart[J]. Journal of Biomechanics 2013,46(2):229 -239
10 David LC,Ashish A,Nicholas K,et al. Photoacoustic tomography of joints aided by an Etanercept - conjugated gold nanoparticle contrast agent—an ex vivo preliminary rat study[J]. Nanotechnology 2008;19(9):1 -6
11 Kevin C,Graham SA.Detombe,L T.et al. contrast -enhanced micro computed tomography using intraperitoneal contrast injection for the assessment of tumor - Burden in liver metastasis models[J]. Invest Radiol,2008,43:488 -495
12 彭艳,姚吉龙.大鼠尾静脉注射方法的比较[J].海南医学,2012,23(2):112
13 陈育尧,黄雪玲. 大鼠尾静脉注射法[J]. 南方医科大学学报,2009,29(6):1312
