电化学质子耦合电子转移分步机理的动力学特征
2015-01-13张文彬
张文彬
(宜春学院 化学与生物工程学院;江西省高校锂电新能源工程技术研究中心,江西 宜春 336000)
小分子电催化在能量转换领域中一直占据重要位置,[1,2]诸如在水和O2之间相互转换,O2、CH4和CO2的还原,H2的制备及氧化等过程中。高效电催化剂的要求是能最大化催化转化率及最小化催化过程所需过电势,而这依赖于对电催化机理的掌握。在能量转换领域的小分子电催化过程中,催化循环中往往包括电子转移及质子转移,这些质子和电子转移步骤可以统称为质子耦合电子转移过程,其机理由众多热力学参数及动力学参数决定。对质子耦合电子转移过程机理的研究将有助于对已有实验结果的解释,同时还能够帮助设计更为有效的用于能量转换领域的小分子电催化剂。
已有研究表明,[3]质子耦合电子转移机理主要分为分步机理和协同机理。具体地以单电子单质子转移过程为例,分步机理指的是质子-电子转移和电子-质子转移两种形式,其中经过高能态的中间体。协同机理中,反应物与质子给/受体及电子给/受体同时作用生成产物,这样就避免经过高能态的中间体。本文侧重探讨电化学质子耦合电子转移过程,其电子给/受体为电极,其质子给/受体一般为水,但不排除其他物质的可能性。[4,5]从量子力学出发,Hammes-Schiffer 等人已经建立了协同质子耦合电子转移机理的动力学公式,相关理论已经扩展到电化学体系,[6]然而,她们的工作并不易直接应用到实验中去。为更好地分析实验数据,Costentin 等人从经典动力学出发,推导了协同机理电化学质子耦合电子转移的表观速率常数的表达式,并成功应用到实际体系中。[7-9]
Laviron[10,11]、Finklea[12-14]、Costentin[15-17]及Burgess[18,19]分别对分步机理做过阐述,相对于协同机理而言,分步机理动力学理论较为简单,其相关公式是建立在电子转移理论及假设质子转移处于准平衡态基础之上的。也正因为分步机理动力学理论的简单性,研究人员对此机理的分析反而有所忽略不够。本文将重点探讨了解离常数及pH 值与表观速率常数的关系,特别是首次分析了表观标准速率常数随pH 值变化速率的问题。
1 模型
在分步机理理论的研究中,Finklea 在2001 年发表的一篇文章中推导了常见质子耦合电子转移体系(从1e1H 到2e2H)分步机理表观速率常数的表达式,[14]并重点讨论了电子传递系数随过电位变化对表观速率常数的影响。Costentin 等人也对分步机理模型进行过部分数据模拟。[17]基于已有的理论模型,张文彬于2012 年提出在分步机理中也存在动力学同位素效应。[19]即便如此,目前对分步机理的理论模型研究还是不够完善,还有许多的空白之处。为简化分析,本文以1e1H 为例,从前人的理论框架出发,着重讨论这样两个问题:1)解离常数对pH vs关系的影响;2)表观标准速率常数随pH 值变化的速率与pH 值的关系。
如图1 所示,对于此分步机理的单电子单质子转移过程,有两个转移途径:一是反应物A 得到电子生成A-,然后接受质子生成AH(ept);二是质子转移生成AH+,然后电子转移生成AH(pet)。描述此体系的参量有酸解离常数pK1和pK2,标准电极电位E01和,标准速率常数ks1和ks2。
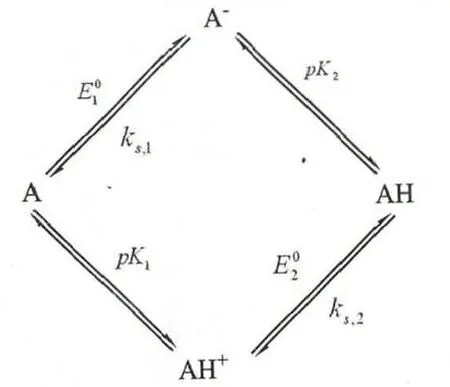
图1 单电子单质子转移过程分步机理示意图
根据能斯特方程,满足分步机理的反应A →AH 表观电位E0
app满足以下关系式:

其中∑(Ox)=[A]+[AH+]为氧化物浓度,∑(Red)= [A-]+[AH]为还原产物浓度。

综合式(1)和式(2),可得1e1H 转移分步机理表观电位的函数关系式为:


分步机理表观标准速率常数表达式在文献中已有详细推导,[17,19]依据Butler-Volmer 公式,可推知其表达式如下:
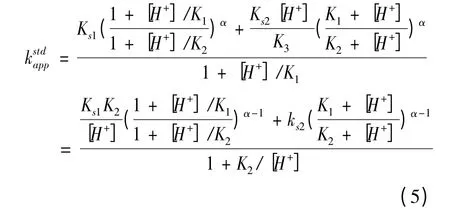
α 为电子转移传递系数,在此假设α = 0.5 ,可简化公式(5)得:

式(6)表明,分步机理表观标准速率常数与pH 值、酸解离常数及标准速率常数相关,与标准电极电位无关。
2 结果与讨论
由公式(6)可得图2 (在Excel 2010 中进行计算,后同),从图中可以看出,表观标准速率常数随pH 值变化的一个明显特征是,关系图呈“V”形,存在一个最小值()。从图2 还可以看出,随着解离常数差值的减小,表观标准速率常数最小值变大。表观标准速率值最大值为电子转移标准速率值,当pK2-pK1= 9 时,电子转移标准速率值为表观标准速率值的100 倍,而当pK2-pK1= 1时,其倍数为1.2。需要说明的是,当ks1≠ks2时,表观标准速率值最大值为ks1,ks2中的大值。

图2 还原态解离常数不同差值下表观标准速率常数随pH 值变化
注:(1:pK2= 12 ,pK1= 3 ;2:pK2= 10 ,pK1= 5 ;3:pK2= 8 ,pK1= 7 ,ks2= ks1= 1s-1)


本文首先从理论上讨论表观标准速率值处于最小值(kstdapp,min)时体系pH 值与ks2/ks1的关系。一般情况下有:

此时式(8)可以简化为:


为简化分析,本文讨论ks1= ks2条件下值的影响因素。
根据式(10)可得:

一般地,K1K2,通过对式(10)的分析可知,K1/K2越大,即pK2-pK1越大,越小。换句话说,体系中还原态解离常数差值越大,质子耦合电子转移机理越不倾向于分步机理,而倾向于协同机理,特别是在当pH = (pK1+pK2)/2 时,这一点在文献中有类似表述,[17]本文中给出了相关数学表达式。图3 依据式 (11)而得,如其所示,随pK2-pK1的下降不满足线性关系,pK2-pK1越大,值的减小就变得越慢。对于易表现为单电子耦合单质子转移的羟胺类、苯酚类化合物及酪氨酸,其pK2-pK1一般大于10,至少为表观标准速率值最大值,即ks1或ks2的1/158 倍。这也说明,在假定ks2= ks1的条件下,如果这些化合物的电荷转移遵循质子耦合电子分步机理,其表观标准速率值应至少为体系中电子转移标准速率值的1/158 倍,否则这些化合物的质子耦合电子转移应部分甚至全部遵循协同机理,这个特点可以用于粗略判断质子耦合电子转移体系的转移机理。

图3 随解离常数差值pK2-pK1 的变化(ks2 = ks1 = 1s-1 )

图4 不同条件下 随pH 值的变化
注:(1:pK2= 12 ,pK1= 3 ,ks2= ks1= 1s-1;2:pK2= 10 ,pK1= 5 ,ks2= ks1= 1s-1;3:pK2=12 ,pK1= 3 ,5ks2= ks1= 1s-1)。内图:与pH值关系图(——),与pH 值关系图(---)(pK2= 12 ,pK1= 3 ,ks2= ks1= 1s-1)。
3 结论
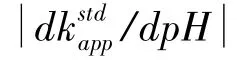
[1] Weinberg DR,Gagliardi CJ,Hull JF,et al.Proton-Coupled Electron Transfer[J].Chemical Review,2012,112(7):4016-4093.
[2]Solis BH,Hammes-Schiffer S.Proton-Coupled Electron Transfer in Molecular Electrocatalysis:Theoretical Methods and Design Principles[J].Inorganic Chemistry,2014,53(13):6427-6443.
[3]Mayer JM,Rhile IJ,Thermodynamics and kinetics of proton- coupled electron transfer:stepwise vs.concerted pathways[J].Biochimica et Biophysica Acta (BBA)-Bioenergetics,2004,1655(1-3):51-58.
[4] Bonin J,Costentin C,Robert M,et al.Pyridine as proton acceptor in the concerted proton electron transfer oxidation of phenol[J].Organic Biomolecule Chemistry,2011,9(11):4064-4069.
[5] Ishikita H,Soudackov AV,Hammes-Schiffer S.Buffer-Assisted Proton-Coupled Electron Transfer in a Model Rhenium-Tyrosine Complex[J].Journal of Americal Chemistry Society,2007,129(36):11146-11152.
[6]Venkataraman C,Soudackov AV,Hammes-Schiffer S.Theoretical Formulation of Nonadiabatic Electrochemical Proton-Coupled Electron Transfer at Metal-Solution Interfaces[J].Journal of Physical Chemistry C,2008,112(32):12386-12397.
[7]Costentin C,Evans DH,Robert M,et al.Electrochemical Approach to Concerted Proton and Electron Transfers.Reduction of the Water-Superoxide Ion Complex[J].Journal of Americal Chemistry Society,2005,127(36):12490-12491.
[8]Costentin C,Robert M,Savéant JM.Electrochemical concerted proton and electron transfers.Potential-dependent rate constant,reorganization factors,proton tunneling and isotope effects[J].Journal of Electroanalytical Chemistry,2006,588(2):197-206.
[9] Costentin C,Robert M,Savéant JM.Adiabatic and Non-adiabatic Concerted Proton-Electron Transfers. Temperature Effects in the Oxidation of Intramolecularly Hydrogen-Bonded Phenols[J].Journal of Americal Chemistry Society,2007,129(32):9953-9963.
[10]Laviron E,Roullier L.General expression of the linear potential sweep voltammogram for a surface redox reaction with interactions between the adsorbed molecules:applications to modified electrodes[J].Journal of Electroanalytical Chemistry,1980,115(1):65-74.
[11]Laviron E.General expression of the linear potential sweep voltammogram in the case of diffusionless electrochemical systems[J].Journal of Electroanalytical Chemistry,1979,101(1):19-28.
[12]Haddox RM,Finklea HO.Proton-Coupled Electron Transfer of an Osmium Aquo Complex on a Self-Assembled Monolayer on Gold[J].Journal of Physical Chemistry B,2004,108(5):1694-1700.
[13]Haddox RM,Finklea HO.Proton coupled electron transfer of galvinol in self-assembled monolayers[J].Journal of Electroanalytical Chemistry,2003,(550-551):351-358.
[14]Finklea HO.Consequences of a potential-dependent transfer coefficient in ac voltammetry and in coupled electron –proton transfer for attached redox couples[J].Journal of Electroanalytical Chemistry,2001,495(2):79-86.
[15]Costentin C,Robert M,Savéant JM,et al.Concerted and stepwise proton-coupled electron transfers in aquo/hydroxo complex couples in water:oxidative electrochemistry of[Os(II)(bpy)2(py)(OH2)]2+[J].ChemPhysChem,2009,10(1):191-198.
[16]Costentin C,Robert M,Savéant JM,et al.Concerted proton- coupled electron transfers in aquo/hydroxo/oxo metal complexes:electrochemistry of[OsII(bpy)2py(OH2)]2+in water[J].Proceedings of the National Academy of Sciences,2009,106(29):11829-11836.
[17]Anxolabehere-Mallart E,Costentin C,Policar C,et al.Proton-coupled electron transfers in biomimetic water bound metal complexes.The electrochemical approach[J].Faraday Discussion,2011,148:83-95.
[18]Zhang W,Burgess IJ.Step-wise proton-coupled electron transfer extended to aminobenzoquinone modified monolayers[J].Physical Chemistry Chemical Physics,2011,13(6):2151-2159.
[19]Zhang W,Burgess IJ.Kinetic isotope effects in proton coupled electron transfer[J].Journal of Electroanalytical Chemistry,2012,668:66-72.
